中国沿海寄生性病原血卵涡鞭虫(Hematodinium sp.)的遗传多样性研究*
肖 洁 张学雷① 刘瑞娟 李才文
(1. 国家海洋局第一海洋研究所 青岛 266061; 2. 海洋生态环境科学与工程国家海洋局重点实验室 青岛 266061;3. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 青岛 266071)
血卵涡鞭虫(Hematodinium sp.)是一类感染蟹、虾等海洋甲壳动物中的寄生性甲藻(parasitic dinoflagellate);该寄生性甲藻能够在宿主的血淋巴和心脏、肝胰腺等器官的血腔内大量繁殖, 进而导致宿主呼吸、代谢等机体功能紊乱直至死亡(Stentiford et al, 2005)。自20世纪30年代, 法国科学家Chatton等(1931)首次在法国近海的绿蟹(Carcinus maenas)和港口蟹(Liocarcinus depurator)中发现并报道了该类寄生性甲藻以来, 研究人员相继在欧洲英吉利海峡和大西洋沿岸、美国东部沿海、阿拉斯加沿岸和加拿大西海岸, 以及澳大利亚等海域的40多种甲壳动物宿主发现该寄生性甲藻感染 (Shields, 1994; 李才文等,2014)。血卵涡鞭虫在多种重要的海洋经济甲壳动物中的大规模流行, 造成了巨大的经济损失(Field et al,1992; Messick et al, 2000; Sheppard et al, 2003;Stentiford et al, 2005)。2004年, 许文军等(2007a, b)在我国浙江沿海的养殖三疣梭子蟹以及广东汕头海域的青蟹中发现了血卵涡鞭虫感染, 并发现该寄生性病原是造成养殖三疣梭子蟹“牛奶病”和青蟹“黄水病”的主要病原之一。随后, 研究人员在我国沿海其他地区的养殖虾蟹类中发现和报道了这类寄生性甲藻的流行(Li et al, 2008, 2013; 吴清洋等, 2010; Xu et al, 2010; 刘顺等, 2014)。
近年来, 基于 DNA序列的分子标记为鉴定和诊断该寄生性甲藻提供了新的技术手段; 并且, 随着国际基因数据库(Genbank)中Hematodinium相关基因序列数据日益增多, 一些种间或株系间的遗传差异逐渐被发现。Hudson等(1996)最早发现不同宿主中的Hematodiniumspp.有着较大的遗传差异; 随后, 研究人员通过对 ITS1和 SSU这两个位点的测序和分析,发现不同宿主和不同地区的株系在这两个位点上有一定的碱基序列差异(Hamiltonet al, 2010; Jensenet al, 2010; Smallet al, 2012)。
已有研究和报道表明, 在我国发现的这种血卵涡鞭虫的发生、流行与其他国家和地区相比存在明显差异。例如: 在广东汕头牛田洋养殖基地感染青蟹的血卵涡鞭虫株系发生在低盐水体中(<9ppt), 这与国际上普遍认为的Hematodiniumspp.流行于高盐水体中(>18ppt)有明显分歧。另外, Xu等(2010)首次在对虾中发现了该寄生性甲藻感染, 初步研究表明其与感染该区域梭子蟹和青蟹的血卵涡鞭虫具有相近的遗传关系(相似度为99%)。随后, Li等(2013)发现山东沿海的株系存在一定的遗传多态性, 且在我国沿海流行的这种血卵涡鞭虫(Hematodiniumsp.)与寄生于美国东海岸兰蟹(Callinectes sapidus)中的株系遗传关系比较接近。然而, 以上研究中涉及的遗传信息有限,相关分析尚不足以阐明我国发现的血卵涡鞭虫群体是否存在遗传多样性以及不同地理群体间是否存在遗传差异等问题。
因此, 本研究采用核糖体基因中突变频率相对较高的分子标记(5.8S、ITS1和ITS2核糖体间区序列),研究我国沿海不同地理群体和不同宿主群体的血卵涡鞭虫种下水平的遗传差异, 并进一步分析了我国沿海血卵涡鞭虫群体的遗传多样性和遗传结构, 及其与其他国家和地区血卵涡鞭虫群体的遗传关系,以期为明确我国沿海血卵涡鞕虫株系的分类地位提供一定的科学依据, 并为渔业生产中预防和控制该病害的发生提供理论指导。
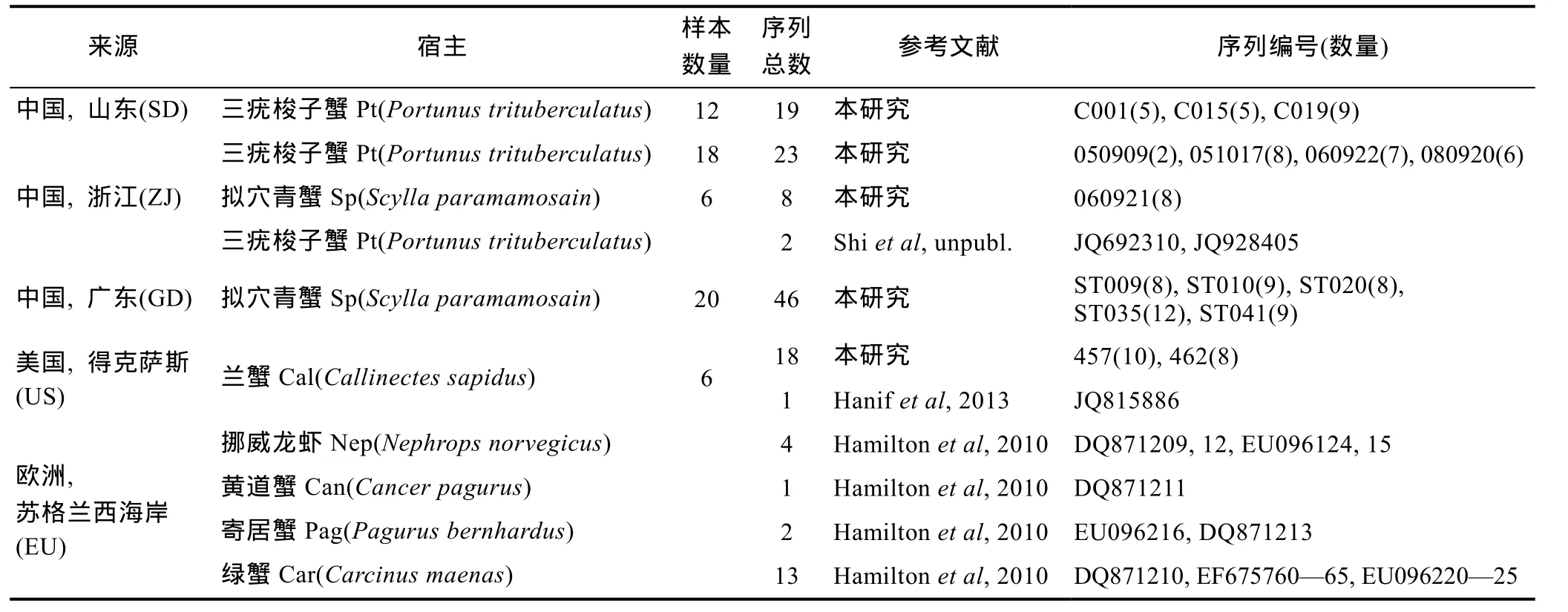
表1 本研究所用rDNA序列来源、宿主及样本数量Tab. 1 Sources, hosts, and sample sizes of rDNA sequences used in this study
1 材料与方法
1.1 血卵涡鞭虫DNA样品采集
感染血卵涡鞭虫的三疣梭子蟹(Portunus Trituberculatus)和拟穴青蟹(Scylla paramamosain, 曾用名锯缘青蟹S. Serrata[林琪, 2008])样本, 于2012年 6—9间分别采自山东省、浙江省、广东省沿海的养殖池塘(表 1); 美国得克萨斯沿岸的兰蟹样本由德克萨斯农工大学(Texas A&M University) J. Gain博士采集。采集的螃蟹样本经血淋巴中性红染色方法(Stentifordet al, 2005)确认感染后, 用无菌注射器抽取病蟹血淋巴于95%酒精固定, 冷藏保存。提取DNA时, 取200μL酒精固定的血淋巴, 低速(约8000r/min)离心3分钟后弃上清; 加500μL双蒸水洗涤沉淀, 再低速离心3分钟, 弃上清; 然后加定量裂解液, 根据E.Z.N.ATM动物组织 DNA提取试剂盒 (Omega Bio-Tek, USA)说明书提取样品基因组DNA。
1.2 分子标记目标片段扩增和测序
利用特异性引物(正向: 5′-CCTGGCTCGATAGA GTTG-3′; 反向: 5′-TCCTCCGCTTATTGATATGC-3′;Hamiltonet al, 2010)扩增血卵涡鞭虫核糖体 5.8S rDNA基因和核糖体间区1、2基因(ITS1, ITS2)。PCR扩增反应体系包括: 1×PCR反应缓冲液, 终浓度为1.5mmol/L的MgCl2, 0.4mmol/L的dNTPs, 0.1mg/mL BSA, 0.02U/μL Taq酶(TaKaRa, 中国大连), 引物终浓度各为 0.5pmol/μL, 1μL DNA 模板(约 50ng)。PCR 反应循环: 95°C预变性2分钟, 然后94°C变性30秒、57°C退火45秒、72°C延伸30秒、共35个循环, 最后72°C延伸10分钟。反应产物经1%(W/V)琼脂糖凝胶电泳, 溴化乙啶(EtBr)染色后, 于紫外灯下观察并成像。
用 E.Z.N.A.TM割胶回收试剂盒(Omega Bio-Tek,USA), 将目标片段(约 1.2 kb)割胶回收。然后利用TaKaRa T载体链接试剂盒将回收的目标片段连接至pMDTM19 T-Vector, 并转化至感受态大肠杆菌DH5α。重组子经含有 X-Gal和 IPTG的平板蓝白斑筛选后, 选择含有目标片段的菌落进行测序(上海美吉生物医药科技有限公司)。
1.3 基因序列比对和遗传关系分析
为比较我国发现的血卵涡鞭虫(Hematodinium sp.)与其他国家、地区株系的遗传差异, 从NCBI基因数据库(www.nlm.nih.gov)中下载同时包含有 ITS1和ITS2的代表性序列(表1), 其中包括2条来自中国的序列(Accession nos. JQ928405, JQ692310), 20条欧洲的序列(DQ871209—DQ871213, EF675760—EF675765,EU096214—EU096225), 和 1条来自美国的序列(JQ815886)。用MacVector 13.0软件包(MacVector Inc.,美国)中的Muscle方法(Edgar, 2004)对下载序列以及本研究所得序列进行比对分析。
比对后的序列导入PAUP 4.0(Swofford, 2002)软件, 计算遗传距离, 并用邻接法(Neighbor-joining, NJ)和最大似然法(Maximum-likelihood, ML)构建分子系统树, 并进行 1000次自举分析(bootstrapping)检验系统树的可信度。
另外, 选取来源于我国的血卵涡鞭虫的代表性序列, 依据统计简约法(Statistical Parsimony Network,SPN)原理, 用TCS软件(Clement et al, 2000)构建序列的单倍型(Haplotype)网络图。
2 结果
2.1 血卵涡鞭虫基因型和出现频率
利用特异性PCR扩增, 从56个来自我国沿海的感染血卵涡鞭虫的螃蟹样本中共获得 96条序列; 获得的特异性片段总长 1203—1208bp (不包括引物),其中包含ITS1约427bp, ITS2约393bp。从美国兰蟹样本扩增产生 18条序列, 片段总长为 1218—1221bp。通过序列比对, 本研究得的中国株血卵涡鞭虫的序列与施慧等(Shi et al, unpubl.)提交GenBank的两条序列(JQ928405, JQ692310)相似度达 99.1%—99.9%; 而本研究所得的美国株血卵涡鞭虫的序列与Hanif等从美国东海岸环境样品中测得的序列(JQ815886; Hanif et al, 2013)基本一致(相似度为99.8%—99.9%)。统计分析显示, 来自我国沿海的血卵涡鞭虫序列可以分成 14个单倍型(Haplotype); 其中单倍型ST041a有45条序列, 在我国沿海的出现频率为45.9%, 单倍型060922和ST030分别有15条和13条, 发生频率为 15.3%和13.3%, 其他的出现频率较低(<10%)。
根据样本采集的不同地理位置, 将本研究获得的序列分成山东(SD)、浙江(ZJ)和广东(GD)三个群体,结果表明: 山东群体的序列多态性最低, 总共只发现3种单倍型, 其中单倍型 ST041a出现频率最高, 达52.6%; 浙江群体共有 8个单倍型, 出现频率最高的两个单倍型为ST041a和060922, 频率分别为24.2%和45.5%; 广东群体共有 5个单倍型, 出现频率最高的是ST041a和ST030, 频率分别为58.7%和28.3%。按宿主种类不同, 将这些序列分成三疣梭子蟹(Pt)和拟穴青蟹(Sp)两个群体。寄生于三疣梭子蟹的血卵涡鞭虫序列中共发现 10个不同的单倍型, 其中单倍型ST041a和 060922出现频率较高, 分别为 22.7%和34.1%; 而宿主为青蟹的群体中, 共有 5个单倍型,其中 ST030和 ST041a的出现频率最高, 分别为24.1%和 64.8%(表 2)。
2.2 单倍型网络图
单倍型网络图(图 1)明确显示了在我国沿海发现的14个血卵涡鞭虫单倍型之间的碱基差异(1个节点代表1个碱基差异)。常见单倍型ST041a处于网络中心位置 。另外, 这些单倍型的变异顺序没有呈现明显的规律, 即来源于同一地理群体或宿主的单倍型随机分布于单倍型网络中, 没有集中于某一或某几个分支中; 而且, 单倍型 ST041a在各个地理群体和宿主群体中均有出现。
2.3 遗传距离与系统进化树
遗传距离分析表明, 我国沿海的血卵涡鞭虫株(CH)与美国株(US)遗传上较为相近, 遗传距离(D)为0.027; 而欧洲冷水株(EU)与中美两个群体的遗传差异较大, 遗传距离分别为0.236和0.259, 约为中美之间的十倍; 相较而言, 三个群体内部的遗传距离明显较小, 只有 0.001—0.003, 远小于中国群体与美国或欧洲群体之间遗传距离(表3)。
对于我国沿海三个群体(SD、ZJ和GD)的进一步分析后发现(表 3), 这三个群体之间的遗传距离(0.001—0.003)与三个群体内部的遗传距离(0.001—0.004)无明显差异; 另外, 按宿主群体划分后的进一步分析结果表明, 三疣梭子蟹(Pt)和青蟹(Sp)两个群体之间的遗传差异(0.002)与各自群体内部的(0.001—0.003)遗传差异也没有明显不同。
本研究中用最大似然法(ML)和邻接法(NL)构建的系统进化树基本一致, 都可以将所有血卵涡鞭虫序列分成三个独立的类群; 其中, 来源于欧洲的序列组成一支, 来源于中国和美国的序列各组成亲缘关系较近的姊妹支(图2)。然而, 来源于不同宿主的序列无明显聚类规律, 例如, 欧洲分支中来源于四种不同宿主(挪威龙虾、黄道蟹、寄居蟹和绿蟹)的序列相互交叉, 没有进一步分化聚类(图2)。

表2 14个单倍型在不同群体中的发生频率Tab. 2 The frequencies of 14 haplotype in all geographic and host populations
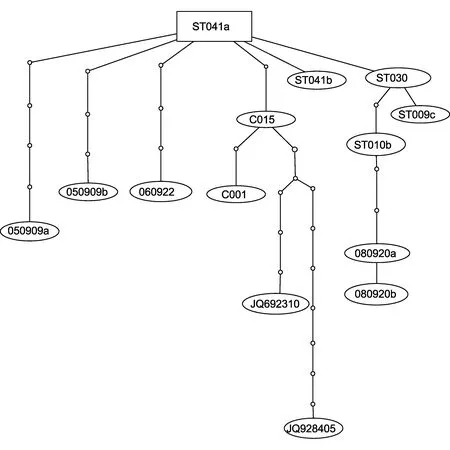
图1 14个在中国沿海发现的rDNA基因单倍型的TCS网络图Fig. 1 The TCS network of the 14 rDNA haplotypes observed along Chinese coast
3 讨论
本研究对我国山东、浙江和广东三地感染不同宿主的血卵涡鞭虫样本进行rDNA测序和遗传分析。结果表明, 我国沿海不同地理群体和侵染不同宿主的血卵涡鞭虫不存在明显的遗传差异, 应来源于同一自然群体; 我国沿海的血卵涡鞭虫群体为一独立的遗传株系, 与寄生于美国兰蟹的H.perezi基因型Ⅲ有显著的遗传差异(遗传距离D=0.027), 而与寄生于苏格兰龙虾和阿拉斯加雪蟹等冷水型动物中的株系遗传差异更大(D=0.236)。根据 Small等的分类体系(Smalletal2013), 我国沿海养殖蟹类中的血卵涡鞭虫可暂定为H.perezi基因型Ⅱ, 这与前人的研究结果一致(许文军等, 2007a; Xuet al, 2010; Liet al,2013)。
然而, 目前国际上对于血卵涡鞭虫的系统分类还存在一定的分歧。如前所述,H.perezi种下的三个基因型群体存在明显的遗传差异, 核糖体基因序列的差异高达2.7%—4.3% (Hudsonet al, 1996; Jensenet al, 2010; Smalletal, 2013), 与甲藻纲中众多常见种之间的遗传差异相当(Litakeretal, 2007; Sternetal,2012)。Small等人根据宿主类型、地理分布和遗传差异, 曾一度建议将感染美国兰蟹的血卵涡鞭虫定为独立的种, 不同于来源于欧洲黄道蟹的模式种H.perezi(基因型Ⅰ), 但终因缺少形态、生活史等方面的证据, 而将其定义为H.perezi种下的一个基因型(H.perezi基因型Ⅲ; Smallet al, 2012; Small, 2013)。Jesen等(2010)也发现感染阿拉斯加雪蟹的H.sp., 在核糖体小亚基基因的保守区核酸序列和二级结构上,与感染苏格兰龙虾的类似, 而与来自温带地区的两个基因型(H.perezi基因型Ⅰ和Ⅲ)存在明显的区别,暗示着流行于这些冷水地区的血卵涡鞭虫可能是不同于H.perezi的新种或类型。然而,Hematodinium属和H.perezi种下的确切分类地位, 还有待于在形态学、生活史和交叉感染实验等方面的进一步研究。在生活史研究方面, 仅有寄生于苏格兰龙虾和美国兰蟹中的株系完成了连续体外培养, 也发现了一些生活史阶段的差异(Appletonet al, 1998; Liet al, 2011)。对我国株系的研究, 以及与H.perezi另外两个基因型(Ⅰ和Ⅲ)的对比研究, 将有助于明确这几个基因型是否存在遗传信息以外的差异; 另外, 交叉感染实验可以研究这些地理株系是否存在明显的生殖隔离, 从而探讨这些群体的遗传差异的起因。这些研究可以为Hematodinium属下种或基因型的界定提供一定的依据和帮助。

表3 不同群体之间的遗传距离(D)Tab.3 The pairwise genetic distances (D) among populations from different geographic locations and hosts
我国的血卵涡鞭虫株系可以感染多种甲壳类宿主。本研究发现取自各个地理群体或宿主群体的株系,遗传相似度达 99.7%—99.9%, 远高于中国群体与美国或欧洲群体之间的相似度(分别为 97.3%、76.4%),表明我国养殖蟹类中的血卵涡鞭虫群体遗传差异较小, 属于同一个群体。我们进一步分析了我国血卵涡鞭虫群体单倍型遗传关系及发生频率, 发现该群体存在一定的遗传多态性, 总共发现了 14个不同的单倍型, 其中单倍型 ST041a在各个群体中都有出现,且频率较高。然而, 根据这些单倍型的变异顺序(图1)以及在各个群体的发生频率(表 2), 发现这些单倍型的变异和分布, 没有明显的规律。因此, 可推断我国沿海三地和不同宿主中的Hematodinium群体未发生明显的遗传隔离, 应为同一株系、同一群体。与此类似, Pagenkopp Lohan等(2012; 2013)发现流行于美国东海岸兰蟹中的Hematodinium株(即H.perezi,Genotype Ⅲ), 分布南至得克萨斯、北至麻塞诸塞州沿岸, 能够感染寄居蟹、桡足类等其它 7种甲壳类,而且无明显遗传差异; 另外, 在欧洲大西洋沿岸也发现报道了能侵染多种宿主的Hematodinium株系(Hamiltonet al, 2010)。由此, 有学者认为血卵涡鞭虫是一类“泛宿主(host generalist)” 寄生性病原(Hamiltonet al, 2010; Pagenkopp Lohanet al, 2012)。另外, 国外其它地区的Hematodiniumspp.普遍流行于高盐度水体环境中(>18ppt; Stentifordet al, 2005),而我国发现的血卵涡鞭虫株能够在低盐水域(<9ppt)流行(Liet al, 2008)。我国发现的这类寄生性甲藻病原为何对盐度有如此广泛的适应性, 以及这类病原如何规避不同种类甲壳动物宿主的免疫机制而导致感染等, 都值得进一步探讨。相关科学问题的阐释有助于针对现行养殖模式提出合理建议, 进而避免这类“泛宿主”型流行性病原在不同种类养殖动物中进一步传播扩散。
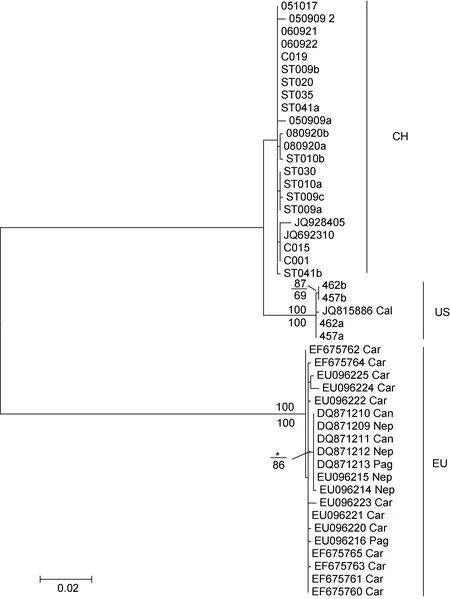
图2 基于rDNA序列构建的Hematodinium spp.系统进化树。Fig.2 Phylogenetic analysis on Hematodinium spp. in rDNA sequence
刘 顺, 戴瑜来, 周素明等, 2014. 拟穴青蟹(Scylla paramamosain)血卵涡鞭虫病的流行病学分析.海洋与湖沼, 45(3): 595—601
许文军, 施 慧, 徐汉祥等, 2007a. 养殖梭子蟹血卵涡鞭虫感染的初步研究. 水生生物学报, 31(5): 637—640
许文军, 绳秀珍, 徐汉祥等, 2007b. 血卵涡鞭虫在养殖锯缘青蟹中的寄生. 中国海洋大学学报, 37(6): 916—920
李才文, 许文军, 2014. 海水甲壳类寄生性甲藻Hematodinium spp.研究进展. 海洋与湖沼, 45(1): 1—11
吴清洋, 李远友, 夏小安等, 2010. 汕头牛田洋沿海围垦区锯缘青蟹病害爆发的环境因素. 生态学报, 30(8): 2043—2048
Appleton P L, Vickerman K V, 1998. In vitro cultivation and development cycle in culture of a parasitic dinoflagellate(Hematodinium sp.) associated with mortality of the Norway lobster (Nephrops norvegicus) in British waters. Parasitology,116(Pt 2): 115—130
Chatton E, Poisson R, 1931. Sur l’existence, dans le sang des Crabes, de Péridiniens parasites: Hematodinium perezi n. g.,n. sp. (Syndinidae). Compes Rendu Sceances Soc Biol Paris,105: 553—557
Clement M, Posada D, Crandall K A, 2000. TCS: a computer program to estimate gene genealogies. Molecular Ecology,9(10): 1657—1659
Edgar R C, 2004. MUSCLE: multiple sequence alignment with high accuracy and high throughput. Nucleic Acids Research,32(5): 1792—1797
Field R H, Chapman C J, Taylor A C et al, 1992. Infection of the Norway lobster Nephrops norvegicus by a Hematodinium-like species of dinoflagellate on the west coast of Scotland.Diseases of Aquatic Organisms, 13: 1—15
Hamilton K M, Morritt D, Shaw P W, 2010. Genetic diversity of the crustacean parasite Hematodinium (Alveolata, Syndinea).European Journal of Protistology, 46(1): 17—28
Hanif A W, Dyson W D, Bowers HA et al, 2013. Variation in spatial and temporal incidence of the crustacean pathogen Hematodinium perezi in environmental samples from Atlantic Coastal Bays. Aquatic Biosystem, 9(1): 11
Hudson D A, Adlard R D, 1996. Nucleotide sequence determination of the partial SSU rDNA gene and ITS1 region of Hematodinium cf. perezi and Hematodinium like dinoflagellates. Diseases of Aquatic Organisms, 24(1):55—60
Hudson D A, Shields J D, 1994. Hematodinium australis n. sp., a parasitic dinoflagellate of the sand crab Portunus pelagicus from Moreton Bay, Australia. Diseases of Aquatic Organisms, 19: 109—119
Jensen P C, Califf K, Lowe V et al, 2010. Molecular detection of Hematodinium sp. in Northeast Pacific Chionoecetes spp.and evidence of two species in the Northern Hemisphere.Diseases of Aquatic Organisms, 89(2): 155—166
Li C, Miller T L, Small H J et al, 2011. In vitro culture and developmental cycle of the parasitic dinoflagellate Hematodinium sp. from the blue crab Callinectes sapidus.Parasitology, 138(14): 1924—1934
Li C W, Song S Q, Liu Y et al, 2013. Hematodinium infections in cultured Chinese swimming crab, Portunus trituberculatus,in northern China. Aquaculture, 396—399: 59—65
Li Y Y, Xia X A, Wu Q Y et al, 2008. Infection with Hematodinium sp. in the mud crabs Scylla serrata cultured in low salinity water in southern China. Diseases of Aquatic Organisms, 82(2): 145—150
Litaker R W, Vandersea M W, Kibler S R et al, 2007.Recognizing dinoflagellate species using ITS rDNA sequences. Journal of Phycology, 43(2): 344—355
Messick G A, Shields J D, 2000. Epizootiology of the parasitic dinoflagellate Hematodinium sp. in the American blue crab Callinectes sapidus. Diseases of Aquatic Organisms, 43(2):139—152
Pagenkopp Lohan K M, Reece K S, Miller T L et al, 2012. The role of alternate hosts in the ecology and life history of Hematodinium sp. a parasitic dinoflagellate of the blue crab(Callinectes sapidus). Journal of Parasitology, 98(1): 73—84
Pagenkopp Lohan K M, Small1 H J, Shields J D et al, 2013.Conservation in the first internal transcribed spacer (ITS1)region of Hematodinium perezi (genotypeⅢ) from Callinectes sapidus. Diseases of Aquatic Organisms, 103(1):65—75
Sheppard M, Walker A, Frischer M E et al, 2003. Histopathology and prevalence of the parasitic dinoflagellate Hematodinium sp, in crabs (Callinectes sapidus, Callinectes similis,Neopanope sayi, Libiniae marginata, Menippemer cenaria)from a Georgia estuary. Journal of Shellfish Research, 22:873—880
Shields J D, 1994. The parasitic dinoflagellates of marine crustaceans. Annual Review of Fish Diseases, 4: 241—271
Small H J, 2013. Advances in our understanding of the global diversity and distribution of Hematodinium spp.—significant pathogens of commercially exploited crustaceans. Journal of Invertebrate Pathology, 110(2): 234—246
Small H J, Shields J D, Reece K S et al, 2012. Morphological and molecular characterization of Hematodinium perezi(Dinophyceae: Syndiniales), a dinoflagellate parasite of the harbour crab, Liocarcinus depurator. Journal of Eukaryotic Microbiology, 59(1): 54—66
Stentiford G D, Shields J D, 2005. A review of the parasitic dinoflagellates Hematodinium species and Hematodiniumlike infections in marine crustaceans. Diseases of Aquatic Organisms, 66(1): 47—70
Stern R F, Andersen R A, Jameson I et al, 2012. Evaluating the ribosomal internal transcribed spacer (ITS) as a candidate dinoflagellate barcode marker. PLoS ONE 7(8): e42780. doi:10.1371/journal.pone.0042780
Swofford D L, 2002. PAUP*: Phylogenetic Analysis Using Parsimony (*and other methods), Version 4. Sinauer,Sunderland, Mass.
Xu W J, Xie J J, Shi H et al, 2010. Hematodinium infections in cultured ridgetail white prawn, Exopalaemon carinicauda, in eastern China. Aquaculture, 300(1—4): 25—31

