大鹏澳牡蛎养殖对浮游植物种群结构的影响研究*
张 玲 李政菊 陈飞羽 江 涛, 吕颂辉 江天久
(1. 暨南大学赤潮与海洋生物学研究中心 广州 510632;2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071)
浮游植物是海洋中最重要的初级生产者, 其种类组成、群落结构和丰度变动直接或间接地制约着海洋生产力的发展。在海洋生态系统中浮游植物能改变海洋碳通量(Sarmiento et al, 1988)、云返照率(Charlson et al, 1987)以及海水的光通量与热通量(Sathendranath et al, 1991), 从而对全球气候产生影响。另外, 海洋浮游植物的群落结构可以灵敏且迅速地反映环境的变化, 不同的浮游植物群落结构决定了其在生态系统中的功能差异。海洋浮游植物群落与环境因素的相关性是当今海洋生态学研究热点之一。
已有研究表明, 海水中营养盐的含量和水体中滤食生物的生物量是影响水中浮游植物变动的主要因素(Newell, 2004)。王友绍等(2004)、Ma 等(2014)、Wang等(2009, 2014)对大亚湾(大鹏澳)的营养状况和浮游植物进行了研究, 发现近几十年来大亚湾(大鹏澳)已由贫营养状态发展到中营养状态, 局部海域出现富营养化, 生物群落组成明显小型化, 生物多样性降低。然而, 大亚湾海域有关贝类养殖对浮游植物种群结构影响的研究较少(Wang et al, 2009)。
20世纪90年代中期, 大鹏澳开始以延绳式平挂的方式吊养葡萄牙牡蛎(Crassostrea angulata)。近年来, 牡蛎已成为当地主要的养殖贝类, 大面积的牡蛎养殖区在该湾形成了一个独特的生态系统(于宗赫等,2014)。牡蛎作为大鹏澳主要养殖贝类, 具有很强的滤水能力, 主要滤食水体中的浮游植物、底栖微藻和悬浮颗粒有机物。牡蛎超负荷养殖将会造成浮游植物种类、数量和群落结构的改变(Wetz et al, 2002)。
本文根据 2013—2014年 4个季度的调查结果,对大鹏澳牡蛎养殖区浮游植物的群落结构和多样性进行了分析, 以期明确该海域牡蛎养殖对浮游植物丰度和种群结构的影响程度, 为大鹏澳生态环境评价及养殖业的可持续发展提供科学依据。
1 材料与方法
1.1 采样点的设置及采样方法
大亚湾大鹏澳位于大亚湾西南侧, 为半封闭型溺谷湾, 总面积约14km2, 平均水深为7m, 该海域的环境条件十分适合各类海产品的增养殖, 是广东沿岸二类海水增养殖区之一(于宗赫等, 2014)。本文在大鹏澳海域设置 3个采样点 S1(牡蛎养殖区)、S2(养殖区外)、S3(湾口)(图 1), 分别于 2013 年 8 月(夏季)、10 月(秋季)和 2014 年 2 月(冬季)、5 月(春季)进行了采样。垂向逐层采集水样(间隔1m), 取1L水样加入15mL鲁哥氏液固定, 运回实验室。采集的样品静置48h后吸去上清液, 浓缩至15mL。在使用显微镜计数时, 首先将样品充分摇匀, 吸取浮游植物样品 0.1mL滴入计数框内, 之后用视野法计数各个种的细胞数。
图1 大鹏澳浮游植物调查站位图Fig.1 Sampling stations of phytoplankton in Dapeng Cove
1.2 研究方法
物种多样性指数、均匀度及优势度分别采用以下公式计算:
香农-威纳指数(Shannon-Wiener H′) (Shannon and Weaver, 1949):
优势度值(Y) (孙军等, 2004)Y=(ni/N)×fi
式中, N为采集样品中所有物种的总个体数, s为采集样品中的物种总数, Pi为第i种的个体数与样品中所有物种的总个体数的比值; ni为第i种的总个体数, fi为第i种在各站位出现的频率, Y值大于0.02的种类为优势种。
2 结果
2.1 浮游植物种类组成与季节变化
大鹏澳水样共鉴定出58属144种藻类, 主要物种有硅藻、甲藻、蓝藻、金藻、隐藻、绿藻、裸藻等。其中硅藻无论是细胞丰度, 还是种类数量上都占优势。共鉴定出硅藻36属100种, 占总数种类的69.4%,其次为甲藻15属34种占总种类的23.6%, 蓝藻、绿藻、隐藻等共7属10种。浮游植物种类的季节更替十分明显。夏季(8月)水温最高, 盐度较低, 浮游植物中耐高温和盐度适应能力较强的种类占优势, 如柔弱拟菱形藻(Pseudo-nitzschia delicatissima)、中肋骨条藻(Skeletonema costatum)、柔弱根管藻(Rhizosolenia delicatula)、脆根管藻(Rhizosolenia fragilissima)等为硅藻中的优势种; 甲藻的优势种为叉状角藻(Ceratium furca)(表1)。秋季(10月), 硅藻和蓝藻成为优势种, 硅藻包括尖刺拟菱形藻(Pseudo-nitzschia pungens)、克尼角毛藻(Chaetoceros knipowitschi)和窄隙角毛藻(Chaetocero affinis); 蓝藻仅有丝状鞘丝藻(Lyngbya confervoides), 占细胞丰度百分比为6.58%。蓝藻仅在秋季成为优势种。冬季(2月)水温最低, 盐度最高, 浮游植物中仅硅藻为优势种。春季(5月), 水温回升且盐度降低, 甲藻所占百分比有所升高, 但仅微小原甲藻(Prorocentrum minimum)成为优势种, 硅藻依然占绝对优势。
2.2 浮游植物丰度的时空分布
大鹏澳各水层浮游植物丰度在 6.15×103—5.94×106cells/L之间, 10月浮游植物丰度最高, 其次为2月; 8月和5月浮游植物丰度较低(图2)。8月, 浮游植物丰度高值区出现在S2站位, 最高值出现在S2站位1m水层, 为6.16×105cells/L。牡蛎养殖区内(S1站)浮游植物丰度较低, 浮游植物丰度范围为0.89×105—2.67×105cells/L, 0—2m 水层丰度明显低于3m水层。10月, 浮游植物丰度出现两个高值区, 分别位于S1站位3m水层和S2站位1m水层, 丰度分别为 5.94×106和 3.25×106cells/L。S3站位 0—2m 水层也具有较高的浮游植物丰度, 但养殖区内 S1站位0—2m浮游植物丰度较低。2月, 浮游植物高值区主要出现在湾口 S3站位各水层, 其次为 S2站位。S3和 S2站位浮游植物平均丰度(分别为 16.0×105和9.26×105cells/L), 明显高于 S1站位(平均丰度为2.07×105cells/L)。5月, 浮游植物丰度较低, 高值区出现在牡蛎养殖区(S1站位), 最高值出现在 3m 水层(3.85×105cells/L)。

表1 2014年大鹏澳浮游植物优势种Tab. 1 Dominant species of phytoplankton in Dapeng Cove
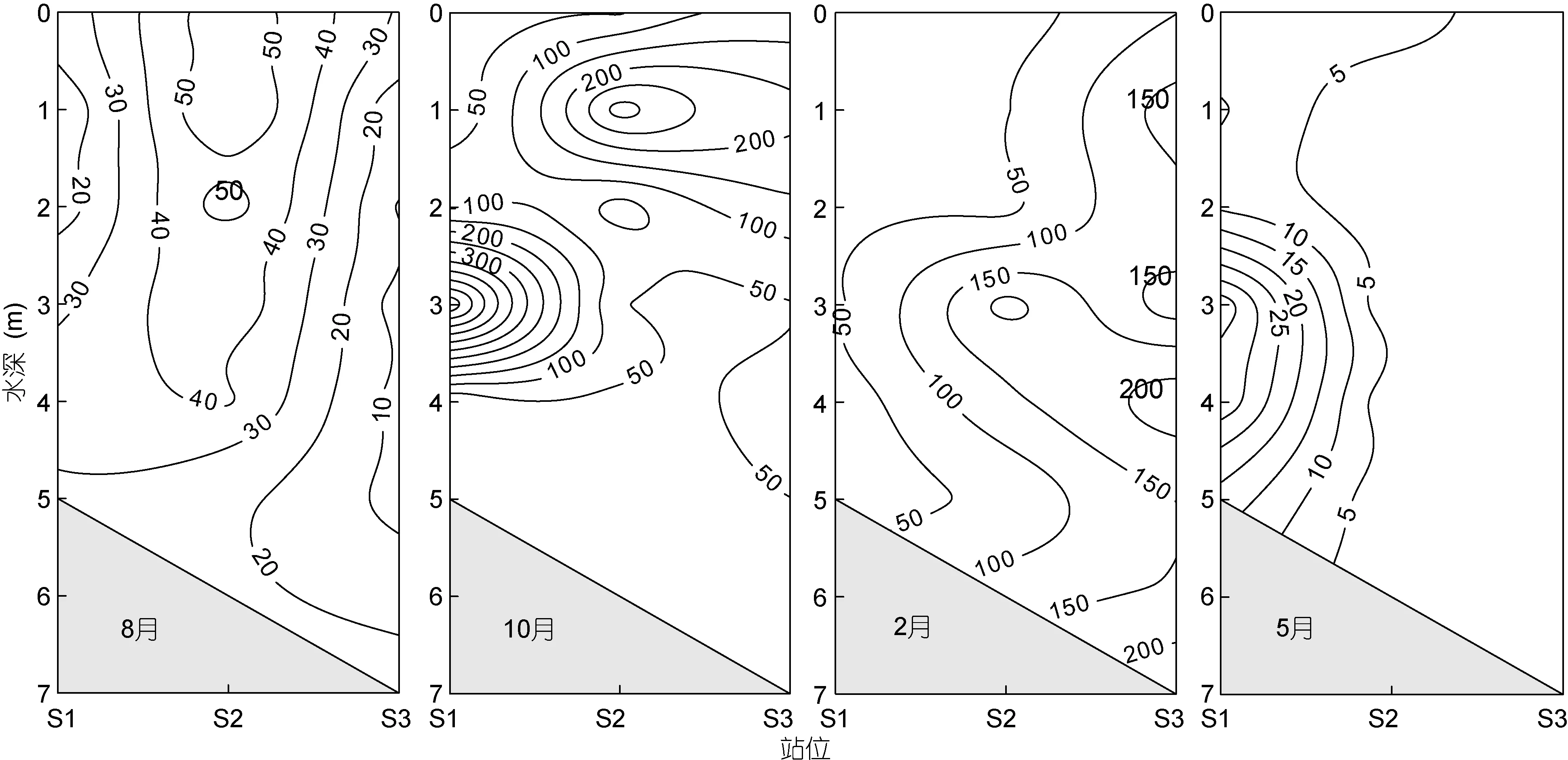
图2 大鹏澳总藻类丰度(×104cells/L)Fig.2 The total phytoplankton abundance (×104cells/L) in Dapeng Cove
浮游植物丰度主要由硅藻控制。硅藻丰度在4.5×103—5.93×106cells/L范围内, 占浮游植物总丰度的 90%以上, 所以硅藻的细胞丰度的空间分布特征与总浮游植物细胞丰度一致(图 3)。甲藻的时空分布与总浮游植物和硅藻丰度分布不一致(图2, 3, 4)。大鹏澳甲藻各水层丰度在 1.5×102—4.79×104cells/L 范围内, 平均丰度为 3.94×103cells/L; 甲藻丰度 2月最低, 平均为 6.57×102cells/L, 5 月最高, 平均为3.03×103cells/L。在8月、10月和 2月, 甲藻丰度高值区均出现在S2和S3站位, 牡蛎养殖区S1站位各水层甲藻丰度均明显低于S2和S3站位。5月, 甲藻丰度高值区位于S1、S2和S3站位3m以上水层, 最高值为7.65×103cells/L, 出现在S1站位2m水层。
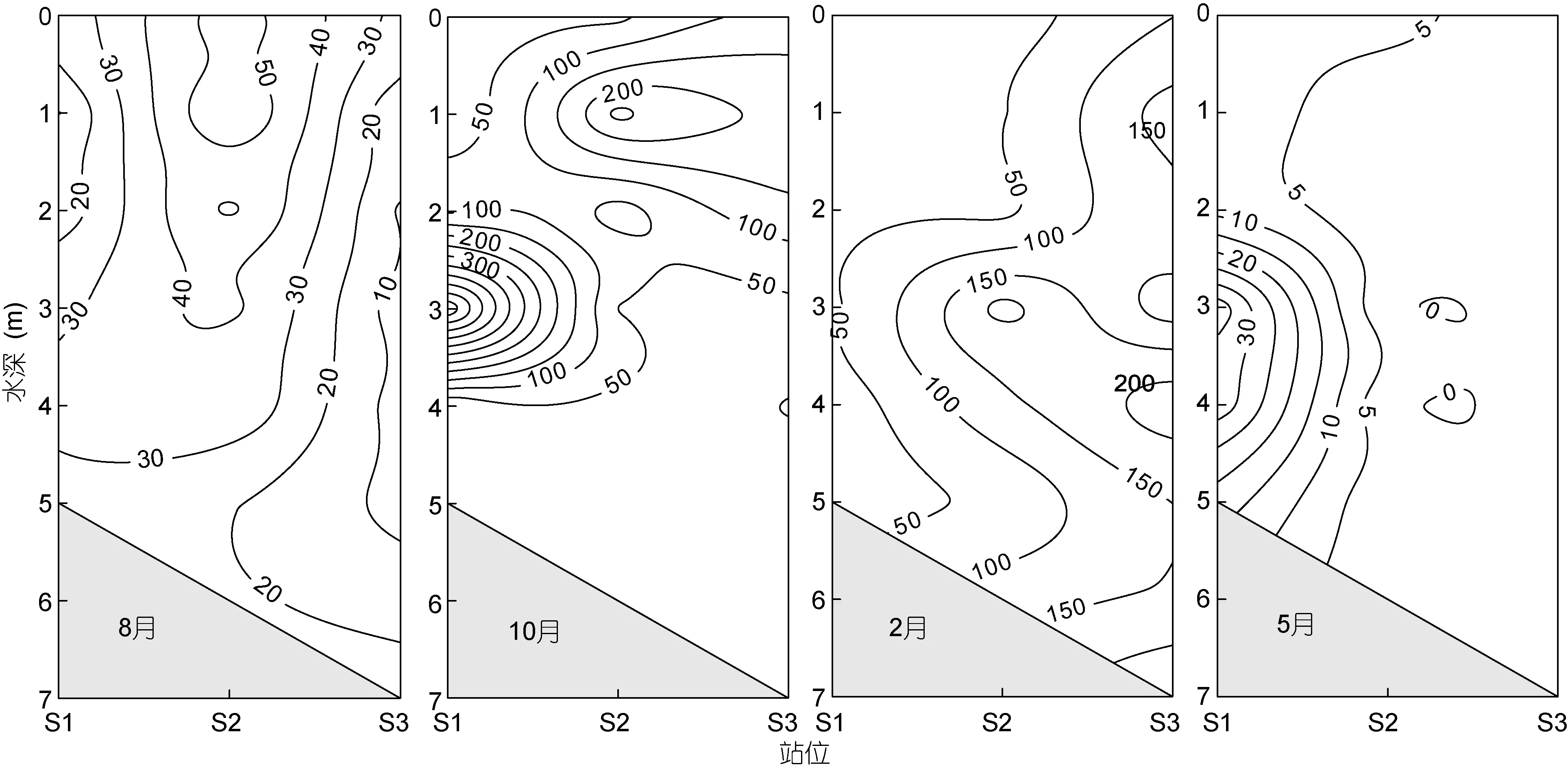
图3 大鹏澳四个季度硅藻丰度(×104cells/L)Fig.3 The abundance of diatoms(×104cells/L) in Dapeng Cove

图4 大鹏澳四个季度甲藻丰度(×102cells/L)Fig.4 The abundance of dinoflagellates(×102cells/L) in Dapeng Cove
2.3 浮游植物多样性指数和均匀度
各站位不同水层的多样性指数 H′变化范围为0.34—3.59, S1、S2和S3三个站位H′平均分别为1.36、2.68和2.69。8月, 3个站位H′相差不大; 但10月、2月和 5月, S1站位 H′水柱平均值明显低于 S2和 S3站位(图 5)。例如, 10月 S1站 H′值为 0.55, 而 S2和S3站H′值分别为2.44和3.31; 2月S1站H′值为0.34,而S2和 S3站H′值分别为2.11和1.25。均匀度J表现出跟H′相似的变化趋势, S1、S2和S3站平均值分别为0.27、0.49和0.51。8月, 3个站位均匀度J相差不大; 但其它月份, S1站均匀度 J水柱明显低于 S2和 S3站(图 6)。
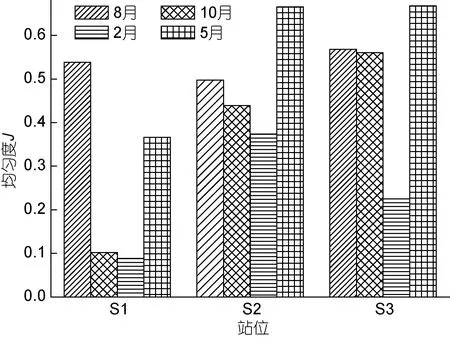
图6 大鹏澳浮游植物均匀度JFig.6 The evenness index of phytoplankton in Dapeng Cove
3 讨论
自20世纪90年代中期以来, 大鹏澳开始养殖葡萄牙牡蛎, 牡蛎养殖业给当地带来了巨大的经济效益。2012年以前, 大鹏澳牡蛎养殖分夏苗和冬苗投放,每年冬季和夏季收获。但2012年夏季牡蛎养殖面积剧增, 该海域超负荷养殖, 导致牡蛎生长缓慢, 牡蛎收获期减少为一年一次(从该年度 12月起至次年4—6月止)(于宗赫等, 2014)。浮游植物是贝类的重要饵料, 贝类超负荷养殖势必造成浮游植物丰度和种群结构的改变(Trottet et al, 2008a)。
本研究表明, 大鹏澳牡蛎养殖对浮游植物总丰度造成显著影响。8月牡蛎投苗初期和10月、2月牡蛎生长旺盛期, 牡蛎养殖区内浮游植物丰度均明显低于养殖区外, 这表明牡蛎对浮游植物有显著的滤食效应。但是, 5月进入牡蛎收获末期, 现存牡蛎量较少, 牡蛎滤水量显著降低, 加之养殖区内氮、磷等营养元素再循环程度显著, 营养盐浓度增加, 导致牡蛎养殖区内浮游植物总丰度高于非养殖区。总之, 超负荷牡蛎养殖能够显著降低浮游植物量, 这种现象在Beatrix Bay和 North Inlet estuary均曾被观察到(Ogilvie et al, 2000; Wetz et al, 2002)。而在Grande-Entrée Lagoon, 贝类养殖则对浮游植物生物量无显著影响, 其紫贻贝(Mytilus edulis)产量一直保持较高水平, Trottet等(2008b)指出该海域贝类养殖并未超出养殖容量。从本研究中牡蛎养殖对浮游植物丰度的影响来看, 2013—2014年大鹏澳牡蛎养殖已超出其养殖容量。超负荷养殖导致了食物短缺, 从而限制了牡蛎的生长。
硅藻在大鹏澳海域全年都是优势种类, 所以硅藻丰度的空间分布与浮游植物总丰度分布一致。本海域牡蛎主要吊养于3m以上浅水层中, 除5月外, 其它3个月牡蛎养殖区内3m以上水层硅藻和浮游植物总丰度均低于养殖区外, 说明硅藻是牡蛎的重要饵料。但值得注意的是, 在10月S1站位3m水层出现了硅藻高值区, 这说明在牡蛎养殖水层外(或边缘地带)牡蛎的滤食作用可能难以控制硅藻的生长。由于养殖贝类排出大量代谢产物, 物质循环和能量流动较为迅速, 大量无机和有机化合物给藻类的生长提供了充足的营养物质(Wetz et al, 2002)。另外, 贝类排泄物中含有氨基酸等多种有机氮化合物, 而这些物质对浮游植物尤其是硅藻的生长具有促进作用(徐立等, 1995; 周毅等, 2002), 这在一定程度上解释了牡蛎养殖区内出现硅藻高值区(如5月)的原因。
甲藻是海洋浮游植物的另一大类群, 先前的研究认为甲藻仅是某些浮游动物的饵料(Zhong et al,1990), 但近年来研究发现贝类养殖区内甲藻类丰度明显低于非养殖区, 表明甲藻类可能优先被贝类选择摄食(张莉红等, 2005)。另外, 张莉红等(2008)研究表明, 栉孔扇贝对东海原甲藻(Prorocentrum donghaiense)的摄食率和摄食选择效率均高于硅藻(中肋骨条藻和小角毛藻(Chaetoceros minutissimus) )。本研究结果与张莉红等(2005)相似, 除 5月牡蛎收获末期外, 养殖区内 S1站甲藻丰度显著小于非养殖区, 且牡蛎养殖对甲藻的滤食程度要高于硅藻。Wetz等(2002)研究结果也证实了牡蛎滤食效应能够显著降低浮游植物群落中甲藻的密度。
浮游植物多样性指数是表示其群落多样性的重要指标。均匀度则是实际多样性指数与理论上最大多样性指数的比值, 是一个相对值, 是群落是否成熟和稳定的特征之一。从各站位多样性指数和均匀度的结果来看, 牡蛎养殖区内浮游植物多样性和均匀度均明显低于非养殖区(图5, 图6), 尤其在牡蛎生长旺盛期(10月和 2月), 养殖区内浮游植物多样性指数 H′仅为非养殖区的1/3—1/4。现常以多样性指数小于l、均匀度小于0.3作为多样性较差的标准进行综合评价(马建新等, 2002)。在此标准下, 大鹏澳牡蛎养殖已经显著降低了养殖海域的多样性指数和均匀度(尤其在10月和2月), 导致该海域生态系统不稳定及生境退化。
另外, 10月份, 该海域可观察到一定量的蓝藻—丝状鞘丝藻(Lyngbya confervoides), 且其为优势种之一, 这与 Wang等(2014)的结果类似, 他们曾观察到蓝藻种群(Lyngbya, Oscillatoria等)在大鹏澳海域作为优势种出现。蓝藻的频繁出现可能与大鹏澳海域人类活动(包括贝类和鱼类养殖及污水排放等)导致水体富营养化程度加剧有关, 水产养殖与蓝藻的关系值得进一步研究。牡蛎的饵料来源除了浮游植物外, 还包括了浮游动物、颗粒有机物等, 本研究着重于牡蛎养殖对浮游植物的影响, 下一步的研究应全面考虑浮游植物、浮游动物及颗粒有机物的综合影响。
4 结论
(1) 大鹏澳海域2013年8月—2014年5月四个季度的采样调查共发现浮游植物 58属144种, 浮游植物类型多为广温性近岸种。硅藻在丰富度和物种数量上都占据绝对优势。
(2) 牡蛎对浮游植物有明显的滤食效应, 养殖区内牡蛎吊养水层(3m以上水层)浮游植物总丰度明显低于非养殖区。牡蛎对硅藻和甲藻均有显著的滤食作用, 但对甲藻的滤食作用更为明显。
(3) 牡蛎养殖能显著降低多样性指数和均匀度,导致该海域浮游植物群落不稳定、生态系统退化。
于宗赫, 江 涛, 夏建军等, 2014. 大鹏澳牡蛎养殖区生态服务价值评估. 水产学报, 38(6): 853—860
马建新, 郑振虎, 李云平等, 2002. 莱州湾浮游植物分布特征.海洋湖沼通报, (4): 63—67
王友绍, 王肇鼎, 黄良民, 2004. 近20年来大亚湾生态环境的变化及其发展趋势. 热带海洋学报, 23(5): 85—95
孙 军, 刘东艳, 徐 俊等, 2004. 1999年春季渤海中部及其邻近海域的网采浮游植物群落. 生态学报, 24(9):2003—2016
张莉红, 张学雷, 朱明远, 2008. 栉孔扇贝对硅藻和甲藻细胞的选择性摄食初探. 海洋科学进展, 26(3): 372—376
张莉红, 张学雷, 李瑞香等, 2005. 桑沟湾扇贝养殖对甲藻数量的影响. 海洋科学进展, 23(3): 342—346
周 毅, 杨红生, 何义朝等, 2002. 四十里湾几种双壳贝类及污损动物的氮、磷排泄及其生态效应. 海洋与湖沼, 33(4):424—431
徐 立, 吴瑜端, 1995. 有机氮化合物对海洋浮游植物生长的影响. 厦门大学学报(自然科学版), 34(5): 824—828
Charlson R J, Lovelock J E, Andreae M O et al, 1987. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate. Nature, 326: 655—661
Ma Y, Ke Z X, Huang L M et al, 2014. Identification of human-induced perturbations in Daya Bay, China: Evidence from plankton size structure. Continental Shelf Research, 72:10—20
Newell, R I E, 2004. Ecosystem influences of natural and cultivated populations of suspension-feeding bivalve molluscs: A review. Journal of Shellfish Research, 23(1):51—61
Ogilvie S C, Ross A H, Schiel D R, 2000. Phytoplankton biomass associated with mussel farms in Beatrix Bay, New Zealand.Aquaculture, 181(1—2): 71—80
Pielou E C, 1969. An introduction to mathematical ecology. New York: Wiley-Inter-Science
Shannon C E, Weaver W, 1949. The Mathematical Theory of Communication. Urbana L: University of Illinois Press
Sathyendranath S, Gouveia A D, Shetye S R et al, 1991.Biological control of surface temperature in the Arabian Sea.Nature, 349(6304): 54—56
Sarmiento J L, Toggweiler J R, Najjar R et al, 1988. Ocean carbon-cycle dynamics and atmospheric pCO2.Philosophical Transactions of the Royal Society of London,325(1583): 3—21
Trottet A, Roy S, Tamigneaux E et al, 2008a. Impact of suspended mussels (Mytilus edulis L.) on plankton communities in a Magdalen Islands lagoon (Québec, Canada):A mesocosm approach. Journal of Experimental Marine Biology and Ecology, 365(2): 103—115
Trottet A, Roy S, Tamigneaux E et al, 2008b. Influence of suspended mussel farming on planktonic communities in Grande-Entrée Lagoon, Magdalen Islands (Québec, Canada).Aquaculture, 276(1—4): 91—102
Wetz M S, Lewitus A J, Koepfler E T et al, 2002. Impact of the Eastern oyster Crassostrea virginica on microbial community structure in a salt marsh estuary. Aquatic Microbial Ecology, 28(1): 87—97
Wang Z H, Zhao J G, Zhang Y J et al, 2009. Phytoplankton community structure and environmental parameters in aquaculture areas of Daya Bay, South China Sea. Journal of Environmental Sciences, 21(9): 1268—1275
Wang Z H, Song S H, Qi Y Z, 2014. A comparative study of phytoneuston and the phytoplankton community structure in Daya Bay, South China Sea. Journal of Sea Research, 85:474—482
Zhong Z, Li S J, Zhou Q L, 1990. Marine Planktology. Berlin:Springer Verlag, 454

