血脂、LP(a)及TNF-α水平变化及在动脉粥样硬化过程中的作用
郑昌柱,任雨笙,李兰蓀,贾国良
(1.上海浦东新区周浦医院心内科 201318;2.第二军医大学长征医院心内科,上海200003;3.第四军医大学西京医院心内科,西安710032)
动脉粥样硬化(atherosclerosis,AS)是由多种因素共同作用导致的结果,其中以炎症、脂质浸润、血管内皮细胞受损、平滑肌细胞增生等起着关键作用[1],高血脂和脂质代谢紊乱在AS发病机制中占有重要地位,脂蛋白(A)[Lipoprotein(a),LP(a)]有致AS作用,其血中浓度升高与心肌梗死、血管再狭窄和脑卒中等密切相关,是冠心病的独立危险因素[2]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是一种具有多种生物学活性的小分子蛋白,具有促发炎症级联反应的作用,也参与了AS的发生与发展。本实验采用高脂喂养-球囊损伤新西兰兔胸腹主动脉复制动脉粥样硬化及血管成形术(percutaneous tranluminal angioplasty,PTA)后再狭窄模型,在慢性实验过程中以血管病理学变化为基础,研究血管AS及PTA后血管组织结构的改变以及血脂、LP(a)和TNF-α在这一过程的变化。
1 材料与方法
1.1 实验动物与试剂 纯种新西兰兔30只、雄性、7月龄、体质量2.5~3.5kg(第四军医大学实验动物中心)。胆固醇(天津市东方卫生材料厂进口分装),LP(a)检测试剂盒(上海博力生物制品公司),TNF-α检测试剂盒(北京军事医学科学院),单C臂心脏介入X光系统(Philips Lab,荷兰),造影导管及PTCA球囊导管(Cordis,美国),日立7150型自动生化分析仪(Hitachi Co,日本),Shandon AS352R 型切片机(Life Sci.Inter.Limited,英国)。
1.2 方法
1.2.1 高脂动物模型的制备 30只高脂饮食(1.0%胆固醇、5.0%蛋黄粉、1.5%猪油)喂养的纯种新西兰兔作为实验组。高脂饮食喂养2周后,使用3%戊巴比妥钠30mg/kg麻醉动物,常规穿刺左侧股动脉,经右股动脉送入4F球囊导管至胸主动脉分别以6、8、12个大气压充盈球囊后回拉至髂总动脉,反复回拉3次以造成腹主动脉内膜损伤。以气囊的机械作用造成动脉内膜损伤,术后动物继续高脂饮食喂养。10只普通饲料喂养的纯种新西兰兔作为对照组。实验组和对照组新西兰兔在月龄、性别和术前体质量比较差异无统计学意义(P>0.05)。
表1 实验组和对照组术前指标(±s)

表1 实验组和对照组术前指标(±s)
组别 n TC(mmol/L) TC(mmol/L) LDL-C(mmol/L) HDL-C(mmol/L) Lp(a)(mg/L) TNF-α(ng/L)实验组 30 1.62±0.92 0.89±0.37 2.26±0.47 0.89±0.18 83.93±17.83 0.34±0.08对照组 10 1.63±0.92 0.85±0.35 2.51±0.48 0.90±0.18 82.78±17.05 0.32±0.07
表2 新西兰兔高脂实验前后指标变化(±s,n=30)
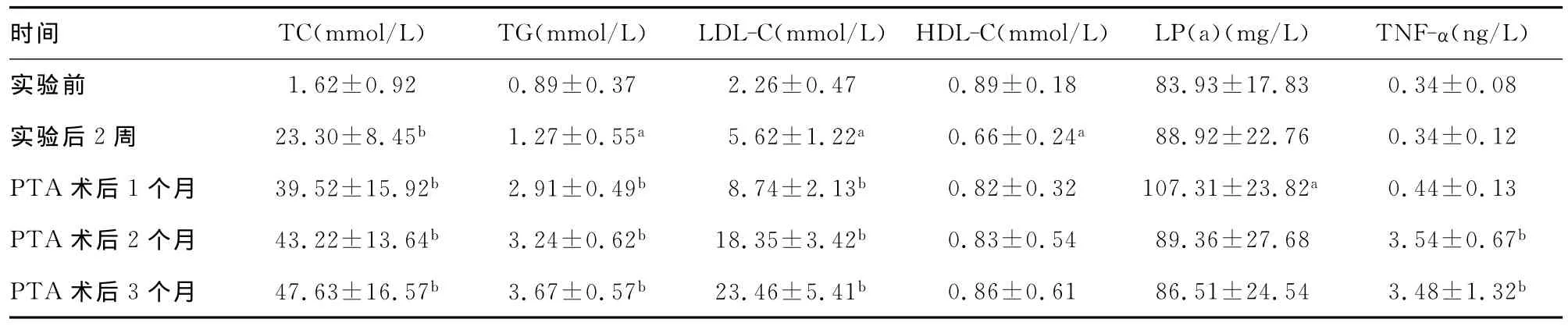
表2 新西兰兔高脂实验前后指标变化(±s,n=30)
a:P<0.05,b:P<0.01,与试验前比较。
时间 TC(mmol/L) TG(mmol/L) LDL-C(mmol/L) HDL-C(mmol/L) LP(a)(mg/L) TNF-α(ng/L)93±17.83 0.34±0.08实验后2周 23.30±8.45b 1.27±0.55a 5.62±1.22a 0.66±0.24a 88.92±22.76 0.34±0.12 PTA术后1个月 39.52±15.92b 2.91±0.49b 8.74±2.13b 0.82±0.32 107.31±23.82a 0.44±0.13 PTA术后2个月 43.22±13.64b 3.24±0.62b 18.35±3.42b 0.83±0.54 89.36±27.68 3.54±0.67b PTA术后3个月 47.63±16.57b 3.67±0.57b 23.46±5.41b 0.86±0.61 86.51±24.54 3.48±1.32实验前 1.62±0.92 0.89±0.37 2.26±0.47 0.89±0.18 83.b
1.2.2 血液生化检查 分别于实验前、喂养2周和PTA术后1、2、3个月行血液生化检查,常规生化法检测总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL-C)浓度、低密度脂蛋白(LDL-C)浓度、按Friedewald公式计算;ELISA法检测LP(a)和TNF-α浓度。
1.2.3 病理学检查 PTA术后3月时,解剖胸腹腔及腹股沟区,分离胸、腹主动脉及髂总动脉全长,纵行切开后,观察血管内膜结构,斑块、血栓形成情况照相记录;分段截取全程血管壁组织,常规固定、脱水、包埋、切片、苏木素-伊红(HE)染色,光镜下观察实验组以及对照组血管的病理改变。
1.3 统计学处理 采用SPSS13.0软件进行统计学分析,计量资料用±s表示,采用t检验、方差分析及Logistic相关分析等处理。相对参考值确定用ROC曲线下面积(area under the curve,AUC),AUC<0.5表明无诊断价值;AUC 为0.5~<0.7有较低的诊断价值;AUC为0.7~≤0.9中等诊断准确性;AUC>0.9具有较高诊断准确性。以P<0.05为差异有统计学意义。
2 结 果
实验组及对照组实验前一般特征差异无统计学意义(P>0.05),见表1。经高脂喂养的新西兰兔的TC、TG、LDL-C水平随着喂养时间的延长明显增高,显著高于基础水平(P<0.05),高脂喂养2周时 HDL-C较实验前明显较低(P<0.05),PTA术后HDL-C水平略有升高但仍低于实验前(P>0.05);高脂喂养2周时及PTA术后1个月兔血中LP(a)含量与高脂实验前差异有统计学意义(P<0.05),而在PTA术后2~3个月的兔血中LP(a)含量与高脂实验前差异无统计学意义(P>0.05);高脂喂养PTA术后1个月的兔血中TNF-α含量较高脂实验前无明显升高(P>0.05),PTA术后2个月时TNF-α含量急剧升高,明显高于实验前(P<0.01),PTA术后3个月时TNF-α含量进一步升高,见表2。
球囊扩张拉伤腹主动脉后3周,高脂喂养的实验组动物主动脉内膜广泛增厚,部分呈瘢痕样改变,斑块内大量平滑肌细胞增生伴纤维结缔组织透明变性,内膜下灶性钙盐沉积及少量炎症细胞浸润,而对照组动脉内膜完整,无增生,表面光滑,血管壁弹力纤维分布均匀,无泡沫细胞及类脂质沉积,见图1。
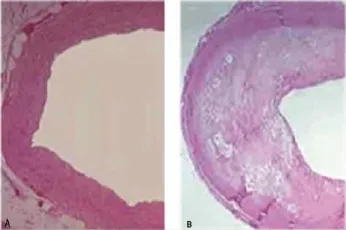
图1 3个月后腹主动脉组织切片(HE染色,×100)
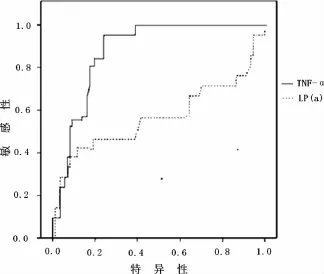
图2 TNF-α和LP(a)ROC曲线
以术后腹主动脉是否发生大于50%狭窄为因变量,月龄,术前体质量,术前后 TG、TC、HDL-C、LDL-C、LP(a)、各个时间点TNF-α水平等均作为自变量,进行多元Logistic逐步回归分析,发现术后,2个月TNF-α水平对于腹主动脉狭窄发生的危险性比值(RR)为1.84(95%CI:1.26~2.73,P<0.01)。表明术后2个月TNF-α峰值为腹主动脉狭窄发生的独立危险因素。TNF-α的ROC曲线下面积为0.871(95%CI:0.811~0.956),Lp(α)为0.523(95%CI:0.409~0.720),表明 TNF-α对高血压伴随冠心病具有较高诊断准确性。以敏感性加特异性最大值为截断点,对TNF-α进行分析,其截断点为3.1 ng/L,敏感性为87.2%,特异性为78.3%,见图2。
3 讨 论
AS的形成与发展是一个缓慢的炎症过程,早期由于血管内膜的损伤、血小板聚集、炎细胞浸润,包括血小板源性生长因子(PGDF)等的大量生长因子及血管活性物质的释放,促进了血栓形成及平滑肌细胞的迁移、增生以及细胞外基质的增生,在AS的不同时间段血管壁出现不规则狭窄等。本实验采用高脂状态下的新西兰兔动脉损伤模型,应用球囊导管的机械作用模拟PTCA导致兔动脉血管壁的损伤,观察AS的慢性实验过程中动脉血管组织的病理形态及改变以及血脂、LP(a)和TNF-α在这一过程的变化。本组实验结果显示,正常动脉内膜结构完整、表面光滑;而实验组腹主动脉内膜广泛增厚,斑块内大量平滑肌细胞增生伴纤维结缔组织透明变性,内膜下灶性钙盐沉积及少量炎细胞浸润。研究证实高血脂和脂代谢紊乱、LP(a)、慢性炎性反应等均参与AS的发生和发展[3-4]。Lp(a)结构与LDL-C相似,是动脉粥样硬化的独立危险因素[5],与冠状动脉病变程度呈正相关[6]。本实验显示,血清中LP(a)水平变化与TC、LDL-C的变化没有平行关系,LP(a)水平在TPA术后1个月比术前有升高,但TPA术后2~3个月同术前比较差异无统计学意义。体内LP(a)的水平与遗传因素有关,个体差异很大,变化不受年龄、饮食、吸烟、酗酒及多数降脂药物的影响[7]。在本实验中LP(a)水平未表现出明显升高,这可能与实验动物的种属和抗原性不同及实验中采血时间点选择较宽等有关。LP(a)的生物学性质、致病机制等还需进一步研究。本研究发现TNF-α对腹主动脉粥样硬化敏感性为87.2%,特异性为78.3%。AS早期阶段,TNF-α可通过破坏血管内皮结构和功能的完整性、sis原癌基因的转录、血管平滑肌细胞的增殖、凝血与抗凝系统失平衡等机制参与AS的发生与发展[8-9]。TNF-a参与动脉粥样硬化的炎症发生、发展过程[10],并处于核心地位[11]。本组实验结果显示,PTA术后1个月的血清TNF-α浓度升高,PTA术后2个月时TNF-α浓度急剧升高,PTA术后3个月时TNF-α含量较前一个月无明显改变。提示TNF-α升高并非发生在组织损伤期,而多与组织的修复过程有关。由于巨噬细胞、血管平滑肌细胞及内皮细胞都可产生TNF-α,推测TNF-α在PTA 后中晚期急剧升高可能是血管平滑肌及内皮细胞在组织修复过程中产生的,与血管PTA后再狭窄发生发展有关。本研究发现术后2个月TNF-α峰值为腹主动脉狭窄发生的独立危险因素,说明TNF-α在引起动脉粥样硬化发展的病理进程中,起到了关键作用。总之,TNF-α参与了PTA后血管再狭窄过程的发生发展,但其在AS中的作用机制还需进一步研究。
[1] Dzau VJ,Braun-Dullaeus RC,Sedding DG.Vascular pro-liferation and atherosclerosis:new perspectives and therapeutic strategies[J].Nat Med,2002,8(11):1249-1256.
[2] Golden LB,Bushnell CD,Adams RJ,et al.Guidelines for the primary prevention of stroke:aguideline for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2011,42(2):517-584.
[3] Schachinger V,Halle M,Minners J,et al.Lipoprotein(a)selectively impairs receptor-mediated endothelial vasodilator function of the human coronary circulation[J].J Am Coll Cardiol,1997,30(4):927-934.
[4] Okada M,Matsuto T,Miida T,et al.Lipid analyses for the management of vascular diseases[J].J Atheroscler Thromb,2004,11(4):190-199.
[5] Bennet A,Di AngeIantonio E,Erqou S,et al.Lipoprotein(a)levels and risk of future coronary heart disease:largescale prospective data[J].Arch Intern Med,2008,168(6):598-608.
[6] Kamstrup PR,Benn M,Tybjarg-Hansen A,et al.Extreme lipoprotein(a)levels and risk of myocardial infarction in the general population:the Copenhagen City Heart Study[J].Circulation,2008,117(2):176-184.
[7] Jones DW,Chambless LE,Folsom AR,et al.Risk factors for coronary heart disease in African Americans:the atherosclerosis risk in communities study,1987-1997[J].Arch Intern Med,2002,162(22):2565-2571.
[8] Valgimigli M,Merli E,Malagutti P,et al.Hydroxyl radical generation,levels of tumor necrosis factor-alpha,and progression to heart failure after acute myocardial infarction[J].J Am Coll Cardiol,2004,43(11):2000-2008.
[9] Jovinge S,Hultgårdh-Nilsson A,Regnström J,et al.TTumor necrosis factor-alpha activates smooth muscle cell migration in culture and is expressed in the balloon-injured rat aorta[J].Arterioscler Thromb Vasc Biol,1997,17(3):490-497.
[10] Chen YY,Hsu MJ,Hsieh CY,et al.Andrographolide inhibits nuclear factor-κB activation through JNK-Akt-p65 signaling cascade in tumor necrosis factor-α-stimulated vascular smooth muscle cells[J].ScientificWorldJournal,2014,2014:130381
[11] Angel K,Provan SA,Mowinckel P,et al.The L-arginine/asymmetric dimethylarginine ratio is improved by antitumor necrosis factor-αtherapy in inflammatory arthropathies.Associations with aortic stiffness[J].Atherosclerosis,2012,225(1):160-165.

