呋喃二烯纳米脂质载体的制备及其性质的考察
孙林林,姜伟化,陈 宁,张建梅,王东凯
(沈阳药科大学 药学院,辽宁 沈阳 110016)
呋喃二烯纳米脂质载体的制备及其性质的考察
孙林林,姜伟化,陈 宁,张建梅,王东凯*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的制备呋喃二烯纳米脂质载体,对其处方工艺进行优化,并考察其制剂的性质。方法以乳化超声法制备呋喃二烯纳米脂质载体,根据单因素考察的结果,通过正交设计实验,优选出最佳制备工艺处方。对粒子的形态、粒径和电位进行表征,微柱离心法测定包封率。结果最优处方中MCT占总脂质质量的30%,乳化剂用量为20 g·L-1。F68与磷脂的质量比为2∶1。该优化处方制备的纳米粒子呈类球型,粒径为94.64 nm,zeta电位为-19.4 mV,包封率为91.27%。结论本实验制备的呋喃二烯纳米脂质载体粒径小,稳定性较好且药物包封率高。
药剂学;纳米脂质载体;乳化-超声分散法;正交设计;呋喃二烯;包封率
呋喃二烯(furanodiene,FN)是从姜科姜黄属植物莪术中提取分离得到的倍半萜类化合物,结构中的十元二烯环在高温条件下会由椅式过渡态发生[3,3]-σ迁移的Cope重排反应,产物为莪术烯。所以该结构有遇光和温度高于100 ℃时不稳定等理化性质[1]。 药理研究表明[2],呋喃二烯抑制肿瘤活性显著,具有广谱、低毒、高选择性的抗癌作用,但其在水中极难溶解且稳定性差。
脂质纳米粒包括固体脂质纳米粒(solid lipid nanoparticles,SLN)和纳米脂质载体( nanostructured lipid carriers,NLC),由天然材料组成,在体内具有固定的降解途径,生物相容性好,毒性低,理化性质稳定等特点。另外,他们具有被动靶向性,可将使药物蓄积于肿瘤组织,提高抑瘤效果[3]。已有文献报道PEG化呋喃二烯固体脂质纳米粒的制备[4],但是SLN依然存在不足之处,包括载药量低、药物析出等现象。NLC 采用混合脂质为载体,将常温下为液态的脂质加入到固态脂质中,不仅兼有SLN的优点,而且可以增加对药物分子的包载,避免放置过程中药物外排,提高了药物的稳定性[5-7],很好的解决SLN的不足。作者本研究通过乳化-超声分散法制备呋喃二烯纳米结构脂质载体,并对其处方工艺进行了优化。
1 仪器与材料
BS110S精密电子天平(北京赛多利斯仪器系统有限公司),PF-101T集热式恒温磁力搅拌器(巩义英峪予华仪器厂),XW-80A涡旋混合器(上海精科实验有限公司),KQ-400KDE高功率数控超声波清洗器(昆山超声仪器有限公司),超声波细胞粉碎机(宁波新芝科器研究所),PB-10 Sartorius普及型pH计(德国赛多利斯股份公司),Zetasizer Nano ZS 90粒度测定仪(英国马尔文公司),透射电子显微镜(TEM,JEM-1200 EX,日本JEOL公司),80-2离心机(上海君竺仪器制造有限公司),LC-10A 高效液相色谱仪、DSC-60差示扫描量热仪(日本岛津公司)。
呋喃二烯(FN,海南碧凯药业有限公司),注射用大豆磷脂(PC,上海太伟药业有限公司),单硬脂酸甘油酯(GMS,天津博迪化工股份有限公司),中链甘油三酸酯(MCT,铁岭北亚药用油有限公司),泊洛沙姆188(F68,德国BASF公司),脱氧胆酸钠(北京双旋微生物培养基制品厂),吐温-80(天津康科德科技有限公司),SephadexG-50葡聚糖凝胶(北京瑞达恒辉科技发展有限公司),甲醇(色谱纯,天津康科德科技有限公司)。
2 方法与结果
2.1 处方前研究
2.1.1 HPLC法测定呋喃二烯的含量
经紫外扫描,确定检测波长为216 nm。经筛选优化,确定流动相的组成为甲醇-水(体积比为95∶5),进样体积为20 μL,流速为1.0 mL·min-1。在该条件下,呋喃二烯的保留时间为8.0 min左右,溶剂、辅料对药物的测定无干扰。方法学验证得知呋喃二烯质量浓度在0.5~80 mg·L-1内线性关系良好,回归方程为A= 57 004 ρ-5 684.6 (r=0.999 8));低(10 mg·L-1)、中(20 mg·L-1)、高(30 mg·L-1)3个质量浓度的平均回收率为100.3%,RSD分别为0.93%、0.82%和0.76%;低、中、高3个质量浓度的日内精密度RSD分别为0.82%、0.60%和0.46%,日间精密度RSD分别为1.71%、1.98%和1.29%;于4 ℃冰箱中溶液24 h内的稳定性良好(RSD=0.62%),上述结果表明建立的HPLC法适合呋喃二烯含量的测定。
2.1.2 FN在水和油中的溶解度测定
精密称取数份过量的呋喃二烯原料药,置于具塞玻璃试管中,分别加入相同量的不同溶液(表1),涡旋15 min后,将具塞玻璃试管置于水浴振荡器中37 ℃振摇72 h,平衡后在规定时间取样,用0.45 μm 微孔滤膜过滤,测定药物溶解度,结果见表1、2。

Table 1 Equilibrium solubility of FN in different solutions at 37 ℃ (n=3)表1 呋喃二烯在不同水溶液中的平衡溶解度(n=3)
结果表明,FN在水中溶解度很小,几乎不溶于水,不同pH值的磷酸盐缓冲液并未对其溶解度有明显的影响,加入一定量的Tween-80、SDS之后能明显增加FN在水中的溶解度。

Table 2 Equilibrium solubility of FN in different oil solutions at 37 ℃(n=3)表2 呋喃二烯在不同油溶液中的平衡溶解度(n=3)
结果表明,FN在MCT和LCT中有一定的溶解度,且在两者中的溶解度无显著性差异(P > 0.05)。
2.1.3 FN的表观油水分配系数的测定
取6支10 mL具塞试管,分为2组,每组3支,分别精密量取质量浓度为1.0 g·L-1与0.1 g·L-1水饱和的正辛醇FN溶液1.0 mL,加正辛醇饱和的水溶液至刻度,密封塞子,置于水浴振荡器中,37 ℃、100 r·min-1振荡72 h,使达到分配平衡。分离水相和油相。经甲醇稀释后,用HPLC法测定水相及油相的药物质量浓度。计算lgP值的结果见表3。

Table 3 Determination of oil-water partition coefficient of furanodiene (n=3)表3 呋喃二烯油水分配系数的测定(n=3)
结果表明,由高、低2个质量浓度测得的FN油/水分配系数的对数值相近,lgP值均在5.0左右,该数值表明药物为强脂溶性药物。
2.2 FN-NLC的制备
2.2.1 脂质材料的选择
常见的固体脂质有单硬脂酸甘油酯、硬脂酸、棕榈酸和山嵛酸甘油酯。由于 FN的化学结构在温度高于100 ℃时可发生Cope重排反应而不稳定,所以宜选择熔点较低的固体脂质。山嵛酸甘油酯作为脂质材料时,制备温度需要达到85 ℃,不利于FN的稳定。棕榈酸为固体脂质时,放冷后呈黏稠状混浊液。单硬脂酸作为脂质材料时,制备的纳米粒易产生絮凝,稳定性不好。因此选择单硬脂酸甘油酯作为固态脂质。
大豆油和中链油是常见的液态脂质。FN在两者中的溶解度差别不大,但是MCT黏度小、流动性好、易被多种乳化剂乳化、注射给药安全性高,因此作者选择中链油作为液态脂质。
2.2.2 乳化剂种类的选择
文献报道[8-9],使用复合乳化剂可以有效的降低粒径,提高稳定性。本研究以粒径和放置稳定性为指标,考察豆磷脂分别与吐温-80、Solutol HS 15、F68及聚氧乙烯蓖麻油(Cremphor EL 35)4种非离子型表面活性剂联合使用对制剂的影响,结果见表4。

Table 4 The effect of various emulsifiers combination on particle size and stability表4 不同乳化剂联用对粒径和稳定性的影响
结果表明,选用豆磷脂和F68作为复合乳化剂时,制备的制剂的粒径小且稳定性较好。
采用乳化-超声分散法制备FN-NLC,方法如下:称取处方量的FN、GMS、MCT置于小烧杯中,加热至70 ℃熔融、混匀,恒温水浴锅中保持恒温,构成有机相。精密称取处方量F68、大豆磷脂和脱氧胆酸钠,溶于适量的蒸馏水中,使其恒温保持在70 ℃,构成水相。用预热至70 ℃的注射器,缓慢地将水相注入在一定转速搅拌下的恒温油相中,继续搅拌8 min,形成半透明O/W型初乳,70 ℃保温条件下,以超声波细胞粉碎机超声处理4 min制备纳米乳。之后迅速冰浴固化数分钟,即冷却形成均一、半透明、呈淡蓝色乳光的纳米粒分散液。将纳米粒分散液经0.22 μm微孔滤膜过滤后,4 ℃密封保存。
2.3 包封率的测定方法
采用葡聚糖凝胶微柱离心法测定包封率[10]。将用去离子水平衡好的SephadexG-50葡聚糖凝胶装入2.5 mL注射器的针筒中,2 000 r·min-1离心3 min,制成Sephadex G-50的微型柱。取制备好的FN纳米脂质载体0.1 mL 2份,其中1份直接置于10 mL量瓶中,加入去离子水1.5 mL,以甲醇破乳并稀释定容,摇匀,过0.45 µm微孔滤膜,取续滤液即为过柱前溶液。另1份加于制备好的葡聚糖凝胶微柱顶端,洗脱液为去离子水,按上述条件离心,每次洗脱液为0.5 mL,洗脱3次,合并洗脱液于10 mL量瓶中,加甲醇稀释定容,摇匀,过0.45 µm微孔滤膜,取续滤液即为过柱后溶液。按“2.1.1”条色谱条件注入液相色谱仪,记录峰面积。包封率(wEE)= 纳米粒中的药物质量/处方中药物的总质量×100 %。
2.4 FN-NLC处方工艺的优化考察
经过单因素初步考察,确定影响FN-NLC包封率的主要因素为脂质质量比(GMS/MCT)、复合乳化剂的比例和乳化剂的用量。采用正交试验设计L9(34)对处方做进一步的筛选。各因素及水平见表5。

Table 5 The factor and levels table of orthogonal design表5 正交实验因素和水平
以包封率为主要评价指标,正交试验结果见表6。

Table 6 The orthogonal experimental results of wEE表6 正交设计包封率的结果
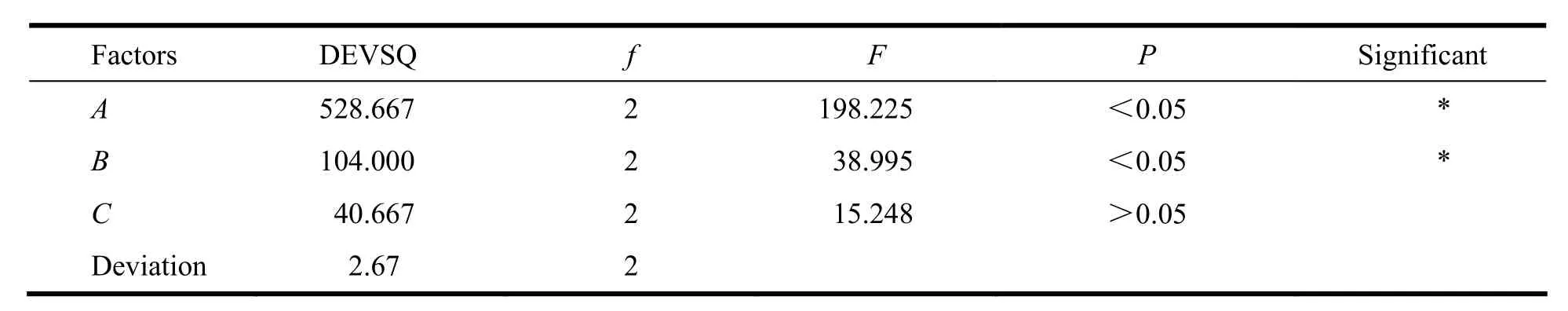
Table 7 Composite score and variance analysis表7 综合评分方差分析
通过直观分析,可知各因素对包封率的影响大小依次为A2>A1>A3,B2>B3>B1,C2>C3>C1,通过极差R值的比较,各因素对实验结果影响的大小顺序为:A>B>C,由此可以得出包封率的最优条件为A2B2C2。
由方差分析可知,因素A、B对包封率影响显著。由表3、4可知最佳制备工艺为A2B2C2,即MCT占总脂质质量的30%,乳化剂用量为的20 g·L-1,F68与磷脂质量比为2。按照优化处方制备呋喃二烯纳米脂质载体,测得其粒径为94.64 nm,电位为-19.4 mV,包封率为91.27%,载药量为4.93%。
2.5 NLC的形态、粒径及zeta电位
NLC纳米混悬液加蒸馏水稀释,取适量滴至铜筛网上,20 g·L-1磷钨酸负染,室温放置至形成薄膜后用透射电子显微镜观察其形态(图1)。由图1可见,纳米粒呈类球形。

Fig. 1 TEM photograph of FN-NLC图1 呋喃二烯纳米脂质载体的透射电镜照片
取稀释后NLC纳米混悬液适量,摇匀[11-12],用Malvern激光散射粒度分析仪测定粒径分布及zeta电位(图2、3)。由图 2、3可见,粒径为94.64 nm,zeta电位为-19.4 mV,表明制得的FN-NLC表面带负电荷。

Fig. 2 Particle size of typical FN-NLC图2 呋喃二烯纳米脂质载体的粒径分布
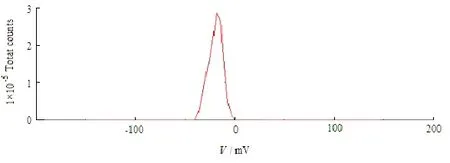
Fig. 3 Zeta potential of typical FN-NLC图3 呋喃二烯纳米脂质载体的电位分布
2.6 DSC曲线的测定
分别取适量的FN、FN-NLC冻干粉和空白NLC冻干粉末,置密闭的铝坩锅中,测定DSC曲线(图4)。由图4可知,FN在66.78 ℃有明显的吸收峰;而FN-NLC的DSC曲线只显示在48.78 ℃时有1个很小的吸收峰,未见药物峰,考虑到纳米粒表面不存在药物晶体,提示结构中药物应该是以无定型状态分散于纳米粒中。

Fig. 4 DSC thermograms of blank-NLC(a), FN-NLC(b) and FN(c)图4 空白NLC冻干粉末(a)、FN-NLC冻干粉(b)和FN(c)的差示扫描量热法分析结果
3 讨论
a. 乳化剂的正确选择是能否制备出稳定的NLC的关键因素。磷脂是制备乳剂时最常用的乳化剂,它主要以囊泡双层膜的形式存在水相中。在NLC的制备中,加入磷脂作为助乳化剂,与非离子型表面活性剂组成复合乳化剂,不仅可以有效的降低粒径,同时保证油水两相的界面的稳定。实验中考察了4种乳化剂(Tween-80、Solutol HS 15、Poloxamer 188和Cremphor EL 35)与磷脂联用的效果,其中Poloxamer 188与磷脂制备的NLC粒径适宜且稳定性好于其他3种。这可能是其他3种更易形成胶束,增大了药物在水中的溶解度,从而使粒子相互碰撞机会增加,最后粒子聚合甚至胶凝。
b. 测定包封率的方法很多,作者曾考虑选用超速离心法测包封率,然而在20 000 r·min-1离心2.5 h并未能将纳米粒中油水相分离,表明此法并不适用该制剂。而透析法测得的包封率低,重现性不好,最终选用葡聚糖凝胶微柱离心法进行包封率的测定,此方法耗时短、脂质载体溶液稀释倍数小,且不需要昂贵的仪器设备。
c. 透射电镜测得的粒径较Malvern测得值偏小。这是因为Malvern测得的粒径是纳米粒的水合半径,粒子外面有一层很厚的水化层;透射电镜测得的是干燥的样品,没有水化层,所以粒径较小[13]。电位是表征纳米混悬微粒的一个重要指标,可以用于预测胶体粒子的物理稳定性。电位绝对值比较高的制剂由于电子排斥作用,很少出现粒子的聚集,所以通常有较好的稳定性。脱氧胆酸钠的加入可以提高zeta电位绝对值,从而使粒子更加稳定。
参考文献:
[1] 孙秀燕, 郑艳萍, 刘志峰. 温莪术环状含氧倍半萜类化学成分的研究[J]. 分析测试学报, 2006, 25(6): 27-30.
[2] 郑艳萍, 孙秀燕, 巴真真. 呋喃二烯的体内外抗肿瘤作用研究[J]. 烟台大学学报: 自然科学与工程版, 2008, 21(2): 115-119.
[3] 卢琳, 熊素彬. EPR效应在实体瘤靶向治疗中的研究进展[J] . 北方药学, 2014, 11(7): 73-74.
[4] 谢鑫鑫, 王俊腾, 秦利芳, 等. PEG化呋喃二烯固体脂质纳米粒的制备及体外巨噬细胞摄取研究[J]. 中国新药杂志, 2012, 21(21): 2552-2561.
[5] PARDEIKE J, HOMMOSS A, MULLER R H, et al. Lipid nanoparticles (SLN, NLC) in cosmetic and pharmaceutical dermal products [J]. Int J Pharm, 2009, 366: 170-184.
[6] MULLER R H, RADTKE M, WISSING S A. Solid lipid nanoparticles (SLN) and nanostructured lipid carriers (NLC) in cosmetic and dermatological preparations [J]. Adv Drug Deliv Rev, 2002, 54(35): 131-155.
[7] ZhANG Xin-xin, GAN Yong, YANG Xing-gang, et al. Preparation of PEG-modified nanostructured lipid carriers loaded with hydroxycampt-othecin and tissue distribution in mice [J]. Acta Pharm Sin, 2008, 43(1): 91-96.
[8] MICHELE T, FRANCO P, TEREZIO I. Stability of drug-carrier emulsions containing phosphatidylcholinemixtures mixtures[J]. Eur J Pharm Biopharm, 2002, 53(2): 203-208.
[9] MUHLEN A Z, MEHNERT W. Drug release and release mechanism of prednisolone loaded solid lipid nanoparticles[J]. Pharmazie, 1998, 53: 552.
[10] 金鑫, 王绛玉, 张娜, 等. 微柱离心-高效液相色谱法测定莪术醇脂质体的包封率[J]. 中国药剂学杂志, 2010, 8(1): 27-32.
[11] 雷欣潮, 刘华钢, 赖茂祥. 正交实验法优选两面针的提取工艺研究[J]. 时珍国医国药, 2011, 22(10): 2494-2495.
[12] 陈辰, 何军, 陆伟根. 白蛋白作为注射用难溶性药物载体的研究[J]. 中国医药工业杂志, 2010, 41(1): 51-54.
[13] QIU Feng, FENG Jun, WU De-qun, et al. Nanosized Micelles Self-Assembled from amphiphilic dextran-graftmethoxypolyethylene glycol/poly(epsilon-caprolactone) copolymers[J]. Eur Polym J, 2009, 45(4): 1024-1031.
Preparation and characteristics of furanodiene nanostructured lipid carriers
SUN Lin-lin, JIANG Wei-hua, CHEN Ning, ZHANG Jian-mei, WANG Dong-kai*
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo prepare furanodiene-loaded nanostructured lipid carriers (FN-NLC), To optimize the formulation and investigate their pharmaceutical properties.MethodsFN-NLC was fabricated by emulsification-ultrasonic method. Based on the single-factor experiments, orthogonal design was used to optimize the formulation. The size and zeta potential were determined by dynamiclight scattering. The morphology of FN-NLC was observed by transmission electron microscopy. Microcolumn centrifugation method was adopted to determine the entrapment efficiency.ResultsThe NLC was prepared with average particle size of 94.64 nm and zeta potential of -19.4 mV. The entrapment efficiency was 91.27%.ConclusionsFN-NLC can improve drug loading capacity with small particle sizes.
pharmaceutics; nanostructured lipid carriers; emulsification-ultrasonic method; orthogonal design; furanodiene; entrapment efficiency
R 94
A
(本篇责任编辑:赵桂芝)
(2015)05-0153-09
10.14146/j.cnki.cjp.2015.05.001
2015-03-04
孙林林(1989-), 女(汉族), 山东聊城人, 硕士研究生, E-mail sunlinlinzxjy@126.com;*通讯作者:王东凯(1962-), 男(汉族), 辽宁沈阳人, 教授, 博士, 博士生导师, 主要从事药物新剂型的研究, Tel. 024-23986310,E-mail wangdksy@126.com。

