HPLC法同时测定布洛芬注射液中的13种有关物质
郝晓丽,刘小云,马攀勤,2,马永付,2,孙志苏,孙 进*
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016;2. 宁夏康亚药业有限公司,宁夏 银川 750002)
HPLC法同时测定布洛芬注射液中的13种有关物质
郝晓丽1,刘小云1,马攀勤1,2,马永付1,2,孙志苏1,孙 进1*
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016;2. 宁夏康亚药业有限公司,宁夏 银川 750002)
目的建立HPLC法同时测定布洛芬注射液中的13种有关物质。方法以COSMOSIL C18-ARⅡ(150 mm × 4.6 mm,5 μm)为色谱柱;以磷酸溶液为流动相A,乙腈为流动相B,进行梯度洗脱;检测波长为214 nm;柱温为30 ℃;流速为1.0 mL·min-1。结果在选定的色谱条件下,布洛芬主峰与各杂质峰和辅料峰均可基线分离,有关物质的检查结果均在限度范围内。结论该方法简便、快速、准确、可靠,可为布洛芬注射液质量标准的建立提供参考依据。
药剂学;有关物质;高效液相色谱法;布洛芬;注射液
布洛芬注射液是由美国Cumberland公司研制,并于2009年由美国FDA批准上市,成为世界上首个治疗疼痛和发热的布洛芬静脉注射液[1]。其用于抗炎、发热和轻度至中度疼痛的治疗[2],也可作为阿片类镇痛药的辅助药物治疗中度至重度疼痛,适用于需要住院治疗且无法采用口服药物医治的患者。布洛芬原料药中已报道的杂质有18种[3-4],但对这些杂质同时分离测定的文献并不多[5-9]。本文作者参照《英国药典》2013年版和《欧洲药典》8.0版收录的布洛芬原料药有关物质检查方法,建立了一种简便、迅速、灵敏、可靠的HPLC法,用于同时测定杂质A、B、D、E、G、H、I、J、K、L、N、Q和R,且该方法适用于布洛芬原料药和注射液中有关物质的检查。布洛芬的化学结构式见图1。

Fig. 1 Structures of ibuprofen (IBU)图1 布洛芬的化学结构式
1 仪器与材料
Hitachi D-2000高效液相色谱仪(配有L-2400 UV 检测器、L-2300柱温箱、L-2200自动进样器、L-2130泵和D-2000 Elite色谱工作站,日本Hitachi公司),Hitachi Chromaster高效液相色谱仪(配有5340光二极管阵列检测器、5310柱温箱、5210自动进样器、5110泵和Chromaster色谱工作站,日本Hitachi公司),BT 25 S电子天平(北京赛多利斯科学仪器有限公司)。
布洛芬(含量质量分数为98.8%,批号为100179-201105,中国食品药品检定研究院),杂质A、B、D、E、G、H、I、J、K、L、N、Q和R(含量质量分数分别为98.9%、95.8%、99.7%、99.3%、98.6%、96.2%、99.4%、99.6%、99.3%、99.9%、99.8%、99.7%和 99.2%,批号分别为 No.16724、No.1188、No.496、No.1916、No.10008、No.8395、No.3061、No.17932、No.11235、No.19803、No.15832、No.02.36.08.02和No.02.37.08.02,英国LGC公司),布洛芬注射液(规格为每支4 mL,含药 400 mg,批号为 20121201、20121202、20121203)、空白辅料(批号为 20121204、20121205)(宁夏康亚药业有限公司)。
乙腈(色谱纯,天津科盟化工工贸有限公司),磷酸二氢钾(分析纯,西陇化工股份有限公司),水为重蒸水(自制)。
2 方法和结果
2.1 色谱条件
以COSMOSIL C18-ARⅡ(150 mm × 4.6 mm, 5 μm)为色谱柱;以磷酸-乙腈-水按体积比0.05∶40∶600混合均匀后,加水至1 000 mL为流动相A,以乙腈为流动相B,梯度洗脱,梯度洗脱程序见表1;检测波长为214 nm;柱温为30 ℃;流速为1 mL·min-1;进样量为20 μL。

Table 1 Routine of gradient elution表1 梯度洗脱程序
2.2 溶液的配制
2.2.1 系统适用性溶液
取布洛芬对照品适量,精密称定。用乙腈溶解并定量稀释制成每1 mL约含布洛芬20 mg的溶液,作为布洛芬对照储备液;精密称取布洛芬杂质A、B、D、E、G、H、I、J、K、L、N、Q和R对照品适量,分别加乙腈溶解并定量稀释制成一定浓度的溶液,作为各杂质对照品储备液。精密量取上述各对照品储备液适量,置同一量瓶中,加乙腈-水(体积比50∶50)定量稀释制成每1mL约含布洛芬2mg、杂质A3μg、杂质B1μg、杂质D 1μg、杂质E1μg、杂质G1μg、杂质H1μg、杂质I1μg、杂质J3μg、杂质K1μg、杂质L1μg、杂质N3μg、杂质Q1μg和杂质R1μg的溶液,作为系统适用性溶液。
2.2.2 混合杂质对照品溶液
精密量取“2.2.1”条各杂质对照品储备液适量,置同一量瓶中,加乙腈-水(体积比 50∶50)定量稀释制成每1 mL约含杂质A3μg、杂质B1μg、杂质D1μg、杂质E1μg、杂质G1μg、杂质H1μg、杂质I1μg、杂质J3μg、杂质K1μg、杂质L1μg、杂质N3μg、杂质Q1μg和杂质R1μg的溶液,作为混合杂质对照品溶液。
2.2.3 供试溶液
取本品适量,加乙腈-水(体积比50∶50)定量稀释制成每1 mL中约含布洛芬2 mg的溶液,作为供试溶液。
2.2.4 对照溶液
精密量取供试溶液适量,用乙腈-水(体积比50∶50)稀释制成每1 mL含布洛芬20 μg的溶液,摇匀,作为对照溶液。
2.2.5 空白辅料溶液
取各辅料适量,加乙腈-水(体积比 50∶50)定量稀释制成一定浓度的溶液,作为空白辅料溶液。
2.3 方法学验证
2.3.1 系统适用性试验
按“2.2”条方法制备空白溶剂、空白辅料、对照溶液、供试溶液和系统适用性溶液,在“2.1”条色谱条件下分别进样,记录色谱图(图2)。结果显示:布洛芬及各杂质出峰顺序为杂质K、L、D、J、N、Q、A,布洛芬和杂质B、E、G、H、I、R。且各杂质峰、杂质峰与主药峰均可达到良好的分离,空白溶剂和空白辅料不干扰有关物质的测定。

Fig. 2 Chromatograms of blank solvent (a), blank excipient (b), reference solution (c), sample solution (d) and system suitability solution (e)图2 空白溶剂(a)、空白辅料(b)、对照溶液(c)、供试溶液(d)和系统适用性溶液(e)的液相色谱图
2.3.2 强制降解试验
热破坏:取注射液2 mL,于沸水浴条件下加热12 h;酸破坏:取注射液2 mL,加1 mol·L-1盐酸溶液5 mL,40 ℃水浴加热4 h,用1 mol·L-1氢氧化钠溶液调节pH值至中性;碱破坏:取注射液2 mL,加1 mol·L-1氢氧化钠溶液5 mL,40 ℃水浴加热4 h,用1 mol·L-1盐酸溶液调节pH值至中性;氧化降解试验:取注射液2 mL,加体积分数30%过氧化氢溶液5 mL,40 ℃水浴加热4 h;光破坏:取注射液2 mL,于强光(4 500 ± 500) lx条件下照射10 d。取上述条件的破坏试验溶液,按“2.2.3”条方法制备所需溶液,在“2.1”条色谱条件下分别进样,记录色谱图(图3)。结果显示,本品在光照和酸性环境中较稳定,基本无降解;在氧化和碱性环境中很不稳定,易降解产生极性大的杂质。各降解条件下,布洛芬峰与各杂质峰达到有效分离,方法专属性良好。并且,在强制降解条件下,杂质K、L、D和E为主要的降解产物。《英国药典》2013年版和《欧洲药典》8.0版收录的布洛芬原料药有关物质检查项规定杂质A、J和N为必检杂质,故重点考察杂质A、D、E、J、K、L和N。

Fig. 3 Chromatograms of sample (a), light (b), heat (c), oxidation (d), acid (e) and alkali (f) destruction图3 破坏前样品(a)和光(b)、热(c)、氧化(d)、酸(e)、碱(f)破坏的液相色谱图
2.3.3 检测限、定量限的确定和线性关系考察
将杂质A、B、D、E、G、H、I、J、K、L、N、Q、R对照品储备液稀释若干倍,在“2.1”条色谱条件下分别进样,记录色谱图。以主成分峰高约为基线噪音的3倍计算各杂质的检测限,以主成分峰高约为基线噪音的10倍计算各杂质的定量限。
取杂质A、B、D、E、G、H、I、J、K、L、N、Q、R对照品储备液适量,配制成不同质量浓度的一系列线性溶液。取各系列质量浓度的混合杂质对照溶液,在“2.1”条色谱条件下分别进样,记录色谱图。以进样质量浓度(g·L-1)为横坐标,峰面积为纵坐标,进行线性回归分析。结果显示,布洛芬注射液中的有关杂质A、B、D、E、G、H、I、J、K、L、N、Q、R在一定质量浓度范围内线性相关性良好。各杂质的检测限、定量限和线性范围结果见表2。

Table 2 Limits of detection and quantitation, linear range, regression equation and correlation coefficient表 2 检测限、定量限、线性范围、回归方程和相关系数
2.3.4 精密度试验
按“2.2.2”条方法制备混合杂质对照品溶液,在“2.1”条色谱条件下分别进样分析,连续进样6次,记录色谱图,计算各杂质峰面积的RSD值。杂质A、B、D、E、G、H、I、J、K、L、N、Q和R的RSD%值分别为0.40%、1.38%、0.29%、0.35%、0.38%、0.39%、0.38%、0.75%、0.41%、0.27%、0.62%、1.59%和0.63%(n = 6)。结果表明,本方法重复性良好(RSD%≤5.0%)。
由2名实验人员,按“2.2.3”条方法各平行配制6份供试溶液,在“2.1”条色谱条件下分别进样分析,连续进样2 d,记录色谱图,计算各杂质含量的RSD%值。杂质A、B、D、E、J和K的RSD%值分别为1.00%、1.27%、0.53%、0.91%、1.20%和0.67%(n = 6)。结果表明,本方法的日间精密度良好(RSD%≤5.0%)。
2.3.5 溶液稳定性试验
按“2.2.2”条和“2.2.3”条方法分别制备混合杂质对照品溶液和供试溶液,室温放置,分别于0、2、4、6、8、10、12 h取上述混合杂质对照品溶液和供试溶液,在“2.1”条色谱条件下分别进样分析,记录色谱图,计算各杂质和主药峰面积的变化率(RE%),结果见表3、4。结果表明,各杂质和主药峰面积的变化率(RE%)均小于5.0%,即混合杂质对照溶液和供试溶液在室温放置12 h内稳定性良好。
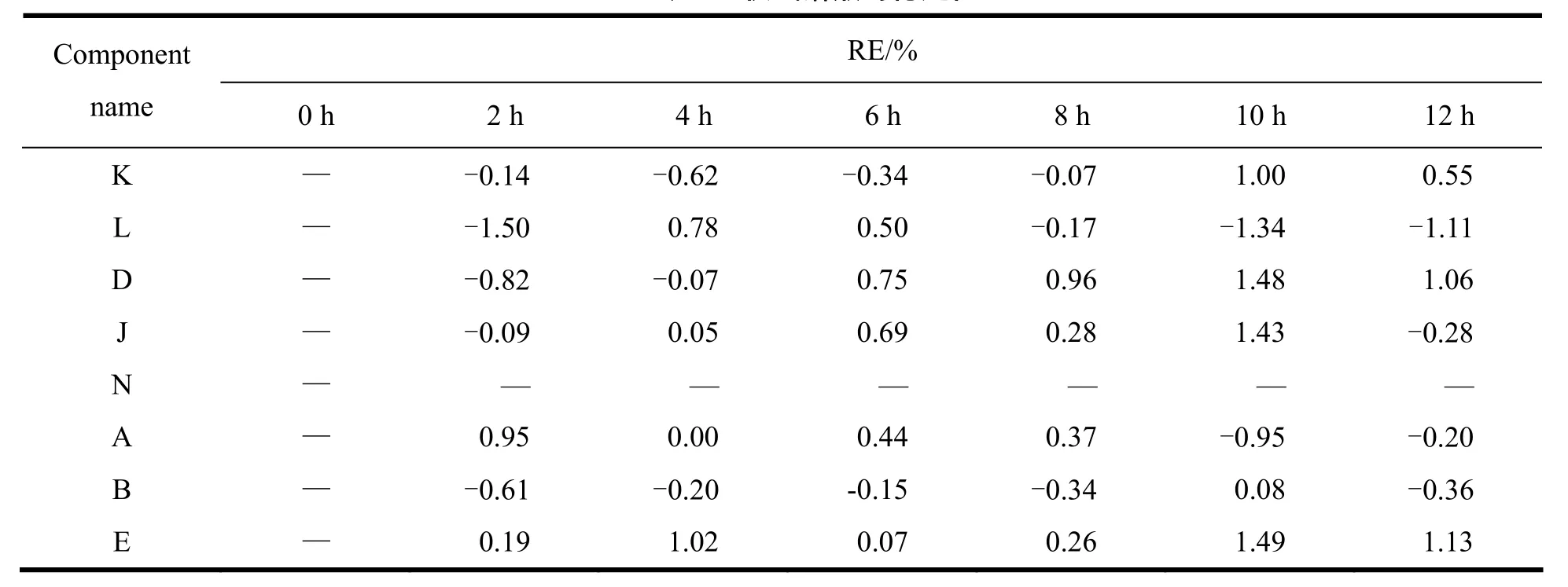
Table 4 Stability of sample solution表4 供试溶液的稳定性
2.3.6 准确度试验
采用加样回收试验,配制加样浓度分别为限度浓度80%、100%和120%水平的供试溶液,每个水平平均配制9份。在“2.1”条色谱条件下分别进样分析,记录色谱图。测得杂质A、B、D、E、G、H、I、J、K、L、N、O、P、Q和R的平均回收率分别为100.17%、99.85%、100.55%、99.72%、98.98%、99.09%、99.47%、101.15%、99.39%、99.68%、100.41%、100.63%和100.05%,RSD%分别为0.33%、0.55%、0.57%、0.99%、0.61%、1.13%、0.92%、0.95%、0.69%、0.45%、1.01%、0.72%和0.30%。结果表明,各杂质的回收率均在98% ~ 102%内,RSD%≤5.0%,说明本方法的准确度良好。
2.3.7 耐用性试验
按“2.2.2”条和“2.2.3”条方法制备混合杂质对照品溶液和供试溶液,分别考察不同色谱柱、波长、流速和柱温的微小变化对各杂质峰的分离度和含量变化的影响。结果表明,上述条件的微小变化和色谱柱的改变,均可使各杂质峰达到基线分离,杂质峰之间的分离度均不小于1.5,杂质A与布洛芬之间的分离度不小于1.2,说明本方法的耐用性良好。
2.3.8 样品中有关物质的测定
取3批供试品,按“2.2.3”条方法制备供试溶液,在“2.1”条色谱条件分别进样分析,记录色谱图。用外标法计算已知杂质的含量,用主成分自身稀释对照法计算未知杂质的含量,结果见表5。

Table 5 Determination results of related substances(%)表 5 有关物质的测定结果(%)
3 讨论
3.1 检测波长的选择
取布洛芬对照品10 mg,精密称定,用乙腈溶解,用乙腈-水(体积比为50∶50)稀释制成每1 mL含布洛芬10 μg的溶液,作为布洛芬对照溶液;另取布洛芬杂质A、B、D、E、G、H、I、J、K、L、N、Q、R对照品适量,精密称定,用乙腈溶解,并稀释至一定浓度的溶液,作为各杂质对照品储备液,分别精密量取各杂质对照品储备液适量,加乙腈-水(体积比为50∶50)稀释制成每1 mL含各杂质对照品10 ~ 20 μg的溶液,作为各杂质对照品溶液;以乙腈-水(体积比50∶50)为空白溶剂,在波长200 ~ 400 nm内进行紫外吸收扫描,记录紫外吸收光谱。结果表明,布洛芬、杂质A、B、D、E、G、H、I、J、K、L、N、Q和R分别在波长220、213.3、218.8、218.1、256、217.7、257.6、220.2、251.6、255.4、219.4、217.8、218.6和226.4 nm处有最大吸收。参照《英国药典》2013年版和《欧洲药典》8.0版布洛芬有关物质检查波长,确定检测波长为214 nm。
3.2 色谱柱的选择
分别考察了Thermo ODS HYPERSIL(150 mm × 4.6 mm,5 μm)、Agilent TC-C18(150 mm × 4.6 mm,5 μm)、Phenomenex Gemini C18(150 mm × 4.6 mm,5 μm)、Diammonsil C18(2)(150 mm× 4.6 mm,5 μm)、Waters Spherisorb ODS-2(150 mm × 4.6 mm,5 μm)和COSMOSIL C18-ARⅡ(150 mm × 4.6 mm,5 μm)柱对系统适用性溶液中各物质峰间的分离度的影响,结果表明:COSMOSIL C18-ARⅡ柱(150 mm × 4.6 mm,5 μm)能使各物质峰达到良好的分离,故选择COSMOSIL C18-ARⅡ(150 mm × 4.6 mm,5 μm)色谱柱。
3.3 流速的选择
分别考察流速为0.8、0.9、1.0、1.1和1.2 mL·min-1时,各物质的出峰时间和分离度。结果表明:流速在0.8 ~ 1.2 mL·min-1内,各杂质峰均可达到基线分离;随着流速的增加,杂质A与布洛芬、布洛芬与杂质B之间的分离度增大;而当流速小于1.0 mL·min-1,杂质R在分析时间内不出峰。结合柱压和色谱柱的耐用性,最终选择流动相流速为1.0 mL·min-1。
3.4 柱温的选择
分别考察柱温为25、28、30和35 ℃时,各物质的出峰时间和分离度。结果表明:柱温在25~ 35 ℃内,各杂质峰均可达到基线分离;随着柱温的增加,杂质A与布洛芬、布洛芬与杂质B之间的分离度略有减小;而当柱温低于28 ℃时,杂质R在分析时间内不出峰。考虑到色谱柱的耐用性,最终选择柱温为30 ℃。
4 结论
本文作者参照《英国药典》2013年版和《欧洲药典》8.0版收录的布洛芬原料药有关物质检查方法,建立了更加简单、快速、有效的高效液相色谱法,并进行方法学验证。同时,采用外标法和主成分自身稀释对照相结合的方法对布洛芬注射液中的已知杂质和未知杂质进行定量分析。结果表明,该方法灵敏度高,耐用性好,适用于布洛芬注射液中有关物质的研究。
[1] 李健和, 曹俊华, 易利丹, 等. 布洛芬静脉注射制剂的研发与临床应用[J]. 中国新药与临床杂志, 2011, 30(8): 584-587.
[2] 徐隽, 宋红萍, 刘忠, 等. 布洛芬注射液的镇痛抗炎解热作用[J]. 中国医院药学杂志, 2010, 39(17): 1500-1501.
[3] Health Ministry. The British Pharmacopeia[M]. Lomdon: British Pharmacopeia Commission, 2013: 1089.
[4] European Directorate for the Quality of Meadicines & Healthcare (EDQM). European Pharmacopeia[M]. 8.0 ed. Stasboury: Council of Europe, 2013: 2473-2475.
[5] 卢翔, 徐旻明. HPLC法测定布洛芬的有关物质[J]. 中国药师, 2012, 15(7): 984-986.
[6] 彭东明, 王福东, 卢茂芳, 等. HPLC法测定布洛芬注射液的含量及有关物质[J]. 华西药学杂志, 2013(2): 195-196.
[7] HUIDOBRO A L, RUPÉREZ F J, BARBAS C. Tandem column for the simultaneous determination of arginineibuprofen and related impurities by liquid chromatography [J]. J Chromatogr A, 2006, 1119: 238-245.
[8] GASCO LOPEZ A I, IZQUIERDO-HORNILLOS R, JIMENEZ A. LC method development for ibuprofen and validation in different pharmaceuticals [J]. J Pharm Biomed Anal, 1999, 21: 143-149.
[8] 刘芳, 柳小秦, 徐长根, 等. HPLC法测定布洛芬原料药及制剂的有关物质[J]. 药物分析杂志, 2011, 31(3): 552-557.
[9] 丁洪亮. HPLC法测定布洛芬布洛芬注射液的含量及有关物质[J]. 药学与临床研, 2010, 18(6): 583-584.
Simultaneous determination of thirteen related impurities of ibuprofen injections by high performance liquid chromatographic method
HAO Xiao-li1, LIU Xiao-yun1, MA Pan-qin1,2, MA Yong-fu1,2, SUN Zhi-su1, SUN Jin1*
(1. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China; 2. Kangya of Ningxia Pharmaceuticals CO., LTD., Yinchuan 750002, China)
ObjectivesTo develop an HPLC method for simultaneous determination of thirteen related impurities in ibuprofen injection.MethodThe chromatographic separation was achieved with a gradient mobile phase consisting of phosphoric acid solution-acetonitrile, a COSMOSIL C18- ARⅡcolumn (150 mm × 4.6 mm, 5 μm) and UV wavelength at 214 nm. The column temperature was 30 ℃ and flow rate was 1.0 mL·min-1.ResultsIbuprofen, arginine and thirteen impurities were achieved baseline separation and the impurities were within the limit.ConclusionsThe method is simple, rapid, accurate, reliable and can be applied for quality control of ibuprofen injection.
pharmaceutics; related impurity; HPLC; ibuprofen; injection
R 94
:A
(本篇责任编辑:赵桂芝)
(2015)06-0196-09
10.14146/j.cnki.cjp.2015.06.002
2015-03-30
郝晓丽(1988-), 女(汉族), 山西忻州人, 硕士研究生, E-mail haoxiaoli19880219@126.com; *
:孙进(1975-), 男(汉族), 安徽金寨人, 教授, 主要从事药剂学研究, Tel. 024-23986325, E-mail sunjin66@21cn.com。

