热熔挤出法和喷雾干燥法制备布洛芬固体分散体的比较
李朋朋,卢恩先,周丽莉
(1. 沈阳药科大学 制药工程学院,辽宁 沈阳 110016;2. 上海奥科达生物医药科技有限公司,上海 201318)
热熔挤出法和喷雾干燥法制备布洛芬固体分散体的比较
李朋朋1,2,卢恩先2,周丽莉1*
(1. 沈阳药科大学 制药工程学院,辽宁 沈阳 110016;2. 上海奥科达生物医药科技有限公司,上海 201318)
目的比较热熔挤出法和喷雾干燥法制备的布洛芬固体分散体的溶解度、体外溶出速度及药物存在状态方面的差异。方法以聚乙烯吡咯烷酮(PVP K30)为载体,药物载体质量比例为1∶3,通过热熔挤出法和喷雾干燥法制备布洛芬的固体分散体,测定并比较它们在0.1 mol·L-1盐酸中的溶出差异;采用差示扫描量热分析实验(differential scanning calorimetry, DSC)和X射线衍射实验(X-ray diffractometer, XRD)对布洛芬固体分散体进行物相鉴别。结果与布洛芬原料药和物理混合物相比,热熔挤出工艺对药物的溶解度和溶出度提高较明显,喷雾干燥工艺对药物的溶解度和溶出度提高非常显著;物相鉴别表明,物理混合物中药物仍有部分以晶体形式存在,采用热熔挤出和喷雾干燥工艺制备的固体分散体中药物均以无定形状态存在。结论相比热熔挤出法,采用喷雾干燥法制备的布洛芬-PVP K30固体分散体更能显著提高药物的溶解度和溶出度,布洛芬在30 min内即可接近完全释放。
药剂学;固体分散体;热熔挤出法;喷雾干燥法;布洛芬;溶出度
布洛芬(ibuprofen)为非甾体抗炎药, 具有解热镇痛及抗炎作用,用于治疗风湿性关节炎、类风湿性关节炎、骨关节炎、强直性脊椎炎和神经炎等[1]。布洛芬在生物药剂学(BCS)分类中属于Ⅱ类,水溶性差,渗透性高。布洛芬溶解度具有pH依赖性,随着溶液pH 值的升高溶解度增大[2],在胃液中较低的溶解度和缓慢的溶出速度成为布洛芬被人体快速吸收的限制性因素。
固体分散体技术是指将难溶性药物以分子、胶态、无定形、微晶等状态均匀分散在一种或多种固体载体物质中形成高度分散体系的一种技术,目前常用来提高难溶性药物溶解度和溶出度。该技术具有可供选择的载体类型多、制备方法多样、增溶效果明显的特点[3]。近年来有学者[4]通过溶剂-熔融法以PEG 6000为载体制备瑞格列奈的固体分散体,药物载体质量比为1∶5和1∶10时,15 min内药物累积释放度达到100%,显著提高了药物的释放速度;也有学者[5]采用超临界流体法以PVP K30为载体制备尼莫地平的固体分散体,药物载体质量比为1∶8时,10 min内药物的溶出达到95%;还有学者[6]通过喷雾干燥法以PVP K30为载体制备阿司匹林的固体分散体,药物载体质量比为1∶6时,30 min内阿司匹林的溶出度达到了99.8%。众多例子表明,通过固体分散体技术能够显著提高难溶性药物的溶出度及溶解速度,但传统方法制备得到的固体分散体产品具有产品后续处理困难、工艺重现性差、产品物理稳定性不好等缺点,不利于工业化生产。热熔挤出法和喷雾干燥法是近年来制备固体分散体较为新颖的可连续化生产工艺,增溶效果明显,且操作过程参数可严格控制,工艺重现性好,但少有文献报道2种工艺制备固体分散体的差异,因此作者尝试以低熔点的布洛芬(θm=77.5 ℃)为模型药物,以具有较高玻璃转化温度的PVP K30(θg=160 ℃)[7]为亲水性载体制备布洛芬的固体分散体,并比较热熔挤出法和喷雾干燥法2种不同工艺制备的固体分散体在提高药物溶出度和药物存在状态方面的差异。
1 仪器与材料
Pharma 11热熔挤出仪(美国Thermo Fisher 科技公司),B-290喷雾干燥仪(瑞士Buchi 有限公司),U5粉碎机(加拿大Quadro科技有限公司),GG92-Q1000差示扫描量热仪(美国TA仪器公司),Bruker D8X射线衍射仪(德国Bruker AXS公司),RCZ-8M智能溶出试验仪(天津天大天发科技有限公司),UV2400PC紫外可见分光光度计(上海舜宇恒平科学仪器有限公司),MS105DU电子天平(梅特勒托利多仪器(上海)有限公司),DZF-6050真空干燥箱(上海精宏实验设备有限公司)。
布洛芬原料药(纯度质量分数为99.75%,湖北康宝泰精细化工有限公司,批号 20140601),PVP K30(巴斯夫(中国)有限公司,批号 S0053),盐酸、无水乙醇及其他试剂(分析纯,市售)。
2 方法
2.1 物理混合物的制备
将布洛芬原料药和载体辅料PVP K30干燥至质量恒定,按质量比1∶2、1∶3、1∶4、1∶5分别称取适量,过177 µm筛,在研钵中充分研磨混合均匀,储存于干燥器内备用。
2.2 Modulated DSC方法筛选合适的药物载体比例
分别称取4.0~5.0 mg药物-载体物理混合物样品,置于DSC仪器中铝盘内,经历快速升温-冷却-慢速升温的循环过程,具体参数设定为:样品在20 ℃下恒温1 min,然后以20 ℃·min-1的速度快速升至180 ℃,保持恒温1 min,再以20 ℃·min-1的速度冷却至20 ℃后保持恒温1 min,最后以1 ℃·min-1的速度调制升温至170 ℃,调制温度为±0.75 ℃·min-1,得到物理混合物的Modulated DSC曲线,通过测量不同药物载体质量比的物理混合物在升温-冷却-升温的过程中形成无定形态物质的玻璃转化温度,筛选合适的药物载体比例。
2.3 热熔挤出法制备固体分散体
称取混合好的布洛芬-PVP K30物理混合物适量,投于热熔挤出仪的料斗内,在如下设定温度下进行热熔挤出:die(100 ℃)-zone8(110 ℃)-zone7(115 ℃)-zone6(115 ℃)-zone5(115 ℃)-zone4 (105 ℃)-zone3(95 ℃)- zone2(80 ℃),以50 r·min-1的速度喂料,得到的淡黄色条状挤出物放于真空干燥箱中40 ℃干燥48 h,经过粉碎机粉碎后过177 µm筛网即得布洛芬-PVP K30固体分散体,储存于干燥器中备用。
2.4 喷雾干燥法制备固体分散体
称取混合好的布洛芬-PVP K30物理混合物适量,溶解于无水乙醇中制备成质量浓度50 g·L-1的澄清透明溶液,将溶液在如下操作参数进行喷雾干燥:进风温度85 ℃、喷雾速度4 mL·min-1、喷雾压力60 kPa、出风温度50~55 ℃,收集到的粉末于40 ℃真空干燥箱中干燥48 h后储存于干燥器中备用。
2. 5 分析方法
2.5.1 最大吸收波长的选择
称取干燥至质量恒定的布洛芬适量,置于100 mL量瓶中,加入0.1 mol·L-1盐酸溶液适量,超声使其充分溶解,放置至室温后用0.1 mol·L-1盐酸l溶液定容至100 mL。以0.1 mol·L-1盐酸溶液为空白,在波长200~400 nm内进行全波长紫外扫描,布洛芬在波长263 nm处有最大吸收,且在此处辅料 PVP K30没有干扰,故选择263 nm作为测定布洛芬紫外测定波长。
2.5.2 标准曲线的制备
精密称取干燥至质量恒定的布洛芬200.0 mg,置于100 mL量瓶中,加少量无水乙醇超声20 min使其充分溶解,放至室温后,用0.1 mol·L-1盐酸溶液定容至100 mL,摇匀。分别精密量取0.5、1.0、2.0、3.0、4.0和5.0 mL溶液,置于10 mL量瓶中,加入0.1 mol·L-1盐酸溶液稀释至刻度,摇匀,以0.1 mol·L-1盐酸溶液为空白,在波长263 nm处测定吸光度,以吸光度(A)对质量浓度(ρ)进行线性回归,得标准曲线方程:A=1.400×10-3ρ+7.100 ×10-3(r=0.999 4),线性范围为50.0~500.0 mg·L-1。标准曲线见图1。

Fig. 1 Standard curve of ibuprofen图1 布洛芬的标准曲线
2.5.3 体外溶出度的测定
称取含有100 mg布洛芬的原料药、布洛芬-PVP K30的物理混合物和固体分散体,分别进行溶出度实验。参照《中华人民共和国药典》2010年版(二部)附录XC第二法,转速为100 r·min-1,温度 (37±0.5) ℃,以0.1 mol·L-1盐酸溶液为溶出介质,在5、10、20、30、45和60 min时间点分别取样5 mL,并补充同温度下等体积的溶出介质。溶出样品经紫外分光光度计测量吸光度,计算累积溶出度。
2.5.4 饱和溶解度的测定
取布洛芬原料药、布洛芬-PVP K30物理混合物及固体分散体适量,以0.1 mol·L-1盐酸为溶剂,于37 ℃恒温水浴中搅拌48 h 后,制成过饱和溶液,用0.45 μm 滤膜过滤,取续滤液作为样品溶液,经过适当稀释后测其紫外吸收,按“2.5.2”条中标准曲线方程计算其饱和溶解度。
DSC工作条件:将待测样品置于DSC铝坩中,以空白铝坩埚为参比。样品质量为4.0~5.0 mg,扫描范围为0~220 ℃,升温速率为10.0 ℃·min-1,扫描气氛为氮气。
Modulated-DSC工作条件:将待测样品置于DSC铝坩中,以空白铝坩埚为参比。样品质量为4.0~5.0 mg,扫描范围为0~170 ℃,升温速率为10.0 ℃·min-1,调制温度为±0.75 ℃·min-1,扫描气氛为氮气。
2.5.6 X射线衍射实验
工作条件:Cu-Ka管电流为40 mA,高压强度为40 kV,衍射角(2θ)的扫描步距为0.02°,扫描速度为5°·min-1,测定范围为3°~40°,扫描方式为连续扫描,结果见图6。
3 结果
3.1 合适的药物载体比例的选择
通过对不同比例的药物-载体物理混合物进行调制差示扫描量热分析可知,不同药物比例的布洛芬物理混合物均可经过升温-冷却-升温过程形成无定形态,表现出单一的θg值,药物载体的质量比为1∶2、1∶3、1∶4和1∶5时形成的无定形态物质的θg分别为52.80 ℃、84.72 ℃、94.70 ℃和115.10 ℃,结果见图2。因无定形态物质θg在高于室温50 ℃以上时理化性质较稳定,故选择药物载体质量比为1∶3进行固体分散体的制备。
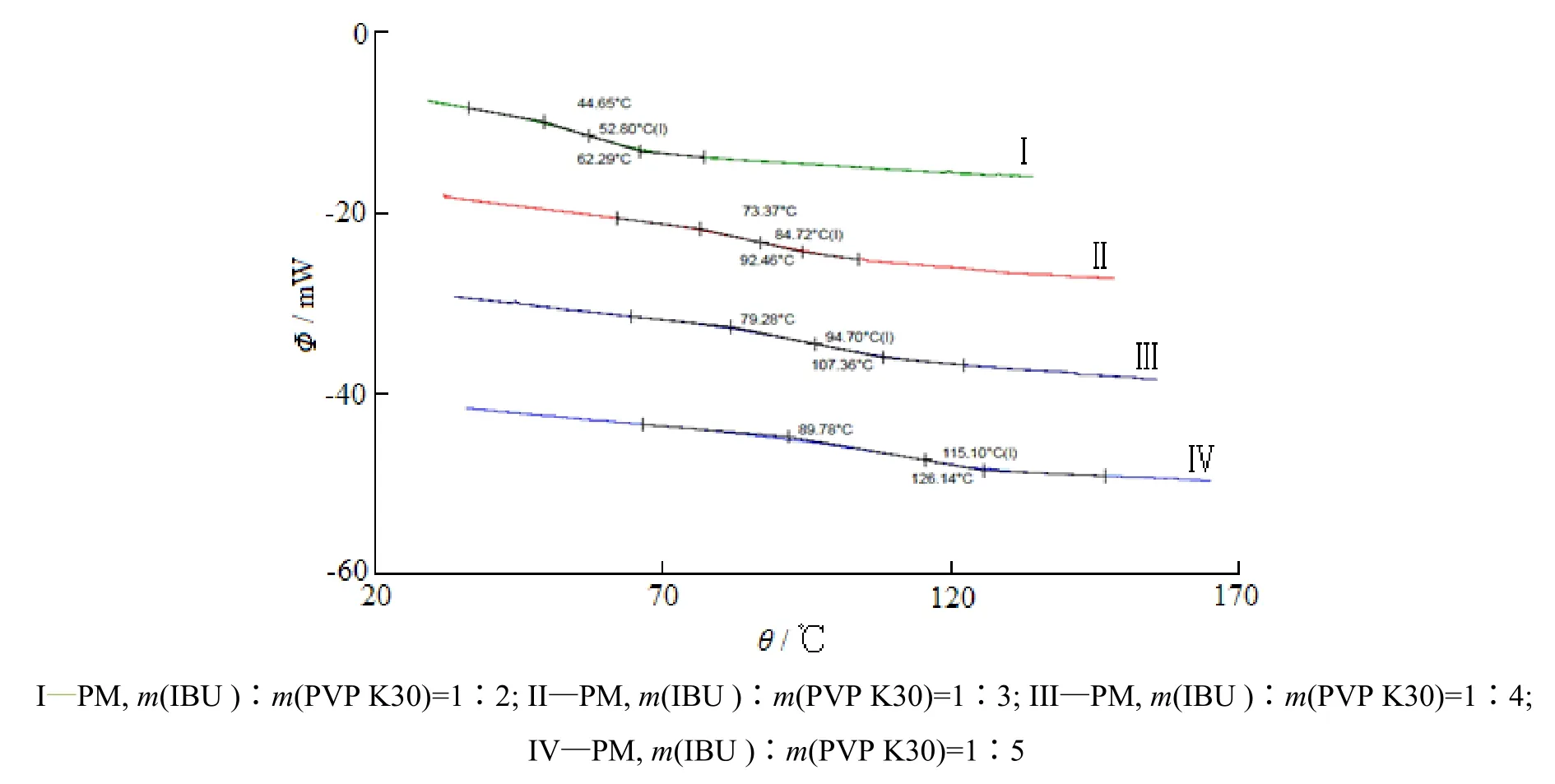
Fig. 2 Modulated-DSC profiles of ibuprofen-PVP K30 physical mixtures at different mass ratios图 2 不同比例布洛芬-PVP K30物理混合物的调制差示扫描量热分析曲线
3.2 饱和溶解度的测定
通过测定布洛芬、 布洛芬-PVP K30物理混合物及不同方法制备的布洛芬-PVP K30的固体分散体在0.1 mol·L-1盐酸溶液中的饱和溶解度可知:相较于布洛芬原料药,物理混合物中布洛芬的饱和溶解度增加不明显;热熔挤出法和喷雾干燥法制备得到的固体分散体溶解度则有显著提高,相较于原料药,分别提高了23倍和30倍,结果见表1。
从信息论的角度来看,绩效评估的过程就是一个信息流从信息搜集、筛选到加工、输出、反馈的过程。绩效评估结果的有效性取决于信息的真实性和准确性。信息数量不足,不能全面反映评价对象的全貌;信息质量失真,则会造成评估结果的失误。因此,要提高绩效评估的科学性和准确性,必须要有充裕、准确的信息来源作为保证。政府主管部门要发挥主导作用,积极推进高校信息公开工作,高校内部也要高标准建设信息管理系统。

Table 1 Saturated solubility of ibuprofen, physical mixture and solid dispersions in 0.1 mol·L-1HCl表1 布洛芬及其物理混合物和固体分散体在0.1mol·L-1盐酸溶液中的饱和溶解度
3.3 体外溶出度测定
通过对布洛芬原料药、布洛芬-PVP K30物理混合物及固体分散体体外累积溶出度的测定,得到溶出曲线(图3)。由图3可知:物理混合物的累积溶出度高于布洛芬原料药,但增加并不明显;与布洛芬原料药和物理混合物相比,固体分散体的溶出度均有明显改善,且采用喷雾干燥法较热熔挤出法更能够显著提高布洛芬的溶出度;采用喷雾干燥工艺制备的固体分散体,30 min内药物即可达到完全释放。
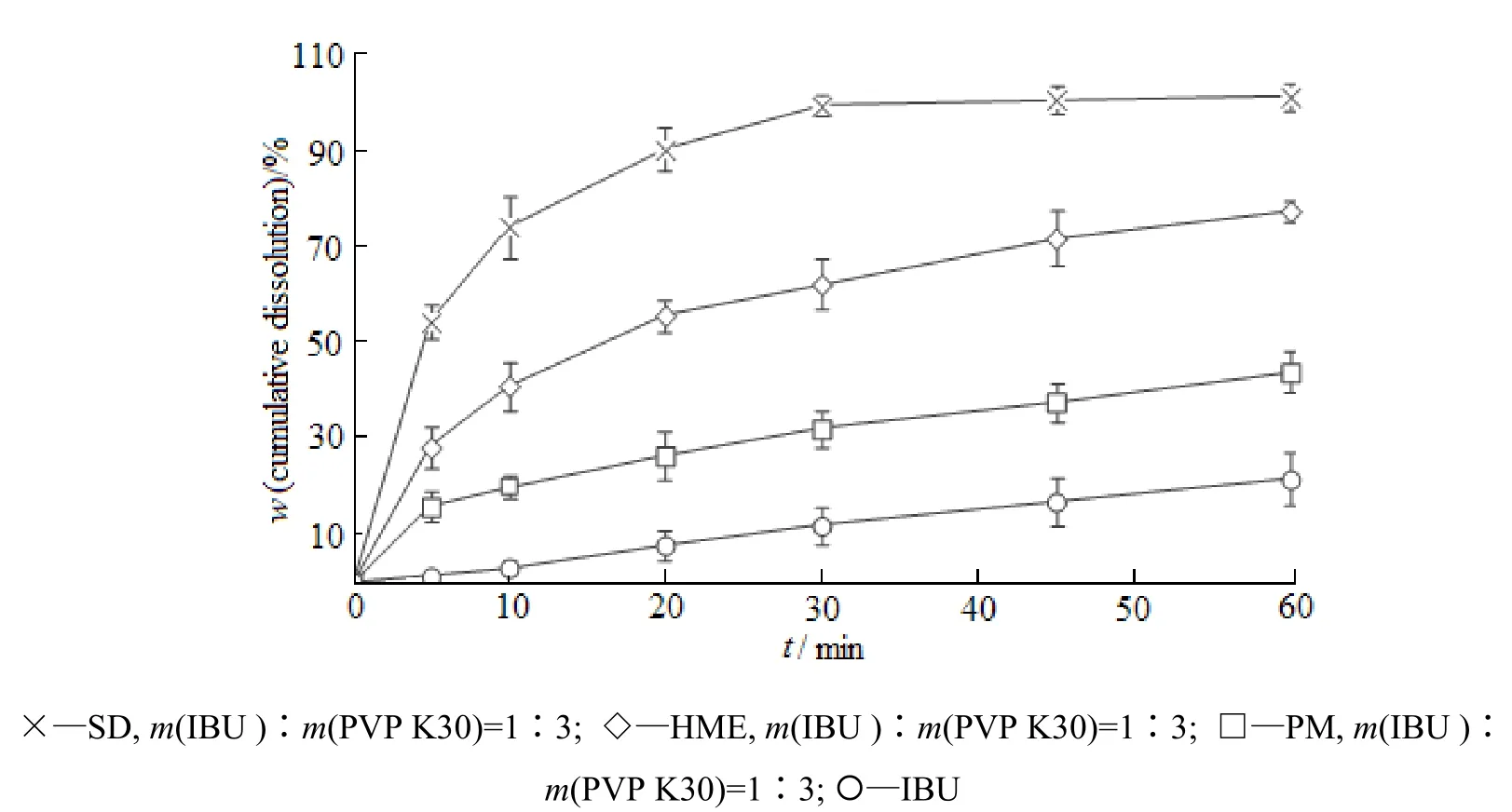
Fig. 3 Dissolution profiles of ibuprofen, ibuprofen-PVP K30 physical mixture and solid dispersions in 0.1 mol·L-1HCl (n=6)图 3 布洛芬及布洛芬-PVP K30的物理混合物和固体分散体在0.1 mol·L-1HCl中的溶出曲线(n=6)
3.4 物相鉴别
3.4.1 差示扫描量热分析
分别对布洛芬原料药、PVP K30、布洛芬-PVP K30的物理混合物和固体分散体进行差示扫描量热分析,结果见图4、5。由DSC扫描图知,布洛芬原料药在程序升温至77.5 ℃时出现较强的熔化吸热峰,表明原料药中布洛芬以晶体形式存在,但当温度高于170 ℃时布洛芬会发生一定程度的降解。物理混合物中存在较弱的布洛芬特征吸热峰,表明物理混合物中布洛芬仍有少部分以晶体形式存在。采用热熔挤出工艺和喷雾干燥工艺制备的固体分散体中,布洛芬特征吸热峰消失,且Modulated-DSC扫描图中存在玻璃化转变对应的相变,相应的θg分别为84.37 ℃、84.16 ℃(图5),表明固体分散体中布洛芬以无定形状态分散于载体聚合物中。
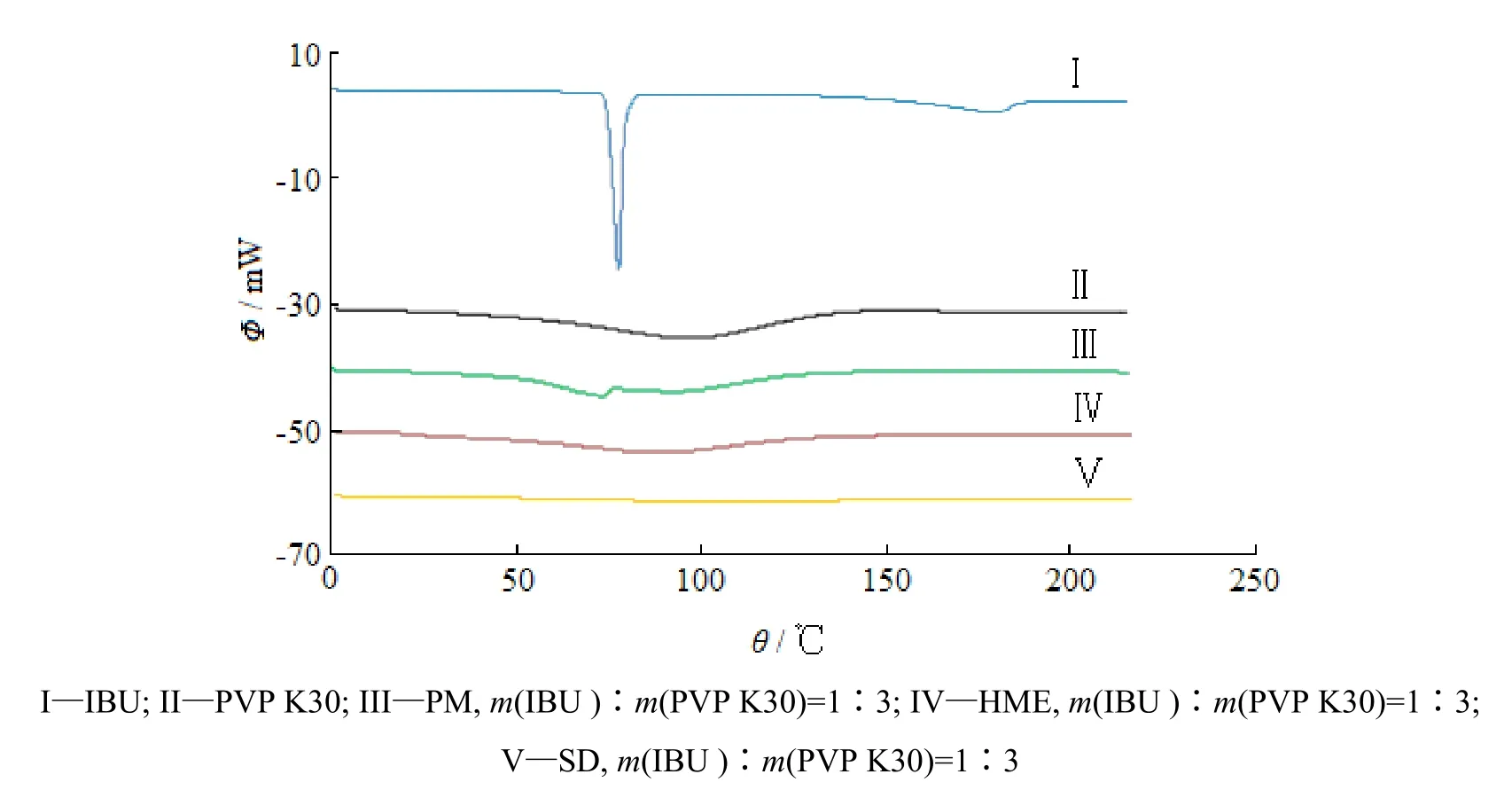
Fig. 4 Differential scanning calorimetry profiles of ibuprofen, PVP K30, physical mixture and solid dispersions图 4 布洛芬、PVP K30及其物理混合物和固体分散体的差示扫描量热曲线
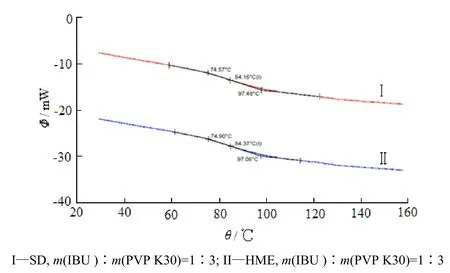
Fig. 5 Modulated-DSC profiles of ibuprofen / PVP K30 solid dispersions图5 布洛芬-PVP K30固体分散体的调制差示扫描量热分析曲线
3.4.2 X射线衍射分析
分别对布洛芬原料药、PVP K30、布洛芬-PVP K30的物理混合物和固体分散体进行粉末X射线衍射分析,结果见图6。由XRD扫描图可知,布洛芬原料药在2θ=6.340°、12.452°、16.808°、17.876°、19.691°、20.379°、22.555°和24.791°等位置显示出较强的晶体衍射特征峰;由于载体聚合物PVP K30较强的抑晶作用,物理混合物中布洛芬的晶体衍射特征峰强降低,但在2θ=6.340°、12.452°、16.808°、22.555°和24.791°处仍有一定的布洛芬晶体衍射特征峰,表明物理混合物中布洛芬仍有部分以晶体形式存在;采用热熔挤出和喷雾干燥工艺制备的固体分散体中,布洛芬的晶体衍射特征峰均消失,表明固体分散体中布洛芬已经转变成无定形态。
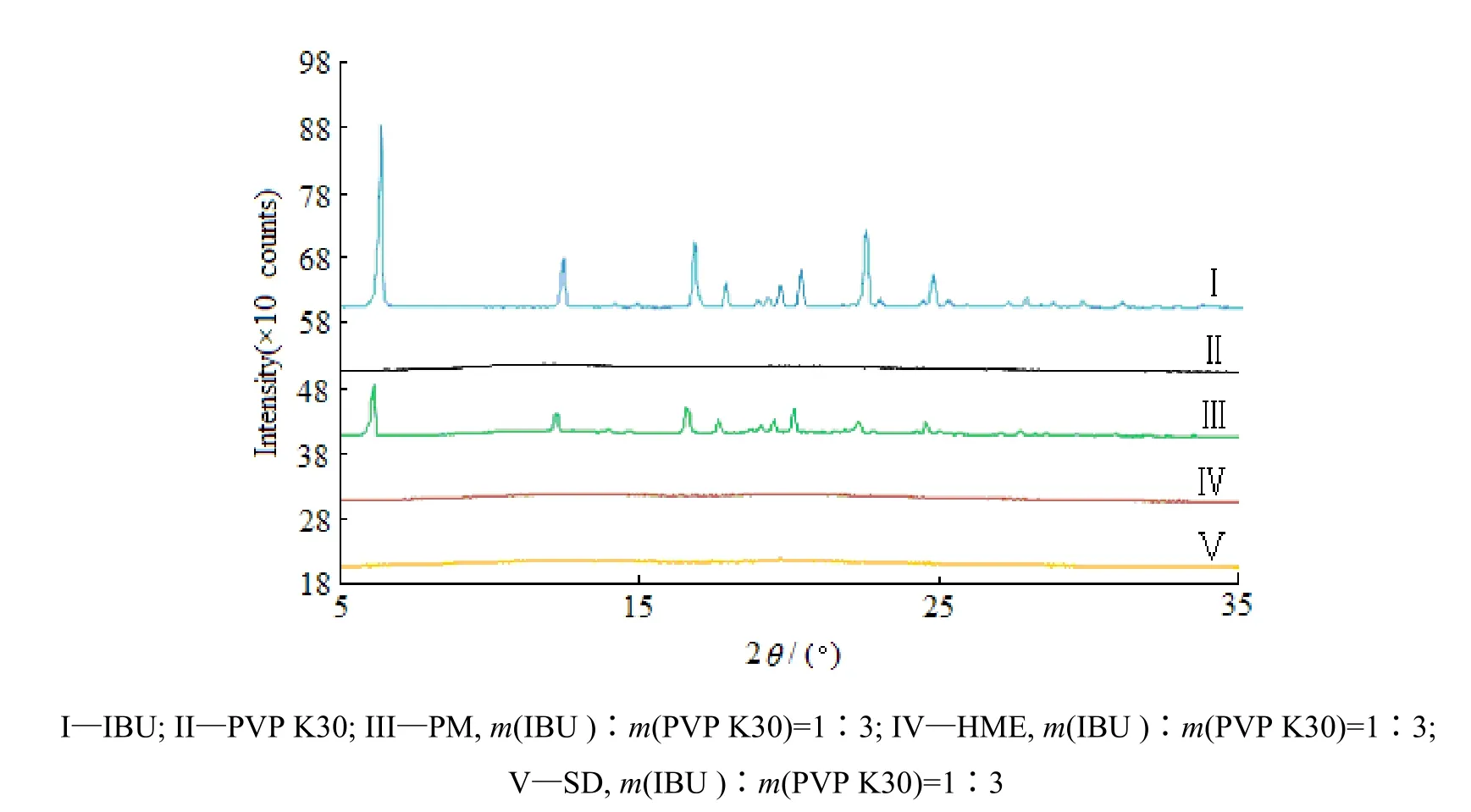
Fig. 6 X-ray diffraction patterns of ibuprofen, PVP K30, physical mixture and solid dispersions图6 布洛芬、PVP K30及其物理混合物和固体分散体的X-射线衍射分析曲线
4 讨论
a. 本文研究了热熔挤出法和喷雾干燥法制备的布洛芬固体分散体在溶出度和物相存在状态方面的差异。DSC和XRD分析实验表明,热熔挤出和喷雾干燥工艺制备的布洛芬固体分散体均以无定形态存在;饱和溶解度实验和溶出度实验表明,喷雾干燥工艺在提高布洛芬溶解度和溶出度方面均优于热熔挤出工艺。
b. 采用热熔挤出工艺制备固体分散体,布洛芬和载体聚合物在热熔挤出仪的双螺杆之间发生强烈的同向啮合作用,布洛芬和载体聚合物之间发生相互高度分散,制备得到的固体分散体致密性高、孔隙率低、亲水性比表面积小,对药物的饱和溶解度提升作用有限,且溶出过程中固体分散体颗粒之间易粘连成团块,进一步减小了药物与溶出介质接触的表面积,降低了药物的溶出度。
c. 采用喷雾干燥工艺制备固体分散体,布洛芬和载体聚合物溶解在溶剂中后形成均一的澄清透明溶液,布洛芬和载体聚合物在分子水平上发生极度分散,其分散程度大于热熔挤出工艺;形成的固体分散体疏松多孔、亲水性比表面积大,大大地增加了药物的饱和溶解度,溶出时固体分散体能够快速均匀的分散在溶出介质中,从而发生药物的速释,30 min内布洛芬即可达到完全释放。
因此,对比热熔挤出工艺和喷雾干燥工艺,以PVP K30为载体聚合物,利用喷雾干燥法制备布洛芬的固体分散体是提高布洛芬体外溶出度更为有效的方法,可以进一步进行稳定性及体内药动学考察。
[1] 陈曦, 魏振平. 布洛芬微粉化及其增溶作用的研究[D]. 天津: 天津大学, 2009: 2-3. .
[2] GRYCZKEB A, SCHMINKEB S, MANIRUZZAMANA M, et al. Development and evaluation of orally disintegratingtablets (ODTs) containing Ibuprofen granules prepared by hot melt extrusion [J]. Colloids and Surfaces B: Biointerfaces, 2011, 86: 275-284.
[3] 李述溪, 李强. 布洛芬自微乳化载药系统的研究[D]. 哈尔滨: 黑龙江大学, 2009 : 14-18.
[4] 李建伟, 海丽娜, 申爱卓, 等. 瑞格列奈固体分散体的制备及体外溶出[J]. 沈阳药科大学学报, 2014, 31(8): 606-609.
[5] 岑琴, 周丽莉. 超临界CO2制备尼莫地平固体分散体的研究[D]. 沈阳: 沈阳药科大学, 2008: 38-40.
[6] 张锴, 王丽虹, 管勇军, 等. 喷雾干燥法制备阿司匹林固体分散体及其胶囊制备与体外特性研究[J]. 中国现代应用药学, 2014, 31(8): 973-977.
[7] TEJA S B, PATIL S P, SHETE G, et al. Drug-excipient behavior in polymeric amorphous solid dispersions [J]. Excipients and Food Chem, 2013, 4(3): 70-94.
The comparison of solid dispersions of ibuprofen prepared by hot melt extrusion method and spray drying method
LI Peng-peng1, LU En-xian2, ZHOU Li-li1
(1. School of Pharmaceutical Engineering, Shenyang Pharmaceutical University, Shenyang 110016, China; 2. Shanghai Aucta Pharmaceuticals, LLC., Shanghai 201318, China)
ObjectiveTo compare the differences of saturated solubility, dissolution and phase state of ibuprofen solid dispersions prepared by hot melt extrusion method and spray drying method.MethodsUsing polyvinyl pyrrolidone (PVP K30) as carrier, with drug to carrier ratio of 1∶3, ibuprofen solid dispersion was prepared by hot melt extrusion (HME) and spray drying (SD) method, and the saturated solubility and dissolution of ibuprofen solid dispersion in 0.1 mol·L-1HCl were determined and compared. Differential scanning calorimetry (DSC) and X-ray diffractometer (XRD) were used to investigate the ibuprofen status in the solid dispersions.ResultsThe saturated solubility and dissolution of ibuprofen were obviously and significantly increased by HME and SD method compared with ibuprofen raw material and its physical mixture. Phase identification showed that part of ibuprofen in physical mixture still exists in crystal form, however, ibuprofen exist in amorphous state in solid dispersions prepared by HME&SD methods.ConclusionCompared with hot melt extrusion method, ibuprofen-PVP K30 solid dispersion prepared by spray drying method can significantly improve the saturated solubility and in vitro dissolution of ibuprofen, and ibuprofen can achieve complete release within 30 min.
pharmaceutics; solid dispersion; hot melt extrusion method; spray drying method; ibuprofen; dissolution
R 94
A
(本篇责任编辑:赵桂芝)
(2015)04-0126-08
10.14146/j.cnki.cjp.2015.04.002
2015-01-19
李朋朋(1990-), 男(汉族), 河南开封人, 硕士研究生, E-mail pengpeng.li@auctapharma.com; *
周丽莉(1956-), 女(汉族), 辽宁沈阳人, 教授, 硕士生导师, 主要从事制药分离新技术研究, Tel. 024-23986406, E-mail zhoulilisy@163.com

