湿法研磨结合流化床包衣法制备盐酸度洛西汀肠溶微丸
芦 威,唐 星
(沈阳药科大学 药学院,辽宁 沈阳 110016)
湿法研磨结合流化床包衣法制备盐酸度洛西汀肠溶微丸
芦 威,唐 星*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的采用湿法研磨技术及流化床包衣法制备盐酸度洛西汀肠溶微丸,并依据体外释放试验对处方进行筛选。方法采用湿法研磨技术将难溶性盐酸度洛西汀与亲水性载体羟丙甲纤维素(HPMC-E5)进行前处理,作为药物混悬包衣液,以羟丙甲纤维素溶液作为隔离层材料,Eudragit L30D-55水分散体作为肠溶层材料,底喷流化床包衣法制成盐酸度洛西汀肠溶微丸。通过考察体外释放度筛选盐酸度洛西汀肠溶微丸工艺处方。结果药物经过湿法研磨后,粒径由2.99×104nm降低到595 nm。由体外释放试验可知,自制制剂与参比制剂体外释放曲线基本一致,在pH值1.0盐酸溶液中120 min时释放度小于10%,而在pH值6.8磷酸盐缓冲液中60 min时释放度大于75%,符合标准。扫描电镜可见微丸表面光滑、圆整。结论湿法研磨技术可显著降低药物粒径,提高包衣效率及药物体外释放度。盐酸度洛西汀肠溶微丸体外释放符合要求,性状稳定,制备工艺简单易行,有望应用于工业化生产。
药剂学;肠溶微丸;湿法研磨;盐酸度洛西汀;体外释放
盐酸度洛西汀(duloxetine hydrochloride,商品名:Cymbalta®)是选择性5-羟色胺(5-HT)和去甲肾上腺素(NE)再摄取抑制剂(SNRI),对2种神经递质具有很强的抑制作用,能使大脑和脊髓中的5-羟色胺和去甲肾上腺素浓度升高,可改善抑郁患者的病情,并提高5-羟色胺和去甲肾上腺素2种神经递质在调控情感和对疼痛敏感程度方面的作用,提高机体对疼痛的耐受力[1],该药于2004年被美国FDA批准用于治疗抑郁症(depression)和糖尿病性神经病变(diabetic neuropathy)。2007年美国FDA批准用于广泛性焦虑障碍(generalized anxiety disorder,GAD)的治疗。2006年国内批准上市[2]。盐酸度洛西汀化学名为( S)-N-甲基-3-( 1-萘氧基)-2-噻吩丙胺盐酸盐,分子式为C18H19NOS·HCl。
盐酸度洛西汀微溶于水,为提高药物体外释放度及生物利用度,采用湿法研磨技术制备盐酸度洛西汀与亲水性载体辅料的混合溶液,可降低药物的结晶度、增加表面积、改善润湿性等作用促进药物的溶出,是增加药物溶出速率的非常有效的途径[3]。由Noyes-Whitney 方程:dc/dt=kS(Cs-C)(dc/dt为溶解速度,k为溶解速度常数,S为固体的表面积,Cs为溶质在溶解介质中溶解度)可知,溶出速度与溶出的有效表面积成正比,药物与亲水性辅料共研磨后,使药物粒径显著减小,增大有效溶出面积,提高了药物的溶出速度,所以湿法研磨技术可有效提高体外释放度和生物利用度。盐酸度洛西汀体内吸收与大多数抗抑郁药不同,其在酸性介质下迅速水解为萘酚(化学结构式见图1),但萘酚无抗抑郁作用,所以本研究将盐酸度洛西汀制成肠溶微丸,可使肠溶微丸完整的通过胃部,有效延长药物释放时间,到达肠道pH值超过5.5的部位后,肠溶衣薄膜立即溶解,释放药物,发挥药效[4]。盐酸度洛西汀易与肠溶材料醋酸羟丙基甲基纤维素琥珀酸酯(HPMCAS)和羟丙基甲基纤维素邻苯二甲酸酯(HPMCP)中聚合物降解产物及游离酸发生反应,生成琥珀酰胺度洛西汀和邻苯二酰胺度洛西汀[5](化学结构式见图1),本研究采用的肠溶层材料Eudragit L30D-55是甲基丙烯酸和丙烯酸乙酯的阴离子共聚物的水分散体,聚合物分子中游离羧基基团和酯基基团之比为1∶1,含有的游离羧基易与盐酸度洛西汀反应,故需在药丸与肠溶层之间包裹一定厚度的隔离层以防止药物与酸性肠溶层直接接触发生降解,同时使微丸表面光滑。

Fig. 1 Chemical structures of duloxetine and degradation products图1 度洛西汀及其降解物的化学结构式
1 仪器与材料
UV759紫外分光光度计(上海精密科学仪器有限公司),SU8010N 高分辨场发射扫描电镜(日本日立公司),ZRS-8G溶出仪(天津天大天发有限公司),FA-1104 电子天平(上海精密科学仪器有限公司),pH计(上海精密科学仪器有限公司),Mini-Easy纳米研磨机(瑞驰拓维科技有限公司),NicompTM 380ZLS 动态光散射粒度测定仪(Santa Barbara,California,USA),FLB-3流化床制粒包衣机(辽宁祥安制药机械有限公司),KQ-50B超声清洗机(昆山市超声仪器有限公司),FJ-200高速分散均质机(上海标本模型厂)。
盐酸度洛西汀原料药(武汉楷伦化学新材料有限公司),盐酸度洛西汀对照品(中国生物制品检定所),盐酸度洛西汀肠溶胶囊(规格为60 mg,美国礼来制药公司,批号 C132961E),空白蔗糖丸芯(上海卡乐康包衣技术有限公司),羟丙基甲基纤维素(HPMC-E5,湖州展望药业有限公司),丙烯酸树脂L30D-55(Eudragit L30D-55,上海赢创-德固赛投资有限公司),聚乙二醇-400(PEG-400,天津博通化石有限公司),柠檬酸三乙酯(TEC,阿法埃莎(天津)化学有限公司),滑石粉(Talc,广西龙胜华美滑石开发有限公司),其他试剂(分析纯,市售)。
2 方法与结果
2.1 释放度的测定
取盐酸度洛西汀肠溶胶囊,按《中华人民共和国药典》2010年版二部附录ⅩD释放度测定法第二法中方法2测定释放度,按《中华人民共和国药典)2010 年版二部附录ⅩC第一法测定溶出度。方法如下:以pH值1.0盐酸溶液900 mL为溶出介质,温度(37±0.5)℃,转速100 r·min-1,2 h后,将转篮升出液面,取6 mL溶液待测,倾出盐酸溶液,立即加入预热至37 ℃的pH值6.8的磷酸盐缓冲液900 mL,继续操作2 h,分别于15、30、45、60、90、120 min取样6 mL,立即补加预热至37 ℃的同体积释放介质溶液,取出的样品过0.45 μm微孔滤膜,在波长230 nm处测紫外吸光度。计算盐酸度洛西汀肠溶胶囊的累积释放度。
2.2 动态光散射测定胶束的粒径
通过NicompTM380ZLS 动态光散射粒度测定仪对制备的研磨液进行粒径测定,具体方法为:取制备的研磨液适量用蒸馏水稀释,使稀释后胶束溶液的光强度(intensity)为300左右,光源为He-Ne 激光(λ0=632.8 nm),介质水的折光率和黏度(n=1.333, η=0.933 mPa·s,室温条件下保持测定至 Time History曲线趋于直线,测定时间为10 min。
2.3 盐酸度洛西汀肠溶微丸制备
2.3.1 湿法研磨法制备含药混悬液
采用羟丙基甲基纤维素为亲水性载体,将HPMC-E5 50 g在不断搅拌下,分散到一定量的纯化水中,将处方量的盐酸度洛西汀原料药与HPMC-E5水溶液按质量比1∶5混合,搅拌均匀,置于纳米研磨机中,以3 000 r·min-1研磨 0.5 h,取出研磨混悬液,静置待泡沫消失进行包衣。
2.3.2 流化床包衣法制备含药微丸
称取空白蔗糖丸芯500 g置于流化床包衣机内,开启设备,设置工艺参数(进风温度:45~50 ℃,出风温度35~40 ℃,风量60~80 m3·h-1;供液泵转速2~6 r·min-1;雾化压力0.1~0.3 MPa),打开蠕动泵,将药物混悬液喷至丸芯表面,喷液过程应根据试验具体情况随时调整工艺参数,喷液结束后,维持温度继续流化30 min,将微丸烘干后取出。
2.3.3 流化床包衣法制备隔离微丸
将HPMC-E5 60 g在不断搅拌下,分散到一定量的纯化水中,加入适量的聚乙二醇-400及滑石粉,继续搅拌1 h,采用与“2.3.2”条相同的流化床工艺参数,将配好的溶液喷至微丸表面,喷液过程应根据试验具体情况随时调整工艺参数。隔离层包衣增重约为含药微丸质量的10%。
2.3.4 流化床包衣法制备肠溶微丸
称取增塑剂柠檬酸三乙酯(聚合物质量的10%)15 g和抗黏剂滑石粉(聚合物质量的40%)60 g,加至150 g的纯化水中,用高速分散均质机匀化10 min,分散均匀后,将上述混悬液缓慢加入到聚合物质量为150 g的Eudragit L30D-55水分散体中,搅拌2 h。设置流化床工艺参数如下:进风温度为35~40 ℃,出风温度为20~30 ℃,风量60~80 m3.h-1,供液泵转速2~8 r·min-1,雾化压力0.1~0.3 MPa。喷液过程应根据试验具体情况随时调整工艺参数,开始宜少量喷液,避免黏结,后阶段可酌情加快喷液速率,使肠溶包衣液充分包裹于微丸表面。喷液结束后,维持温度继续流化30 min,将微丸烘干,取出放入40 ℃烘箱熟化24 h。
2.4 盐酸度洛西汀肠溶微丸处方筛选
2.4.1 湿法研磨时间的筛选
研磨时间直接决定研磨液中原料药的分散状态、药物的粒度分布情况,从而影响包衣过程包衣液的黏度、包衣条件及最终产物体外释放及生物利用度。实验采用羟丙基甲基纤维素(HPMC-E5)作为亲水性载体材料,配制质量分数为4%的HPMC-E5水溶液,将盐酸度洛西汀原料药与HPMC-E5水溶液按质量比1∶5混合,搅拌均匀,置于纳米研磨机中,3 000 r·min-1研磨2 h,分别在0、0.5、1.0和2.0 h取适量研磨液测粒径,考察不同研磨时间对研磨液粒径大小的影响,不同研磨时间研磨液粒径测定结果见表1。
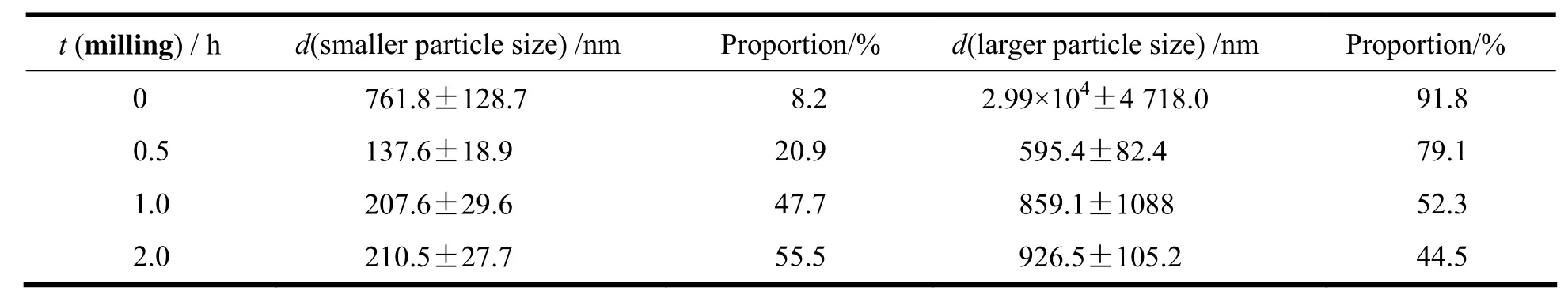
Table 1 Particle size of grinding fluid with different milling time表1 不同研磨时间研磨液粒径测定结果
由表1结果可知,随着研磨时间的增加,粒径逐渐变小,研磨时间为0.5 h时粒径显著减小,粒径由2.99×104nm减小至595.4 nm占粒径分布的79.1%,继续研磨,溶液的黏度不足以阻挡药物分子的聚集,粒径小的颗粒易发生聚集,反而使粒径略微变大,产生“逆研磨”现象[6]。考虑到粒径大小分布及能源损耗,最终确定研磨时间为0.5 h。
2.4.2 研磨液扫描电镜(SEM)图片
分别取适量0 h和2 h纳米研磨液通过冻干制备成冻干粉末,取冻干粉末极少量置于导电胶上,真空条件下喷金,扫描电镜下观察(图2)。
由图2可知:盐酸度洛西汀原料药为圆柱形,0 h研磨液中药物平均粒径约为150 μm,且粒径分布较宽;经过2 h研磨,盐酸度洛西汀平均粒径小于10 μm,且粒径分布较窄。说明盐酸度洛西汀-羟丙基甲基纤维素混悬液经过纳米研磨可使药物粒径显著减小。
2.4.3 研磨频率的筛选
研磨频率是控制研磨效果的主要参数,相同研磨时间,研磨频率决定药物与载体的研磨强度。配制质量分数4%的HPMC-E5水溶液,将盐酸度洛西汀原料药与HPMC-E5水溶液按质量比1∶5混合,搅拌均匀,置于纳米研磨机中,研磨时间0.5 h,考察不同研磨频率的影响。研磨结束后收集各频率研磨液,当研磨频率为2 500 r·min-1时,研磨液黏度较小,造成药物颗粒的聚集,不利于混悬液的稳定,当频率为3 000 r·min-1或3 500 r·min-1时,黏度适宜,混悬液状态稳定,利于充分包裹微丸表面,但以3 500 r·min-1频率研磨时,研磨产热严重,易对研磨液中药物造成影响,故最终选择3 000 r·min-1为研磨频率。
2.4.4 亲水性载体浓度的筛选
选用适宜浓度的HPMC-E5溶液能够有效地提高药物的润湿性和混悬液的稳定性。分别称取适量HPMC-E5加水配制成质量分数2%、4%和6%的载体溶液,量取相应量的载体溶液和盐酸度洛西汀原料药在3 000 r·min-1转速下研磨0.5 h,分别制得不同浓度的药物混悬液。按盐酸度洛西汀肠溶微丸药层包衣工艺制备药丸,并计算上药率。

Fig. 2 SEM photographs of DLX grinding fluid图2 盐酸度洛西汀研磨液扫描电镜照片
结果HPMC-E5溶液质量分数为2%时,上药率为62 .5%,黏度较低,不利于药液与微丸表面的贴合,造成药液损失;质量分数为4%时,上药率为92 .3%,上药率较高;质量分数为6%时,上药率为89 .4%,黏度较大,造成微丸彼此粘连,影响包衣过程,微丸收率低。故选用HPMC-E5质量分数为4%的溶液。
2.4.5 隔离层包衣增质量的筛选
配制质量分数为5%的HPMC-E5水溶液,按隔离衣层增质量分别为5%、10%、20%、30%进行隔离层包衣,烘干后,按肠溶衣包衣操作包 25%肠溶衣增质量,包完后,将微丸置于 40 ℃烘箱加热24 h。观察微丸变色情况并进行释放度测定,结果见表2及图3。

Table 2 Influence of isolation layer weight gain on enteric-coated pellets表2 隔离层增重对肠溶微丸的影响
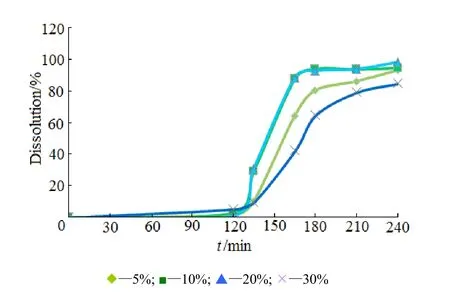
Fig. 3 Influence of isolation layer weight gain on drug release profiles图3 隔离层增质量对药物释放度的影响
由表2可知,当隔离层增质量达到10%以上才具有较好的隔离效果,肠溶微丸在40 ℃熟化24 h后,颜色未发生明显变化,证明肠溶层未对药层造成影响。由图3可知,当隔离层增质量为30%时,影响盐酸度洛西汀肠溶微丸的释放,隔离层增质量为10%和20%时释放基本一致,故最终确定隔离层增质量为10%。
2.4.6 肠溶层包衣增质量筛选
Eudragit L30D-55是甲基丙烯酸和丙烯酸乙酯(质量比1∶1)共聚物的质量分数30%水分散体包衣液。2种材料在胃部酸性条件下不溶解,到小肠中在pH大于5.5时溶解。配制聚合物含量质量分数分别为10%、15%、20%、25%的4种溶液,按盐酸度洛西汀肠溶微丸制备工艺包衣熟化24 h,测定释放度,结果见图4。

Fig. 4 Drug release profiles with different enteric layer levels图4 肠衣层增质量对药物释放度的影响
由图4可知,当肠溶衣层包衣增质量的增加10%和15%时,盐酸度洛西汀肠溶微丸在pH值1.0盐酸溶液中累积释放度大于10%,不符合质量标准要求;当肠溶衣层包衣增质量20%和25%时,微丸在pH值6.8磷酸盐缓冲液中60 min时释放度均大于75%,符合质量标准要求。故最终确定肠溶层包衣增质量为25%。
2.3 自制盐酸度洛西汀肠溶微丸与市售制剂体外释放度比较
依据上述筛选后处方,采用研磨混悬法制备盐酸度洛西汀肠溶微丸,熟化24 h;采用物理混悬法制备药物混悬液未经纳米研磨直接流化床包衣的盐酸度洛西汀肠溶微丸,同样熟化24 h。对2种自制制剂与市售肠溶胶囊按“2.1”条方法测定释放度,其各制剂的释放度曲线见图5。

Fig. 5 Release curves of duloxetine hydrochloride enteric-coated pellets and commercially available preparations图5 盐酸度洛西汀肠溶微丸自制与市售制剂释放度曲线
从实验结果可知,采用物理混悬方法制备盐酸度洛西汀肠溶微丸释放度明显低于研磨混悬法制备的盐酸度洛西汀肠溶微丸释放度,证明研磨混悬技术可有效降低药物粒径,增大药物释放速率,从而增加药物释放度。研磨混悬法自制的制剂与市售制剂释放度曲线基本一致,在pH值1.0盐酸溶液中120 min时释放度为2.75%(符合标准小于10%的要求),在pH值6.8磷酸盐缓冲液中60 min时释放度为93.99%(符合标准大于75%的要求)。研磨混悬法自制的制剂释放度曲线与市售制剂释放度曲线基本一致,且符合质量标准要求。
2.4 扫描电镜观察
采用高分辨场发射扫描电镜对微丸外观及横切面进行扫描,结果见图6。
由图6可见:微丸圆整度良好,表面光滑;由横切面观察,微丸内部结构致密。该肠溶微丸分为4层,内部空白蔗糖丸芯,由内向外为3层分别为药层、隔离层、肠溶层,层与层之间界限明确,各层均包裹完整。
3 结论
本研究通过纳米研磨机湿法研磨技术制备盐酸度洛西汀-羟丙甲纤维素纳米混悬液,制备不同研磨时间的混悬液。药物经过湿法研磨体后,粒径由29.9 μm显著降低到595.4 nm,有效地增加了药物表面积,提高润湿性。扫描电镜图片表明药物通过纳米研磨粒径显著减小,且粒径分布变窄。依据其粒径大小,对研磨时间进行筛选,最后确定研磨物质量比1∶5,研磨频率3 000 r·min-1,研磨时间为0.5 h。采用底喷流化床包衣法制备盐酸度洛西汀肠溶微丸,纳米混悬液以羟丙甲纤维素作为亲水性载体,HPMC-E5溶液的质量分数为4%时,空白蔗糖丸芯上药率最高。选用HPMC-E5作为隔离衣材料,隔离衣膜增质量 10%,可有效确保药物与肠衣层隔离,保证药物稳定。以 Eudragit L30D-55为肠溶层材料,肠溶层增质量25%,所得盐酸度洛西汀肠溶微丸在pH值1.0盐酸溶液120 min和pH值6.8磷酸盐缓冲液60 min时,释放度均符合要求。以该处方工艺制备的盐酸度洛西汀肠溶微丸体外释放度符合标准,并且与市售制剂的释放度曲线基本一致,通过扫描电镜观察微丸圆整度良好,表面光滑,微丸内部结构致密。本处方工艺简单易行,有望应用于工业化生产。

Fig. 6 SEM photograph of DLX enteric-coated pellets图6 盐酸度洛西汀肠溶微丸扫描电镜照片
[1] 邵仲英, 徐巧玲, 史爱欣. 新型5-羟色胺和去甲肾上腺素再摄取抑制剂-度洛西汀[J]. 中国全科医学, 2006, 9(10): 823-825.
[2] 王来海, 张瑞岭, 马金芳, 等. 国产与进口度洛西汀治疗抑郁症的临床疗效与安全性比较[J]. 中国新药杂志, 2012,21(14): 1647-1650.
[3] 白志华, 方晓玲. 难溶性药物口服制剂研究进展[J]. 中国药学杂志, 2005, 40(15): 1124-1127.
[4] 张璐璐, 郑洪波. 盐酸度洛西汀介绍[J]. 临床精神医学杂志, 2007, 17(4): 284-285.
[5] JANSEN P J , KEMP C A, MAPLE S R, et al. Characterization of impurities formed by interaction of duloxetine HCl with enteric polymers hydroxypropyl methylcellulose acetate succinate and hydroxypropyl methylcellulose phthalate[J]. J Pharm Sci, 1998, 87( 1): 81-85.
[6] 王云, 陈宁. 粉体粒度与研磨技术[J]. 中国粉体技术, 2000, 6(4): 13-16.
Duloxetine hydrochloride enteric-coated pellets preparation using wet milling combined fluidized bed coating technology
LU Wei,TANG Xing*
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveUsing wet milling technology and fluidized bed coating methods, duloxetine hydrochloride enteric-coated pellets were prepared and the formulation was optimized with respect of in vitro release.MethodsThe insoluble duloxetine and hydrophilic HPMC-E5 were pretreated by wet milling technology, and drug suspension was coated onto the pellet cores for drug loading process. HPMC-E5 solution and Eudragit L30D-55 aqueous dispersion were used as isolation layer material and enteric layer material by bottom spray fluid bed coating method, respectively. The in vitro release of duloxetine pellets was determined for optimization of formulation and process.ResultsParticle size of drug was reduced from 29.9 μm to 595.4 nm by wet milling. Similar in vitro release curves were obtained for homemade and reference preparations. The accumulative release was less than 10% at 120 min in pH1.0 hydrochloric acid solution, and higher than 75% at 60 min in pH6.8 phosphate buffer, which meets the quality requirement. Scanning electron microscopy showed that pellets was round in shape with smooth surface.ConclusionWet milling technology can significantly reduce particle size of drugs, enhance the efficiency of coating and drug release in vitro. The in vitro release of duloxetine enteric-coated pellets could meet the requirement. With this high stability and simple preparation process, it is expected to be applied to industrial production.
pharmaceutics; enteric-coated pellets; wet milling method; duloxetine hydrochloride; in vitro release
(本篇责任编辑:赵桂芝)
(2015)04-0134-09
10.14146/j.cnki.cjp.2015.04.004
2015-03-11
芦威(1984-), 女(汉族), 辽宁沈阳人, 硕士研究生, E-mail lw0219@126.com; *
:唐星(1964-),男(汉族), 陕西商县人, 教授, 博士, 主要从事口服微粒缓控释制剂和中药现代化研究, Tel. 024-23986343, E-mail tanglab@126.com。

