脑梗死患者认知功能障碍的TGFβ/Smad信号转导通路参与机制
李 娟
(陕西省商洛市中心医院 神经内科, 陕西 商洛, 726000)
脑梗死患者认知功能障碍的TGFβ/Smad信号转导通路参与机制
李娟
(陕西省商洛市中心医院 神经内科, 陕西 商洛, 726000)
摘要:目的探讨TGFβ/Smad信号转导通路在临床脑梗死病患认知功能障碍中的参与作用。方法120例患者中首发脑梗死患者68例,再发脑梗死患者52例。脑梗死患者认知功能检查依据简易精神状况检测量表进行, TGFβ/Smad信号转导通路中组成分子TGFβ、Smad1、Smad3和Smad7的水平采用酶联免疫吸附测定法进行分析。以本院同期的健康体检者作为对照组。结果脑梗死患者的MMSE评分比对照组低(P<0.05),且再发脑梗死患者的评分比首发脑梗死患者的评分低(P<0.05); 脑梗死认知功能障碍组患者的TGFβ、Smad1、Smad3和Smad7水平比对照组升高(P<0.05)。结论脑梗死患者患者存在明显的认知功能障碍,且其认知功能障碍的发生可能与患者血清中TGFβ、Smad1、Smad3和Smad7蛋白浓度的升高有关。
关键词:脑梗死; TGFβ/Smad信号转导通路; 认知功能障碍; 再发脑梗死
脑梗死即缺血性脑卒中,是患者局部脑组织发生缺血功能障碍导致脑组织内神经功能异常或损伤的病理过程[1-2]。随着生产方式的转变及诊断技术的进步,临床上脑梗死患者的发生率和死亡率逐年上升[3]。脑梗死在临床上主要表现为颈动脉闭塞综合征、大脑前动脉、中动脉或后动脉综合征以及椎基底动脉闭塞综合征[4]。同时,脑梗死患者经常出现头痛、头晕以及躯体发生偏瘫等临床症候群。但是,认知功能障碍是脑梗死患者最为常见的表现,且其致残率高、预后差。TGFβ/Smad信号转导通路参与了阿尔茨海默综合征、脑积水、神经胶质瘤发生及发展和大鼠缺血再灌注脑组织损伤的病理过程[5-8]。认知功能障碍是患者学习记忆能力和思维判断能力功能出现异常的过程,但是关于认知功能障碍及脑梗死患者认知功能障碍的发病原因尚未明确[9-10]。本研究主要对本院2011年2月—2014年2月诊治的脑梗死认知功能异常发生患者进行研究,探讨TGFβ/Smad信号转导通路在临床脑梗死病患认知功能障碍中的参与作用,为脑梗死认知功能改善药物开发提供参考。
1资料与方法
1.1 一般资料
本研究对本院2011年2月—2014年2月诊治的脑梗死患者进行研究。120例患者中包括首发脑梗死患者68例和再发脑梗死患者52例。本研究以本院同期的健康体检者为正常对照组。正常对照组、首发脑梗死组和再发脑梗死组患者在一般资料方面差异性无统计学意义(P>0.05)。
1.2 脑梗死患者及正常对照组认知功能评分分析
本研究对脑梗死患者及正常对照组认知功能评分分析依据简易精神状况检测量表(MMSE)进行统计。本研究对首发脑梗死组患者、再发脑梗死组患者以及正常对照组患者的认知功能评分,比较3组研究对象的记忆力评分及注意力评分和计算力评分。
1.3 酶联免疫吸附测定法检测各组血清中TGFβ、Smad1、Smad3和Smad7的水平
所有研究对象于清晨空腹抽取外周静脉血后3 000 r/min离心15 min, 分离上层血清进行ELISA法检测。TGFβ检测试剂盒购自武汉博士德生物工程有限公司; Smad1蛋白ELISA检测试剂盒购自Elabscience公司;Smad3和Smad7检测试剂盒购自北京天根生化科技有限公司。所有操作过程及结果分析均按照试剂盒的自带说明书进行。
1.4 统计学处理
应用SPSS 20.0统计软件对数据进行统计学分析,计量资料用平均数±标准差表示,组间比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2结果
2.1 首发和再发脑梗死患者认知功能的MMSE评分结果
本研究认为脑梗死患者的记忆能力评分、注意力评分及计算能力评分均明显低于对照组 (P<0.01); 同时,再发脑梗死患者的记忆能力评分、注意力评分及计算能力评分均明显低于首发脑梗死患者,差异有统计学意义(P<0.05),见图1。
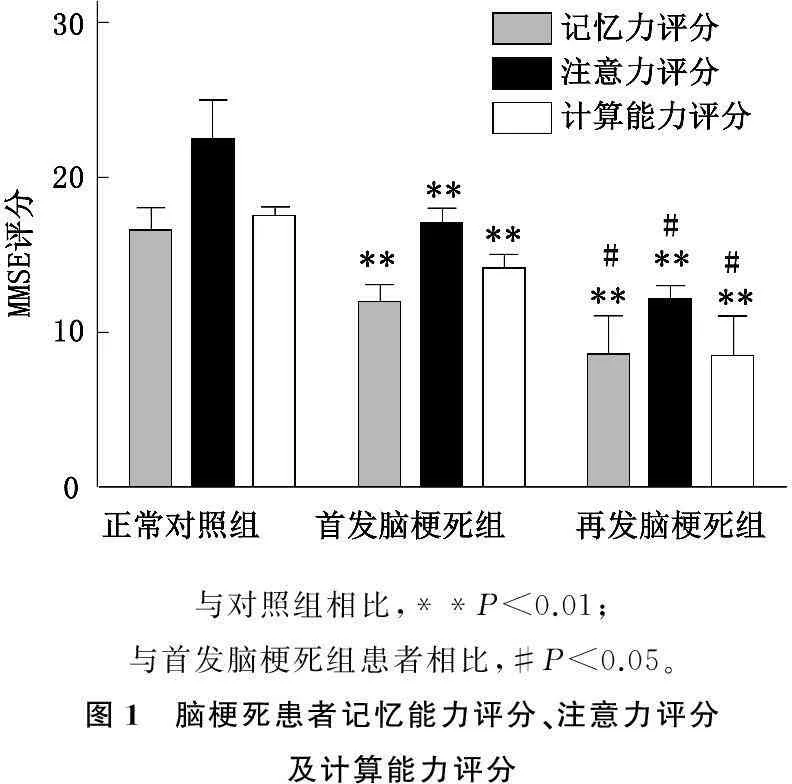
与对照组相比,**P<0.01;与首发脑梗死组患者相比,#P<0.05。图1 脑梗死患者记忆能力评分、注意力评分及计算能力评分
2.2 首发和再发脑梗死患者血清TGFβ及IL-1和IL-10水平的变化
本研究发现与正常对照组相比,首发脑梗死和再发脑梗死组患者TGFβ及IL-1和IL-10明显上升(P<0.01);同时,脑梗死患者中首发脑梗死组与再发脑梗死组患者上述分子的水平也有明显差异(P<0.05),见图2。
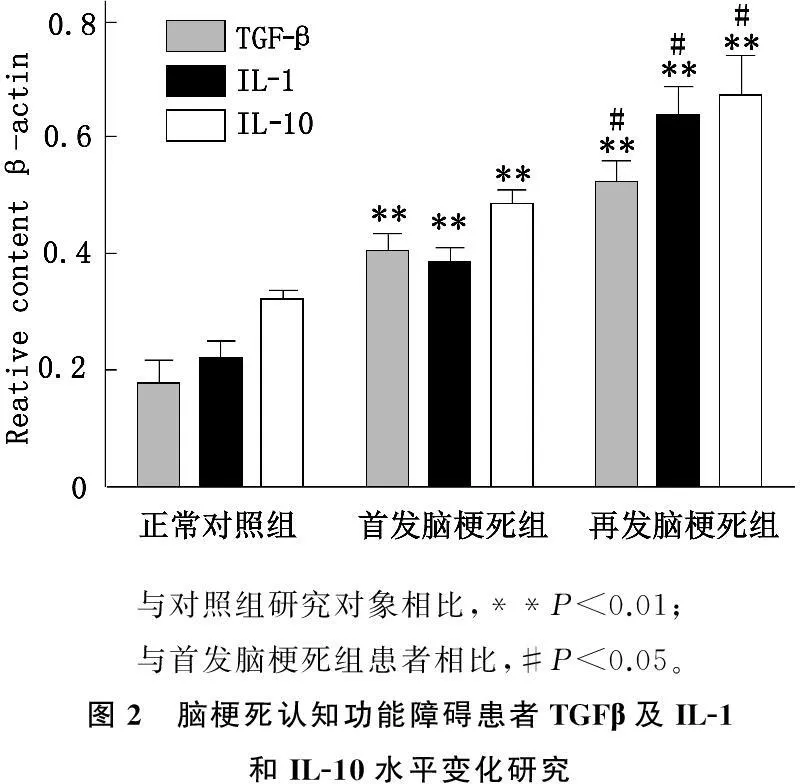
与对照组研究对象相比,**P<0.01;与首发脑梗死组患者相比,#P<0.05。图2 脑梗死认知功能障碍患者TGFβ及IL-1和IL-10水平变化研究
2.3 脑梗死认知功能障碍患者Smad1、Smad3和Smad7的表达研究
本研究发现与正常对照组相比,首发脑梗死和再发脑梗死组患者Smad1、Smad3和Smad7水平明显上升(P<0.01); 同时,脑梗死患者中首发脑梗死组与再发脑梗死组患者上述分子的水平也有明显差异(P<0.05), 见图3。
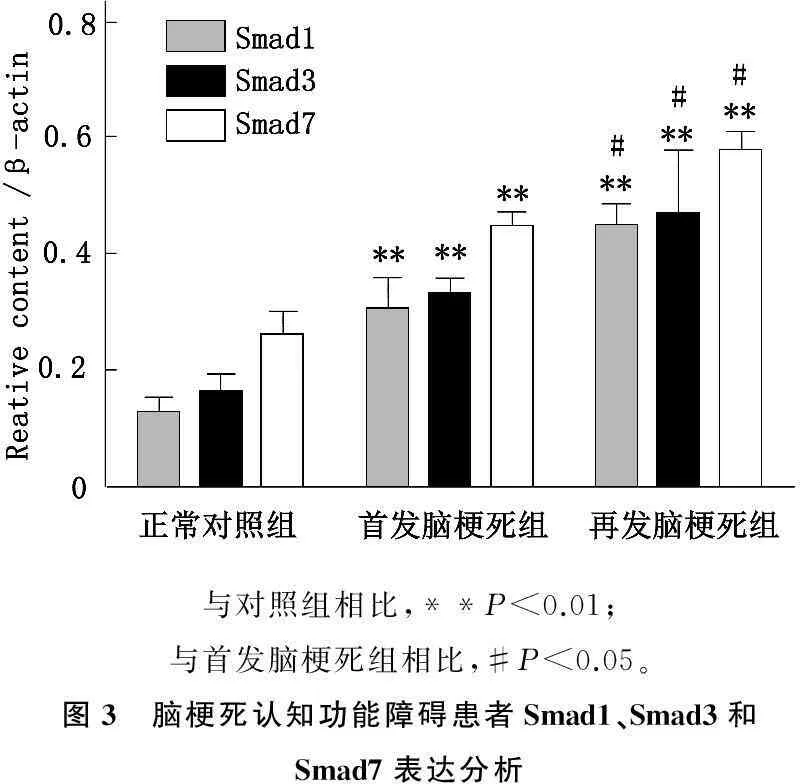
与对照组相比,**P<0.01;与首发脑梗死组相比,#P<0.05。图3 脑梗死认知功能障碍患者Smad1、Smad3和Smad7表达分析
3讨论
脑梗死认知功能障碍是脑梗死临床上最常见和最主要的并发症之一。认知功能障碍是多种原因引起的精神活动的异常,其治疗主要采用神经保护治疗、改善神经递质正常水平治疗以及手术治疗等。但是目前关于脑梗死患者认知功能障碍的确切发病原因尚存在争议。本研究在探讨TGFβ/Smad信号转导通路在临床脑梗死病患认知功能障碍中的参与作用时发现脑梗死患者的MMSE评分水平比正常对照组患者评分低,且再发脑梗死患者的评分比首发脑梗死患者的评分低;同时脑梗死认知功能障碍组患者的TGFβ、Smad1、Smad3和Smad7水平比对照组研究对象的水平升高。因此,脑梗死患者患者存在明显的认知功能障碍,且其认知功能障碍的发病可能与患者血清中TGFβ、Smad1、Smad3和Smad7蛋白浓度的升高有关。
TGFβ蛋白超家族及其对应的受体蛋白以及核内转录因子共同参与了细胞的增殖分化以及脑神经系统的病理过程。在分析老年急性脑梗死患者治疗前后血清半胱氨酸和转化生长因子β检测临床意义的研究中发现老年脑梗死患者血清中TGFβ1水平明显升高,且TGFβ1可以作为病情严重程度及预后的重要指标[11]。在研究血清TGFβ1和VEGF与脑梗死患者颈动脉粥样斑块易损性相关性的研究中也发现TGFβ1水平增高与脑梗死患者发生颈动脉粥样硬化斑块具有密切的相关性,且TGFβ1能够促进斑块稳定的作用[12]。另外,在分析Lp-PLA2及TGFβ1与脑梗死复发的相关性的研究中也表明TGFβ1与脑梗死患者复发具有临床的相关性[13]。TGFβ1也可以作为药物作用的靶点发挥治疗作用。在探讨补阳还五汤作用于脑梗死大鼠血管新生实验中表明药物主要通过调节TGFβ1蛋白的水平发挥治疗作用[14]。本研究也发现与正常对照组相比,首发脑梗死和再发脑梗死组患者TGFβ明显上升,且脑梗死患者中首发脑梗死组与再发脑梗死组患者上述分子的水平也有明显差异,表明TGFβ参与了脑梗死的发病过程,且是脑梗死复发诊断的重要参考分子。Smads蛋白也参与了脑组织损伤的多种病理学的发病过程[15]。在分析实验性交通性脑积水后皮层神经元形态的变化及TGFβ/Smad信号通路对实验性交通性脑积水后神经元形态影响的研究[16]中发现Smad蛋白表达的异常参与了脑积水神级元损伤过程。同时,在分析SD大鼠脑缺血再灌注损伤过程的研究中也发现丹红注射液主要通过干预Smad3及Smad7蛋白的表达发挥作用[17]。本研究也发现与正常对照组相比,首发脑梗死和再发脑梗死组患者Smad1、Smad3和Smad7水平明显上升,且脑梗死患者中首发脑梗死组与再发脑梗死组患者上述分子的水平也有明显差异,表明Smad蛋白也与脑梗死发病及再发过程密切相关。
因此,脑梗死患者患者存在明显的认知功能障碍,且其认知功能障碍的发病可能与患者血清中TGFβ、Smad1、Smad3和Smad7蛋白浓度的升高有关。
参考文献
[1]李治锋, 王静, 夏寿杨. 脑梗死患者血清同型半胱氨酸与平均血小板体积的相关性分析[J]. 实用检验医师杂志, 2013, 7(4): 239.
[2]姜文洲, 王雪梅, 陈艳华, 等. 脑梗死与糖代谢异常相关性研究[J]. 中国医刊, 2013, 8(7): 54.
[3]李琼, 郭立军, 杨期明. 大面积脑梗死预后影响因素的分析[J]. 湘南学院学报: 医学版, 2013, 4(2): 19.
[4]高芳. 依达拉奉联合丹参多酚酸盐治疗急性脑梗死的疗效[J]. 中国老年学杂志, 2013, 18(23): 5991.
[5]刘宝华, 邵胜敏, 白光辉, 等. Dab2调控阿尔茨海默病小鼠模型海马内TGF-β1/SMADs信号传导并减轻其脑损伤[J]. 中风与神经疾病杂志, 2014, 8(6): 514.
[6]王岩, 张晾, 潘杰. 转化生长因子β1在脑积水发生中的作用[J]. 现代生物医学进展, 2009, 24(19): 3774.
[7]苏伟, 刘福生, 朱贵东, 等. 人脑胶质瘤中转化生长因子β2、Smad3蛋白表达及临床意义[J]. 中国康复理论与实践, 2011, 9(5): 433.
[8]周琳. SD大鼠脑缺血再灌注和丹红注射液干预后BMP-7和TGF-β1表达变化的研究[D].中南大学, 2013.
[9]常虹. 老年患者脑卒中后认知功能障碍相关因素分析[J]. 河北医学, 2012, 7(1): 91.
[10]孙景贤, 曾慧. 轻度认知功能障碍的干预研究进展[J]. 中国全科医学, 2012, 23(15): 1681.
[11]张艳艳, 马宁. 老年急性脑梗死患者治疗前后血清Hcy和TGF-β1检测的临床意义[J]. 放射免疫学杂志, 2010, 8(4): 377.
[12]林静, 易兴阳, 池丽芬, 等. 血清TGF-β1和VEGF与脑梗死患者颈动脉粥样斑块易损性的相关性[J]. 中国神经免疫学和神经病学杂志, 2010, 7(4): 269.
[13]梁江红, 魏麓云. Lp-PLA2、TGF-β1与脑梗死复发的相关性[J]. 中南医学科学杂志, 2012, 11(2): 175.
[14]刘宏祥, 赵永辰, 王涛, 等. 补阳还五汤作用于脑梗死大鼠血管新生的实验研究[J]. 现代中西医结合杂志, 2013, 27(30): 3329.
[15]莽靖. ActA/Smads通路在脑缺血损伤中作用及信号转导机制研究[D].吉林大学, 2010.
[16]陈鑫. 实验性交通性脑积水后皮层神经元形态的变化及TGF-β1/Smad2/3信号传导通路对实验性交通性脑积水后神经元形态的影响[D]. 第二军医大学, 2010.
[17]谢春. SD大鼠脑缺血再灌注后Smad3和Smad7表达的变化及丹红注射液干预的影响[D]. 中南大学, 2012.
Participation mechanism of TGFβ/Smad signaling pathway in the pathogenesis of cognitive dysfunction in cerebral infarction patients
LI Juan
(DepartmentofNeurology,ShangluoCentralHospital,Shangluo,Shaanxi, 726000)
ABSTRACT:ObjectiveTo investigate the participation mechanism of TGFβ/Smad signaling pathway in the cognitive dysfunction in patients with cerebral infarction. MethodsAmong 120 patients with cerebral infarction, primary cerebral infarction was observed in 68 patients and recurrent cerebral infarction was observed in 52 patients. The cognitive function was evaluated by MMSE. The expressions of TGFβ, Smad1/3/7 were evaluated by ELISA. The normal people with health examination were designed as control group. ResultsThe MMSE score in cerebral infarction patients was significantly lower than the control group (P<0.05), and the MMSE score in the recurrent cerebral infarction patients was significantly lower than the primary cerebral infarction patients (P<0.05). Serum TGFβ and Smad1, Smad 3, Smad 7 in the cerebral infraction patients with cognitive dysfunction were significantly higher than those in the control group (P<0.05). ConclusionTGFβ, Smad1/3/7 are involved in the pathogenesis of patients with cerebral infarction, and the onset of cognitive dysfunction may be correlated with increasing of serum TGFβ、Smad1、Smad3和Smad7 levels.
KEYWORDS:cerebral infarction; TGFβ/Smad signaling transduction pathway; cognitive dysfunction; recurrent cerebral infarction
收稿日期:2015-03-15
中图分类号:R 743.33
文献标志码:A
文章编号:1672-2353(2015)17-021-03
DOI:10.7619/jcmp.201517007

