滇东喀斯特石漠化地区不同植被模式土壤酶活性与有机碳1)
曹向文 赵洋毅 熊好琴 段旭 舒树淼
(西南林业大学,昆明,650224)
责任编辑:王广建。
从19 世纪80年代末开始,土壤酶活性作为土壤质量的生物活性指标,成为土壤酶学的研究重点[1]。由于土壤理化性质对外界胁迫的响应较慢,很多学者都认为土壤的活性组分(如酶活性)更能表征土壤质量[2-3]。在土壤这个生态系统中,一切生化反应都是在酶的作用下进行的,土壤酶可通过控制土壤养分循环速率,指示土壤多功能的有效性,而且它与有机质分解和土壤质量密切相关[4-5],可以反映土壤生物活性的大小[6]。因此,土壤酶活性是一个不可忽视的重要指标。土壤有机碳包括动植物、微生物的残体及其排泄物、分泌物等,以及土壤腐殖质。土壤有机碳储量并不是稳定的,它是进入土壤的植物残体量和在土壤微生物作用下分解损失量间平衡的结果[7]。土壤有机碳是土壤的重要组成部分,是表征土壤质量变化的敏感指标[8],它能够直接影响土壤物理、化学和生物学特征,可以用来反映土壤的环境[9],并对维持生物的生长发育有调控作用。有研究表明,土壤有机碳质量分数会受到气候、土地利用方式、植被类型等的影响,并且对土壤结构的形成及稳定性有重要的意义[10-11]。
喀斯特环境是一种脆弱的生态环境,石漠化是喀斯特地区土壤荒漠化的表现形式之一,可导致土壤质量下降。目前,对于石漠化过程的研究大多集中在土壤理化性质的变异方面[12-14],而对喀斯特山区中土壤酶活性的研究[15-16]相对较少。喀斯特地区的母质是碳酸盐岩,该岩石是全球最大的碳库。喀斯特石漠化过程中,土壤有机碳的变化对于全球碳循环有非常重要的作用[17]。因此,以土壤酶活性作为土壤质量的生物指标,以有机碳质量分数作为土壤质量的环境指标,通过冗余分析(RDA)研究土壤酶活性与有机碳的关系,以期进一步认识土壤中植物群落近期可利用养分的质量分数,同时评价土壤的质量和活力,在喀斯特环境下,为脆弱生态系统的恢复提供理论依据。
1 研究区概况
研究区位于云南省东部曲靖市,海拔1 150~2 750 m,具有山地季风半湿润气候特征,年平均气温13.5℃,年均降水量1 300 mm,年平均蒸发量831.3 mm,年平均日照时间1 820 h。土壤类型主要为红、黄壤土为主,植被属于北亚热带中山常绿针阔混交林带。本研究区为云南省典型的喀斯特地貌分布区,石漠化土地较多,水土流失严重,石漠化面积占全区的17.23%,占全区喀斯特地貌面积的27.45%。其中,轻度石漠化占全区面积的10.04%、中度占16.51%、强度占1.84%、极强度占0.94%。试验区选取滇东高原典型石漠化地段,区域内主要以中轻度石漠化为主,以4 种植被恢复方式进行治理,分别为针阔混交林(云南松Pinus yunnanensis×华山松Pinus armandii Franch×麻栎Quercus acutissima Carruth)、针叶林(华山松)、阔叶林(麻栎)及灌草植被模式。灌草植被包括椴叶山麻杆(Alchornea tiliifolia (Benth.)Muell.Arg.)、盐肤木(Rhus chinensis Mill)、白茅(Ⅰmperata cylindrica (Linn.)Beauv.)、飞机草(Eupatorium odoratum L.)等。各植被治理模式基本概况见表1。

表1 不同植被模式样地基本情况
2 研究方法
2.1 样地的设置及样品采集
目前喀斯特地貌区森林生态系统在退化演替序列中有乔木林地、灌木林地、灌丛或灌草坡等不同阶段。基于研究地实际情况,选取样地的植被模式有:针阔混交林模式、针叶林模式、阔叶林模式、灌草模式(见表1)。于2014年5月,在海拔、坡度相近的典型地段选取4 种植被模式,并以裸地为对照。在各样地内设置3 个20 m×20 m 的标准地,在每个标准地内设置3 个典型地段作为采样点,每个采样点去除表层枯枝落叶,挖掘土壤剖面,分别在0~20、>20~40、>40~60 cm 土层采集3 个环刀和3 个铝盒,并将3 个样点相同土层土样等比例混匀,除去石块和残根,用四分法取土500 g 左右分层装袋密封,带回实验室,一部分鲜土放在冰箱内4 ℃保存,用于分析土壤酶活性,其余部分经过阴干、研磨,分别过1.00、0.25 mm 筛,装袋待测。每个样品设置3个重复。
作为全球科技界的领军企业,为专业用户提供领先同行业的工业产品,包括无损检测仪器、合金分析仪器、内窥检测设备和工业显微镜等。我们的目标是向全世界范围的用户提供经济可靠的检测和维护系统,来提高安全性、高效性,从而为社会发展贡献力量。
2.2 土壤酶活性及土壤理化性质的测定
土壤密度测量采用环刀法;有机碳采用KCr2O7-H2SO4氧化法;全氮采用自动定氮仪;速效氮采用凯氏扩散皿法;全磷用硫酸-高氯酸消煮法;有效磷用比色法;全钾及速效钾用火焰光度法[18]。脲酶活性测定采用苯酚次氯比色法;蔗糖酶活性采用3,5-二硝基水杨酸比色法;过氧化氢酶活性采用高锰酸钾滴定法;多酚氧化酶活性采用碘量滴定法;蛋白酶活性采用加勒斯江法;淀粉酶活性采用3,5-二硝基水杨酸比色法[19-20]。
2.3 数据统计与计算方法
在选定了0.2mL高氯酸用量的基础上,通过加入不同量的氟化氢铵对页岩标准物质GBW07107进行消解试验,以考察氟化氢铵用量对目标元素测定结果的影响。由图2可见,各稀土元素测定结果与认定值的相对误差(RE)随氟化氢铵用量的增加而降低,当氟化氢铵用量达125mg时,相对误差在±10%以内。
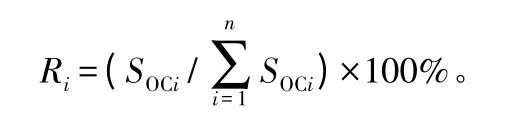
式中:i 表示土层编号,SOCi表示第i 层土壤有机碳密度,n 表示土壤层数,Ri表示第i 层土壤单位面积有机碳占总土层有机碳的百分比。
采用加权和法计算土壤综合酶指数[22-23]。
3 结果与分析
3.1 不同植被模式下土壤有机碳质量分数
由表2可知,不同植被模式下不同土层中有机碳质量分数存在显著差异。研究区内4 种不同植被模式下0~60 cm 土层土壤平均有机碳质量分数为9.86~21.80 g/kg,整体水平上,土壤有机碳质量分数较高。其中:以灌草模式下土壤平均有机碳质量分数最高(21.80 g/kg);针叶林模式下土壤平均有机碳质量分数最低(9.86 g/kg),比灌草模式低近55%。这主要与不同植被模式下枯枝落叶物现存量、有机碳分解速率不同有关。裸地的土壤平均有机碳质量分数(6.83 g/kg)均低于其他林地模式。
感染病原菌在传染病医院分布和耐药情况与综合性医院不同。各医院或各病区应根据其感染菌的分布特点,采取有针对性的防感染措施,减少细菌感染;并根据其感染菌的耐药情况,合理选用抗菌药物,达到治疗目的并减少耐药性细菌的产生。
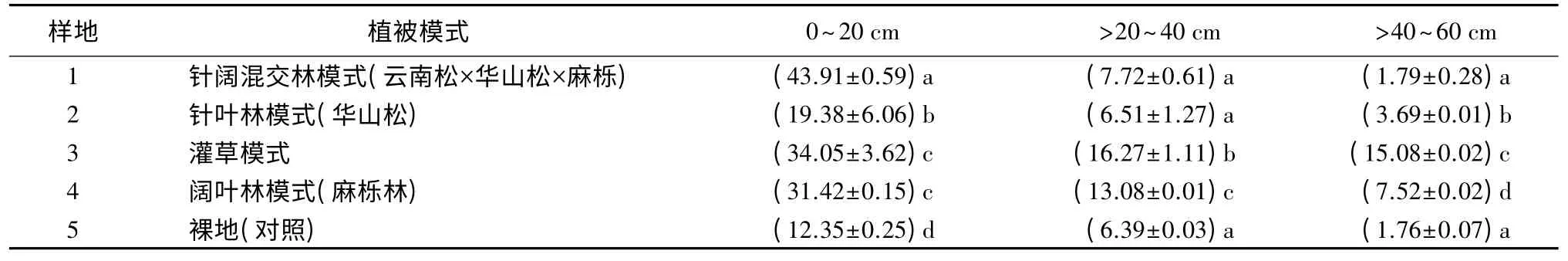
表2 不同植被模式下土壤有机碳质量分数 g·kg-1
受不同植被类型的影响,土壤有机碳质量分数在土壤剖面的分布也出现差异(见表3)。各植被模式下不同土壤层中有机碳质量分数均表现为表层土(0~20 cm)最大,其占整个土壤有机碳的比例为44.8%~76.10%,并且随着土层厚度的增加土壤有机碳质量分数均呈下降趋势。其主要原因是植被类型不同,土壤中根系的分布也有很大差异。此外,随着土层厚度的增加分解者的活动强度减弱,导致有机碳质量分数减少。
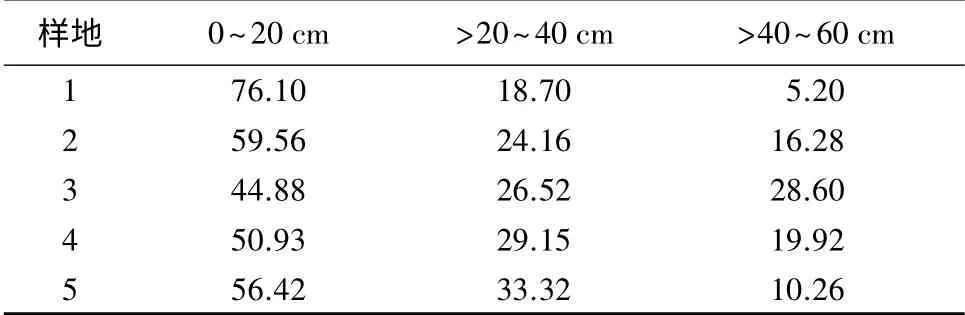
表3 不同植被模式下土壤有机碳储量剖面分布 %
由表3可知,0~20 cm 土层单位面积有机碳质量分数所占百分比由大到小的顺序为:针阔混交林模式(76.10%)、针叶林模式(59.56%)、裸地(56.42%)、阔 叶 林 模 式(50.93%)、灌 草 模 式(44.88%)。>20~40 cm 土层单位面积有机碳质量分数所占百分比中,裸地的为33.32%,针阔混交林模式下为18.70%,针叶林模式、灌草模式和阔叶林模式下相差不大,在24.16%~29.15%。>40~60 cm土层单位面积有机碳质量分数所占百分比由大到小的顺序为:灌草模式(28.60%)、阔叶林模式(19.92%)、针叶林模式(16.28%)、裸地(10.26%)、针阔混交林模式(5.20%)。对于研究结果中裸地相对阔叶林模式、灌草模式下0~20 cm 土层单位面积有机碳质量分数所占百分比较高,其原因是研究区的裸地是由林地退化而来,而且退化时间不长,土壤表层中仍含有较多原来积累的有机碳。而对于>20~40、>40~60 cm 土层中单位面积有机碳质量分数所占百分比,裸地大于针阔混交林模式,主要原因是针阔混交林模式下各树种之间具有相互作用,使得林内凋落物量增加,同时针叶林的存在又使得林内具有较高的温度,加快了凋落物的分解速率,土壤中养分得到及时补充,利于有机碳储存,从而导致表层土壤的有机碳质量分数所占百分比极高,>20~60 cm土层中其所占比例下降。
采用Excel 2010 和SPSS 17.0 统计软件对数据进行基本统计、相关性分析及显著性检验。应用Canoco for Windows 4.5 软件对土壤酶活性和有机质质量分数之间关系进行冗余分析(RDA)。利用土壤有机碳密度(SOC)[21]计算单位面积有机碳占总土壤有机碳的百分比,公式如下:
脲酶活性可以表示土壤中氮素供应情况。灌草模式、阔叶林模式、针阔混交林模式下脲酶活性显著高于针叶林模式和裸地,因此,灌草模式下土壤中有机氮的转化过程快于针叶林模式。有研究表明植被对多酚氧化酶活性有较大的影响[25]。从本研究多酚氧化酶活性来看,在0.92~1.09 ml/g,差异较小。阔叶林模式下多酚氧化酶活性相对较高些,针叶林模式下较低。蛋白酶活性以针阔混交林模式下最高(0.65 mg/g),其次为灌草模式(0.56 mg/g),针叶林模式和阔叶林模式下,蛋白酶活性分别为0.40和0.32 mg/g。土壤中淀粉酶活性的由大到小的顺序为:针阔混交林模式(0.22 mg/g)、阔叶林模式(0.21 mg/g)、灌草模式(0.19 mg/g)、针叶林模式(0.17 mg/g)、裸地(0.13 mg/g)。
3.2 不同植被模式下不同土层土壤酶活性
采用盐酸(1+1)溶解铝土矿试样,分别用氨水和碳酸铵沉淀法消除铝、铁和钙的干扰,过滤,在酸性溶液中,加入铬酸钡悬浊液与硫酸根生成硫酸钡沉淀和铬酸根离子(式1),用氨水调节pH值至9~10,过滤除去多余的铬酸钡和生成的硫酸钡,滤液即为被硫酸根所置换出的铬酸根溶液,通过铬酸根的吸光度值间接计算出硫酸根的含量。
不同植被模式下土壤酶活性存在显著差异(见表4)。随着土层的加深,土壤酶活性整体表现出依次减弱的趋势。针阔混交林模式和灌草模式下的土壤酶活性较高,裸地和针叶林模式下酶活性相对较低。过氧化氢酶能将土壤中的有机质氧化,因此,可以反映土壤腐殖质化强度[24]。灌草模式下的过氧化氢酶活性最高(4.49 mL/g),针叶林模式和裸地土壤中过氧化氢酶活性平均水平分别为4.16 和4.03 mL/g,显著低于灌草模式。
蔗糖酶直接参与土壤有机质的代谢过程,其活性影响着土壤中有机质的分解转化。不同植被模式下,蔗糖酶活性由大到小的顺序为:针阔混交林模式(5.02 mg/g)、灌草模式(4.78 mg/g)、针叶林模式(4.09 mg/g)、阔叶林模式(3.89 mg/g)、裸地(3.67 mg/g)。
通过改进的YOLO单一人脸检测模型检测出人脸区域后,再利用DLIB库中的人脸68个关键点检测模型在人脸区域内进行遮挡判定。当获得一张图片后,算法会生成一个初始形状就是首先估计一个大致的特征点位置,然后采用gradient boosting算法 [19]减小初始形状和真实形状的平方误差总和。用最小二乘法来求最小化误差,得到每一级的级联回归因子。基于回归的方法直接进行特征提取并学习回归方程,通过设计对姿势变化不敏感的特征可以有效的增强算法对姿势变化的鲁棒性。
通过计算土壤综合酶指数来表示不同植被模式下多种酶因子的综合作用,从而全面地反映土壤酶活性特征。结果显示,各植被模式下酶指数由大到小的排列顺序为:灌草模式(0.499)、针阔混交林模式(0.498)、阔叶林模式(0.392)、针叶林模式(0.352)、裸地(0.315)。即综合各种酶活性后显示灌草模式和针阔混交林模式下酶活性相对较高。

表4 土壤酶活性垂直变化
3.3 土壤酶活性与有机碳之间的相互耦合关系
土壤酶活性的去趋势对应分析显示,第一排序轴的长度小于3,因此,该研究适用线性模型下的冗余分析。Monte Carlo 置换检验排序轴结果显示已达到显著水平(P<0.05),表明排序效果良好。

表5 土壤酶活性与土壤有机碳相关关系
3.4 土壤有机碳与土壤酶活性冗余分析
由表5可知,4 种不同植被模式下,土壤有机碳与多种土壤酶活性具有显著相关性。土壤中过氧化氢酶、蔗糖酶、脲酶、多酚氧化酶活性与有机碳均呈极显著正相关,蛋白酶活性与有机碳质量分数呈不相关性。淀粉酶是参与自然界碳素循环的一种重要的酶,淀粉酶与土壤有机碳质量分数存在显著的正相关关系,相关系数为0.461。除蛋白酶外,土壤有机碳与其他5 种酶活性均有显著正相关关系,说明土壤有机碳质量分数大小与土壤中多种酶活性关系密切。
图1中箭头所处的象限代表不同因子与排序轴间的正负相关性,箭头连线在排序轴上投影的长短则表示因子与排序轴间相关性的大小,投影的长度越长,其相关性越大。如图1所示,第一排序轴(横轴)包含了绝大部分土壤环境信息,有机碳与第一排序轴呈显著正关系(P<0.05),说明土壤酶活性主要受有机碳的影响,此外,全磷和全氮的作用也非常显著。第一排序轴从左到右土壤有机碳呈增加的趋势,生境由有机碳质量分数较低的针叶林模式过渡到有机碳质量分数较高的灌草模式和针阔混交林模式,有机碳质量分数较高的生境中,多酚氧化酶、过氧化氢酶、脲酶、蔗糖酶均有较高质量分数;与第二排序轴(纵轴)呈显著正相关的是土壤的密度,第二排序轴从上到下土壤密度呈下降的趋势,淀粉酶在土壤密度小的生境中质量分数较高。因此,RDA 排序图能较直观地反映出土壤中各种酶随着有机碳等环境因子的变化及变化程度。
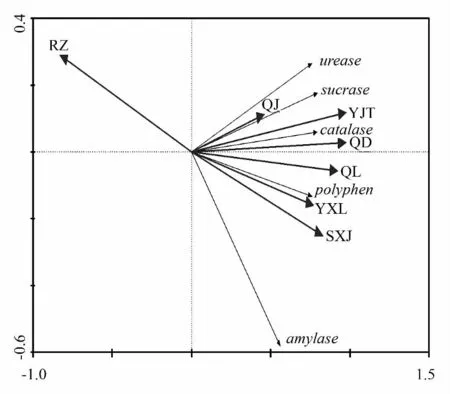
图1 土壤酶活性与多种土壤理化性质的RDA 排序图
分析土壤酶活性与各环境因子之间的关系,图1中小箭头代表各种土壤酶活性,大箭头代表土壤环境因子,小箭头连线与大箭头连线之间的夹角代表酶活性与土壤环境因子之间的相关性,相关系数在数值上等于其夹角的余弦值。由图1可见,有机碳与过氧化氢酶、蔗糖酶、脲酶、多酚氧化酶活性均具有较高的相关性,表明在有机碳质量分数高的生境中酶活性倾向于越高。而有机碳与淀粉酶之间夹角最大,相关性系数相对低,这与表4中相关性分析的结果一致。
从图1中各土壤环境因子连线长度可看出,主控因子为有机碳、全磷和全氮,因为这3 种环境因子的箭头连线较长。由此可见,有机碳不是土壤酶活性的唯一影响因子,全磷和全氮也是影响土壤酶活性的重要环境因子,它们共同影响着土壤中的酶活性。
在图2中,将箭头连线延长,做出某一次样地与环境因子的垂线,沿着环境因子箭头方向环境变量值增大。样地1(针阔混交林模式)、10(灌草模式)、7(阔叶林模式)、4(针叶林模式)均为0~20 cm表层土样地。图中综合多种土壤理化性质分析,各样地对多种土壤理化性质做垂线后显示样地1 值最大,其次为样地10、7、4,说明近期内针阔混交林模式下,土壤表层土中有机碳等养分质量分数高。综合以上分析,针阔混交林模式和灌草模式是4 种植被模式中较理想的植被模式。
工程项目管理信息化建设中,业主缺乏技术经验,仅凭开发商的宣传和自身经验作出投资判断,在投资和开发商选择上容易作出错误的判断。因贪图一些小利而导致成本增加,致使信息化建设以失败告终。为了避免这种结果发生,就要从根本上解决委托代理之间这种信息不对称的问题。在信息化建设中引入第三方会改善业主所处的劣势地位。第三方提供的专业的评估意见会帮助业主更为理性、客观的选择开发商合作,降低投资风险。业主与第三方、开发商之间构成了微妙的利益关系,三方对信息资源各取所需,从而使工程项目管理信息化建设成功的展开。
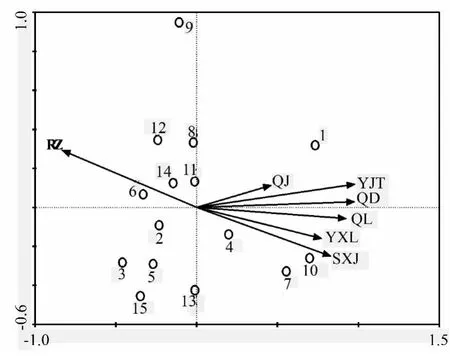
图2 不同样地与多种土壤理化性质的RDA 排序图
研究结果表明,不同植被模式下,土壤有机碳质量分数均表现为表层最高。这主要是因为植物的残体、动物的排泄物等主要积累于表土中[26],所以有机碳质量分数的增加在土壤表层更显著。在各种植被模式下,都存在土壤中有机碳质量分数高,多种酶活性就越高的规律。这是由于土壤有机碳是酶的载体,高水平的有机碳能促进土壤微生物的活动及酶的合成[27]。而土壤有机碳质量分数对不同种类酶活性的影响大小又出现不同,其原因是不同植被模式下土壤有机碳质量分数长期积累有所差异,而酶对外界环境的变化特别敏感。不同植被模式下有机碳及酶活性有明显差异,是由于不同植被模式下形成不同的土壤小气候[28],凋落物生物量越大以及分解速率较快将有利于土壤酶活性的增加[29]。以阔叶林模式为例,由于其林冠层较大,导致其林内土壤表层的温度偏低,低温不利于地表凋落物的分解,使得土壤中有机碳及酶活性相对偏低。
RDA 排序图可以综合多种环境因子,通过排序分析,把排序轴和已知的环境条件联系起来,看某一环境梯度下不同酶活性变化规律,能直观展示土壤中各种酶活性对土壤有机碳的敏感强度,因此可用来探索土壤环境因子与酶活性的内在关系。
四娃生下来就是大舌头,又有点弱智,因此也不能念书。四娃在山顶放牛能一清二楚地看到山对面我们家的院子。他在山顶呜啊呜啊唱歌的时候,恰好小珍的妈妈发现有人在她家的山林里。她最见不得谁动她家山林的柴火,因此,她每次一发现山林有人就会站在院坝扯着喉咙骂山。那天在山林里那个叫梨花的女孩一定是吓破了胆,或者她当时傻站在某棵树下,一动不敢动。
4 结论与讨论
通过对研究区内4 种不同植被模式下(以裸地为对照)不同层次的土壤酶活性和有机碳质量分数进行分析,结果表明:各植被模式下,土壤有机碳质量分数及酶活性均表现为土壤表层最高,其中针阔混交林模式下,表层土中有机碳质量分数所占百分比最大。针阔混交林模式和灌草模式下,土壤有机碳质量分数较高,与有机碳具有显著相关性的多种酶活性也较高,土壤质量相对较好,这两种模式对提高研究区内土壤有机碳质量分数及酶活性的作用较显著。
喀斯特地区石漠化危害大、治理难度大,长期以来治理喀斯特地区石漠化的主要手段是封山育林[30],然而有些地区封山后几年可恢复土壤与植被,有的石漠化地区却长时间不能恢复[31]。已退化的土地不能自然恢复就必须要对其进行生态重建。针阔混交林模式下主要树种有云南松、华山松、麻栎,这几种树种组合下土壤酶活性及有机碳质量分数较高,且都是西南地区本土物种,不存在潜在的物种入侵问题,具有可操作性,可以应用到研究区内石漠化的防治过程中。灌草模式下,物种种类丰富,则需要进一步的研究。有些研究提出在喀斯特地区可采取乔灌混交林、经济林、草本植物等多种不同模式治理石漠化[30-32]。在我国西南喀斯特地区,由于不同区域的自然背景、地理位置、石漠化程度有所不同,使喀斯特地区存在复杂性与特殊性,因此,采取的措施也具有差异性。在石漠化防治中要依据因地制宜的原则,不断探索出适合本地区、具有本地特点的防治方法。
[1] Doran J W,Parkin T B.Defining and assessing soil quality[C]//Doran J W,Coleman D C,Bezdick D F,et al.Defining soil quality for a sustainable environment.Madison,USA:Soil Science Society of America,1994:3-21.
[2] Merilä P,Malmivaara-Lämsä M,Spetz P,et al.Soil organic matter quality as a link between microbial community structure and vegetation composition along a successional gradient in a boreal forest[J].Applied Soil Ecology,2010,46(2):259-267.
[3] Jin K,Sleutel S,Buchan D,et al.Changes of soil enzyme activities under different tillage practices in the Chinese Loess Plateau[J].Soil and Tillage Research,2009,104(1):115-120.
[4] Rodriguez-Loinaz G,Onaindia M,Amezaga I,et al.Relationship between vegetation diversity and soil functional diversity in native mixed-oak forests[J].Soil Biology and Biochemistry,2007,40(1):49-60.
[5] 高扬,毛亮,周培,等.Cd,Pb 污染下植物生长对土壤酶活性及微生物群落结构的影响[J].北京大学学报:自然科学版,2010,46(3):339-345.
[6] 陈彩虹,叶道碧.4 种人工林土壤酶活性与养分的相关性研究[J].中南林业科技大学学报,2010,30(6):64-68.
[7] 任军,郭金瑞,边秀芝,等.土壤有机碳研究进展[J].中国土壤与肥料,2009(6):1-7.
[8] 姜培坤,周国模,徐秋芳.雷竹高效栽培措施对土壤碳库的影响[J].林业科学,2002,38(6):6-11.
[9] 王清奎,汪思龙,冯宗炜,等.土壤活性有机质及其与土壤质量的关系[J].生态学报,2005,25(3):513-519.
[10] 宇万太,姜子绍,李新宇,等.不同土地利用方式对潮棕壤有机碳含量的影响[J].应用生态学报,2007,18(12):2760-2764.
[11] 周程爱,张于光,肖烨,等.土地利用变化对川西米亚罗林土壤活性碳库的影响[J].生态学报,2009,29(8):4542-4547.
[12] 盛茂银,刘洋,熊康宁.中国南方喀斯特石漠化演替过程中土壤理化性质的响应[J].生态学报,2013,33(19):6303-6313.
[13] 龙健,李娟,邓启琼,等.贵州喀斯特山区石漠化土壤理化性质及分形特征研究[J].土壤通报,2006,37(4):635-639.
[14] 周炼川,陈效民,李孝良,等.西南喀斯特地区不同石漠化阶段土壤物理参数的变异研究[J].地球科学与环境学报,2010,32(2):195-199.
[15] 邹军,喻理飞,李媛媛.退化喀斯特植被恢复过程中土壤酶活性特征研究[J].生态环境学报,2010,19(4):894-898.
[16] 陈祖拥,刘方,蒲通达,等.贵州中部喀斯特森林退化过程中土壤酶活性的变化[J].贵州农业科学,2009,37(2):47-51.
[17] 袁道先.地球系统的碳循环和资源环境效应[J].第四纪研究,2001,21(3):223-232.
[18] 中国科学院南京土壤研究所.土壤理化分析[M].上海:上海科学技术出版社,1978:36-42.
[19] 关松荫.土壤酶及其研究方法[M].北京:科学技术出版社,1987:4-16.
[20] 周礼恺.土壤酶学[M].北京:科学出版社,1987:118-162.
[21] 梁启鹏,余新晓,庞卓,等.不同林分土壤有机碳密度研究[J].生态环境学报,2010,19(4):889-893.
[22] 王兵,刘国彬,薛萐,等.黄土丘陵区撂荒对土壤酶活性的影响[J].草地学报,2009,17(3):282-287.
[23] 李鹏,李占斌,薛萐,等.不同海拔对干热河谷地区土壤酶活性的影响[J].应用基础与工程科学学报,2011,19(Z):139-149.
[24] 陈光升,钟章成,齐代华.缙云山常绿阔叶林土壤酶活性与土壤肥力的关系[J].四川师范学院学报:自然科学版,2002,23(1):19-23.
[25] de Alcântara F A,Buurman P,Curi N,et al.Changes in soil organic matter composition after introduction of riparian vegetation on shores of hydroelectric reservoirs (Southeast of Brazil)[J].Soil Biology and Biochemistry,2004,36(9):1497-1508.
[26] 徐阳春,沈其荣,冉炜.长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响[J].土壤学报,2002,39(1):89-96.
[27] Baldrian P,Trögl J,Frouz J,et al.Enzyme activities and microbial biomass in topsoil layer during spontaneous succession in spoil heaps after brown coal mining[J].Soil Biology and Biochemistry,2008,40(9):2107-2115.
[28] Berger T W,Neubauer C,Glatzel G.Factors controlling soil carbon and nitrogen stores in pure stands of Norway spruce (Picea abies)and mixed species stands in Austria[J].Forest Ecology and Management,2002,159(1):3-14.
[29] Mukhopadhyay S,Joy V C.Influence of leaf types on microbial functions and nutrient status of soil:Ecological suitability of forest trees for afforestation in tropical laterite wastelands[J].Soil Biology and Biochemistry,2010,42(12):2306-2315.
[30] 苏维词,朱文孝,熊康宁.贵州喀斯特山区的石漠化及其生态经济治理模式[J].中国岩溶,2002,21(1):19-24.
[31] 王世杰,李阳兵,李瑞玲.喀斯特石漠化的形成背景、演化与治理[J].第四纪研究,2003,23(6):657-666.
[32] 熊康宁,梅再美,彭贤伟,等.喀斯特石漠化生态综合治理与示范典型研究:以贵州花江喀斯特峡谷为例[J].贵州林业科技,2006,34(1):5-8.

