食用植物油中生育酚含量测定方法优化及分析
李 柰,樊 琛,李小波,龙立梅,曹学丽
(北京工商大学食品学院/食品添加剂与配料北京高校工程研究中心,北京 100048)
食用植物油中生育酚含量测定方法优化及分析
李 柰,樊 琛,李小波,龙立梅,曹学丽*
(北京工商大学食品学院/食品添加剂与配料北京高校工程研究中心,北京 100048)
采用高效液相色谱法测定了8种24个植物油样本中生育酚的含量,并对生育酚的提取条件进行优化。在室温下,以甲醇为溶剂,采用超声法进行提取,料液比为1∶1.25,提取3次,每次20 min,采用液相色谱方法进行分析。结果表明:该方法在生育酚质量浓度为0.05~1.00 g/L时,相关系数R2可达到0.999 2~0.999 4,线性关系良好;检出限分别为α-生育酚0.5 mg/L,γ-生育酚2.0 mg/L,δ-生育酚1.2 mg/L;三水平加标样品的平均回收率为92.1%~99.8%,相对标准偏差(RSD,n=3)为2.5%~8.5%。在8种植物油中,葵花籽油中α-生育酚的质量分数较高,可达4.2349×10-4,大豆油的β/γ-生育酚、δ-生育酚及总生育酚的质量分数较高,分别为7.371 3×10-4,1.621 5×10-4,9.883 6×10-4。
食用植物油;生育酚;高效液相色谱法
生育酚(tocopherol)即维生素E,是一种脂溶性维生素,外观呈无色至浅黄色,几乎无嗅,氧化后颜色逐渐变深至棕红色[1]。天然生育酚包含4种右旋光学异构体[2],根据其苯环上所含甲基位置和数目的不同,将它们分别命名为α,β,γ和δ-生育酚。每种生育酚异构体的生物活性强弱不同,其中以α-生育酚的生物活性最高[3],δ-生育酚的抗氧化能力最强[4]。生育酚具有抗不育[5-6]、抗衰老[7-8]、抗氧化[9-11]、免疫调节[12-14]、胰岛细胞保护[15-16]等诸多功能,因而被人们广泛研究。植物油是人们日常生活中获取生育酚的主要来源之一,不同品种的植物油中生育酚的含量有较大差异[17],因此生育酚的组成和含量可以作为食用植物油脂品质的一个重要评价指标[18]。
目前,生育酚的分析方法包括高效液相色谱法、气相色谱法、薄层色谱法、纸层析法、柱层析法、比色法等[19-22],最常用的是高效液相色谱法,我国现行国家标准[23-24]、行业标准[25]均采用此法。这些标准在液相色谱分析前均采用了皂化方法进行提取,该方法时间长而且步骤复杂。为寻找更加简单易行的提取方法,本实验拟采用超声法对生育酚的提取条件进行优化,并采用高效液相色谱法测定北京居民经常食用的8个种类24个植物油样本中生育酚的含量,为居民选用富含生育酚的植物油提供参考。
1 材料与方法
1.1 材料与试剂
植物油样品分别从北京各大超市购买,共8个种类24个品牌,包括橄榄油(压榨,一级)、玉米油(压榨,一级)、花生油(压榨,一级)、葵花籽油(压榨,一级)、调和油、大豆油(浸出,一级)、芝麻油(压榨,一级)、亚麻籽油(压榨,一级),每个种类选取1~5个不同品牌;生育酚标准品:α-生育酚(色谱级,纯度99.8%)、β-生育酚(色谱级,纯度99.5%)、γ-生育酚(色谱级,纯度99.0%)、δ-生育酚(色谱级,纯度98.3%),Sigma公司;无水甲醇(分析纯),北京化工厂;甲醇(色谱纯),Fisher Scientific;纯水由Millipore-Q纯水机自制。
1.2 仪器与设备
RE-52A型旋转蒸发仪,上海亚荣生化仪器厂;GR-200型电子分析天平,北京仪诚科技公司;KQ-400DB型数控超声波清洗器,昆山市超声仪器有限公司;1260型高效液相色谱系统(配自动进样器、二极管阵列检测器DAD和色谱工作站等),美国Agilent公司。
1.3 实验方法
1.3.1 色谱条件的选择
安捷伦ZORBAX SB-C18型色谱柱(150 mm× 4.6 mm,5 μm),柱温30℃,流动相甲醇与水的体积比为98∶2,等度洗脱15 min,流速1.0 mL/min,DAD检测波长295 nm,进样量20 μL。
1.3.2 标准溶液的配制
精确称取α-生育酚、γ-生育酚、δ-生育酚标准品各10.0 mg,分别用甲醇溶解定容到10.0 mL棕色容量瓶中,各标准储备液质量浓度为1.00 g/L,并放置冰箱保存。使用前调至不同质量浓度,并用紫外分光光度法标定其准确质量浓度。
1.3.3 标准溶液质量浓度的标定
分别取生育酚标准溶液100.0 μL,用无水甲醇分别稀释定量至10.0 mL容量瓶中,在295 nm波长下测定各生育酚的吸光值,用比吸光系数计算各生育酚的质量浓度。
计算公式见式(1)。

式(1)中,C1为生育酚标准溶液的质量浓度,g/L;A为生育酚的平均紫外吸光值;E为生育酚1%比吸光系数(α、γ、δ-生育酚的E值分别以73,92,93带入);V2为标准测定溶液体积(10.0 mL);V1为标准溶液取用量,mL。
1.3.4 提取条件的选择
以某品牌大豆油为原料,在室温情况下,采用超声波法进行提取,将甲醇作为提取溶剂,分别考虑提取次数、料液比以及提取时间3个条件对提取效果的影响。
1)提取次数的确定。取1.0 g大豆油,加入10.0 mL甲醇,超声提取20 min后将上清液倒出并再次加入等体积甲醇,超声相同时间,以此类推,共提取5次。
2)料液比的确定。将大豆油与甲醇按不同提取比例1∶10,1∶5,1∶1.67,1∶1.25,1∶1,1∶0.5(g/mL)进行提取,(样品质量浓度分别为0.1,0.2,0.6,0.8,1.0,2.0 g/mL),共提取5次,每次超声20 min。
3)提取时间的确定。取1.0 g大豆油,加入10.0 mL甲醇,超声提取时间分别为10,20,30,40,50 min,共提取5次,每次均将上清液倒出并加入等体积甲醇进行再次提取。
将每次提取出的上清液浓缩至干,加1.0 mL甲醇溶解过膜,用HPLC方法进行检测。
1.3.5 加标回收率与精密度
为了考察整个方法的可靠性,分别对植物油中大豆油、调和油、玉米油的1号品牌进行混合生育酚标准品的加标回收率实验,分别加入50,100,150 μL质量浓度为0.10 g/L的混合标准使用液,每个水平重复3次,然后按照1.3.1的方法进行测定。
1.3.6 不同种类植物油中生育酚含量测定
选用市售8个不同种类、不同品牌的植物油作为样品,按照优化的方法进行超声提取,并进行HPLC分析。
2 结果与分析
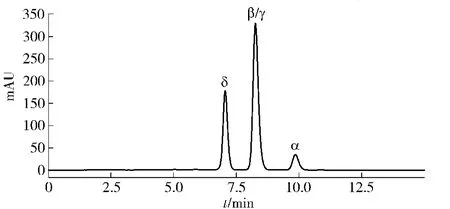
图1 生育酚标样的高效液相色谱图Fig.1 HPLC chromatogram of tocopherol standards
2.1 工作曲线与检出限分析
生育酚异构体共4种物质,但用普通C18反相色谱柱分析时,β-生育酚与γ-生育酚会在同一时间出峰,无法分开。α-生育酚、β/γ-生育酚、δ-生育酚的液相色谱如图1。在选定的色谱条件下,测定α-生育酚、γ-生育酚、δ-生育酚标准品,以标准品的质量浓度为横坐标,峰面积为纵坐标绘制标准曲线,并根据信噪比(S/N=3)计算各组分的检出限,结果如表1。生育酚异构体在质量浓度为0.05~1.00 g/L范围内线性关系良好。

表1 标准物质出峰时间、标准曲线、相关系数及检出限Tab.1 Appearance time,standard curves,correlation coefficients(R2)and limits of detection of tocopherols
2.2 提取条件优化
大豆油提取的单因素实验结果如图2。由图2可知,料液比对提取结果的影响最大,开始时随着大豆油加入量的增多,提取到的生育酚含量也越来越多,但是当提取比例大于1∶1.25(g/mL)时,提取到的生育酚的含量有所降低,这主要是由于植物油加入量过多时,甲醇不能将其完全提取,脂溶性的生育酚在植物油中有残留[26],所以最适的提取比例为1∶1.25(g/mL,即质量浓度为0.8 g/mL)。在提取次数的实验中,提取3次基本上可以将生育酚提取完全,所以最适的提取次数为3次。提取时间对提取结果的影响最小,而且随着超声时间的增加,生育酚含量有轻微降低,这可能是超声过程中温度升高,生育酚缓慢分解导致,考虑生育酚提取完全以及经济性原则,选择较佳的提取时间为20 min。
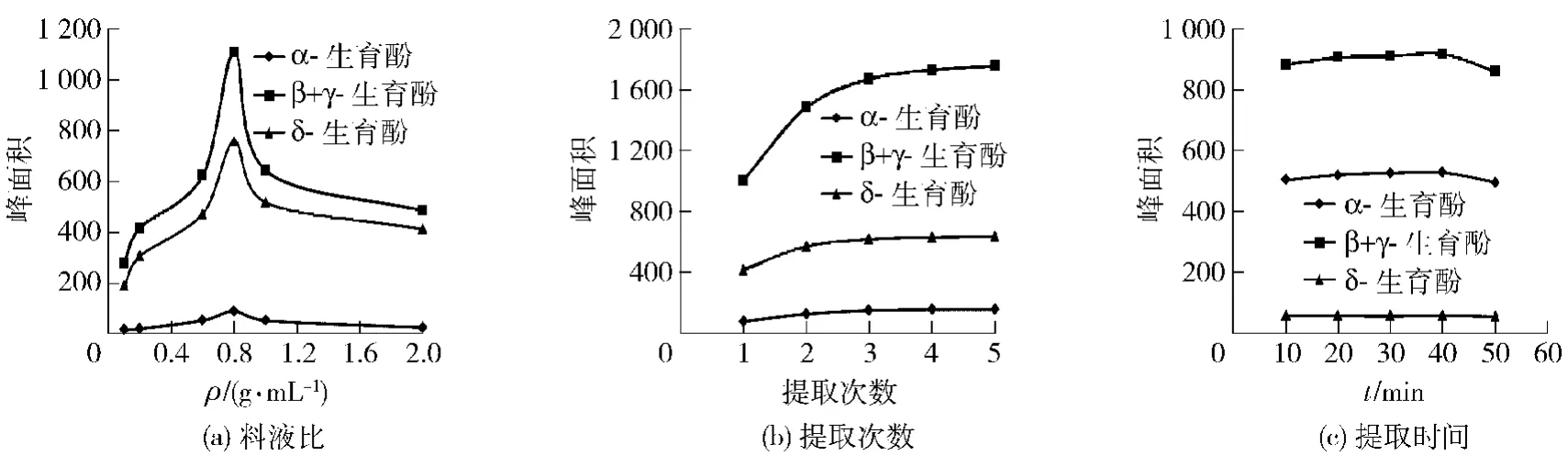
图2 大豆油提取单因素实验结果Fig.2 Single factor experiments of soybean oil extraction
2.3 方法准确性与重复性分析
植物油中大豆油、调和油、玉米油1号品牌的混合生育酚标准品回收率实验结果如表2,加标样品的平均回收率为92.1%~99.8%,相对标准偏差(RSD,n=3)为2.5%~8.5%,说明此方法对生育酚的测定具有良好的准确度和精密度。

表2 生育酚的加标回收率及RSD值Tab.2 Spiked recovery and RSD of tocopherols%
2.4 植物油中生育酚检测结果
选取8种植物油共24个样品按照优化条件进行超声提取,然后运用HPLC方法进行分析,检测结果如图3。通过图3可明显看出,在8种植物油中大豆油中β/γ-生育酚及δ-生育酚的含量最高,葵花籽油中α-生育酚的含量最高。

图3 不同植物油液相分析色谱图Fig.3 HPLC chromatogram of different edible vegetable oils
生育酚含量的具体计算结果如图4。由图4可知,活性最强的α-生育酚在葵花籽油(12~14号)中的含量较高,12号葵花籽油样品中α-生育酚质量分数可达到4.234 9×10-4。β/γ-生育酚和δ-生育酚在玉米油(4~6号)、调和油(15~17号)、大豆油(18~20号)、芝麻油(21~23号)中的质量分数较高,其中大豆油的含量最为丰富,在19号大豆油样品中β/γ-生育酚、δ-生育酚及总生育酚的质量分数可分别高达7.371 3×10-4,1.621 5×10-4,9.883 6 ×10-4。从总生育酚含量上分析,8种植物油生育酚含量由高到低顺序基本为:大豆油、调和油、玉米油、葵花籽油、芝麻油、亚麻籽油、花生油、橄榄油。
3 结论

图4 不同植物油样品生育酚含量分析Fig.4 Column chart analysis of tocopherols content in different edible vegetable oils
本实验采用超声法优化了植物油中生育酚异构体的提取条件,并采用高效液相色谱法测定了8种植物油中24个样品的含量。最适宜的超声提取方法为:在室温条件下,以甲醇为提取溶剂,料液比例为1∶1.25,超声提取3次,每次20 min。该方法在生育酚质量浓度为0.05~1.00 g/L时,相关系数R2达到0.999 2~0.999 4,线性关系良好;液相测定生育酚的检出限分别为:α-生育酚0.5 mg/L,γ-生育酚2.0 mg/L,δ-生育酚1.2 mg/L;三水平加标样品的平均回收率为92.1%~99.8%,相对标准偏差(RSD,n=3)为2.5%~8.5%,说明此方法对生育酚的测定具有良好的准确度和精密度。8种类型的植物油中,大豆油所含的β/γ-生育酚和δ-生育酚的质量分数都很高,最高值可分别达到7.371 3×10-4和1.621 5×10-4,总生育酚为9.883 6×10-4。活性最强的α-生育酚在葵花籽油中的质量分数较高,可达到4.234 9×10-4,从总生育酚含量上分析,8种植物油生育酚含量由高到低顺序为:大豆油、调和油、玉米油、葵花籽油、芝麻油、亚麻籽油、花生油、橄榄油。本实验与国标中采用的皂化提取方法相比,操作更加简单易行,且大大缩短了前处理时间,可为植物油中生育酚的提取及检测提供参考。
[1]王义永.高纯度天然维生素E工业化生产工艺路线的开发与实现[D].济南:山东大学,2013.
[2]李海洋.高含量天然α-生育酚的制备研究[D].无锡:江南大学,2013.
[3]胡传荣,赵昕,章启勇.高活性α-生育酚的制备[J].食品与机械,2005(4):10-14.
[4]兼松弘,吴艳霞.生育酚异构体的抗氧化力和基质的关系[J].油脂科技,1985(6):49-53.
[5]韩文祥.简述维生素E的功能及其缺乏症[J].黑龙江畜牧兽医,2010(16):110-111.
[6]郎楠,张树成,贺斌,等.维生素E在妊娠过程中的作用[J].中国计划生育学杂志,2013(5):352-354.
[7]李响,梁杰.枸杞多糖与维生素E延缓小鼠皮肤衰老的实验研究[J].现代中西医结合杂志,2009(13):1465-1466.
[8]张石革.维生素E与抗衰老[J].中国药房,2005(23):1839-1840.
[9]Niki E,Noguchi N.Dynamics of antioxidant action of vitaminE.[J].Acc Chem Res,2004,37(1):45-51.
[10]朱雪梅,吴俊锋,胡蒋宁,等.α-生育酚在花生油、芝麻油和菜籽油中的抗氧化效能[J].食品与发酵工业,2013(10):85-90.
[11]王丰玲,张英锋,郑向美,等.天然维生素E的制备、抗氧化机理及应用前景[J].化学教育,2007(12):10-12.
[12]王传蓉,王加启,周振峰,等.维生素E的免疫研究进展[J].中国畜牧兽医,2008(8):24-28.
[13]柴海静.维生素E的免疫功能研究[J].当代畜牧,2013(11):23-24.
[14]王凡.维生素E和免疫[J].畜牧兽医科技信息,2012(5):117.
[15]袁英,张艳,宋仕卿,等.α-生育酚缓解链脲佐菌素诱导乳鼠胰岛细胞损伤的研究[J].重庆医学,2011(7):676-677.
[16]郭兵,秦观海,袁英.α-生育酚对链脲菌素诱导乳鼠胰岛细胞凋亡的影响[J].重庆医学,2010(16):2190-2191.
[17]黄百芬,谭莹,姚建花,等.浙江省居民常用食用植物油中4种生育酚异构体的含量分析[J].营养学报,2013(1):78-82.
[18]Zuta P C,Simpson B K,Zhao X,et al.The effect of αtocopherol on the oxidation of mackerel oil[J].Food Chemistry,2007,100(2):800-807.
[19]Bele C,Matea C T,Raducu C,et al.Tocopherol content in vegetable oils using a rapid HPLC fluorescence detection method[J].Notulae Botanicae Horti Agrobotanici Cluj-Napoca,2013,41(1):93-96.
[20]Nagao T,Kobayashi T,Hirota Y,et al.Improvement of aprocess for purification of tocopherols and sterols from soybean oil deodorizer distillate[J].Molecular Catalysis B:Enzymatic,2005,37(1-6):56-62.
[21]Cheman Y B,Ammawath W,Mirghani M E S.Determining α-tocopherol in refined bleached and deodorized palm olein by Fourier transform infrared spectroscopy [J].Food Chemistry,2005,90(1-2):323-327.
[22]Kadioglu Y,Demirkaya F,Demirkaya A K.Quantitative determination of underivatized α-tocopherol in cow milk,vitamin and multivitamin drugs by GC-FID[J]. Chromatographia,2009,70(3-4):665-670.
[23]孟橘,倪芳妍,夏天文,等.GB/T 26635—2011动植物油脂生育酚及生育三烯酚含量测定高效液相色谱法[S].北京:中国标准出版社,2011.
[24]王光亚,李晶.GB/T 5009.82—2003食品中维生素A和维生素E的测定[S].北京:中国标准出版社,2003.
[25]谢立华,李培武,丁小霞,等.NY/T 1598—2008食用油中维生素E组分和含量的测定高效液相色谱法[S].北京:中国农业出版社,2008.
[26]于瑞祥,张欣,张秀芹,等.反相高效液相色谱法同时测定植物油中四种生育酚[J].分析测试学报,2013(6):764-767.
Optimization of Determination Method and Analysis on Tocopherol Content in Edible Vegetable Oils
LI Nai,FAN Chen,LI Xiaobo,LONG Limei,CAO Xueli*
(School of Food and Chemical Engineering/Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients,Beijing Technology and Business University,Beijing 100048,China)
The tocopherol contents in 8 kinds of edible vegetable oils(total 24 samples)were determined by HPLC and the extraction conditions were optimized.Tocopherol was extracted three times by the ultrasonic method and the extraction conditions were liquid material ratio 1∶1.25 and extraction time 20 min. The results showed that the correlation coefficient R2was 0.999 2-0.999 4 within the scope of 0.05-1.00 g/L.The detection limits of α-tocopherol,γ-tocopherol,and δ-tocopherol were 0.5,2.0,1.2 mg/L,respectively,and the recovery average was 92.1%-99.8%.Meanwhile,the relative standard deviation(RSD,n=3)was between 2.5%-8.5%.Sunflower seed oil had the highest α-tocopherol content(4.234 9×10-4)while soybean oil had the highest β/γ-tocopherol(7.371 3×10-4),δ-tocopherol(1.621 5×10-4),and total tocopherols(9.883 6×10-4)contents.
edible vegetable oils;tocopherols;HPLC
叶红波)
TS227
A
10.3969/j.issn.2095-6002.2015.03.011
2095-6002(2015)03-0059-05
李柰,樊琛,李小波,等.食用植物油中生育酚含量测定方法优化及分析[J].食品科学技术学报,2015,33(3):59-63.
LI Nai,FAN Chen,LI Xiaobo,et al.Optimization of determination method and analysis on tocopherol content in edible vegetable oils[J].Journal of Food Science and Technology,2015,33(3):59-63.
2014-07-09
北京市自然科学基金重点资助项目(KZ201410011016)。
李 柰,女,硕士研究生,研究方向为生物分离工程;
*曹学丽,女,教授,博士,主要从事生物分离技术方面的研究。
。

