不同材料固定化柚苷酶的比较
段志涛,夏金兰,单 杨,3,*
(1.中南大学研究生院隆平分院,湖南长沙 410125;2.中南大学资源加工与生物工程学院,湖南长沙 410083;3.柑橘资源综合利用国家地方联合工程实验室/湖南省农产品加工研究所,湖南长沙 410125)
不同材料固定化柚苷酶的比较
段志涛1,夏金兰2,单 杨1,3,*
(1.中南大学研究生院隆平分院,湖南长沙 410125;2.中南大学资源加工与生物工程学院,湖南长沙 410083;3.柑橘资源综合利用国家地方联合工程实验室/湖南省农产品加工研究所,湖南长沙 410125)
选取壳聚糖、海藻酸钠、活性炭和氧化石墨烯对柚苷酶进行固定化,比较不同材料对柚苷酶的载酶率和固定化酶活,得到较佳的固定化材料为氧化石墨烯,其载酶率达85.61%,酶活达410.50 U/g,重复使用7次后仍能保持72.38%的相对酶活。同时研究了不同条件对氧化石墨烯固定化柚苷酶催化活性影响,得到较佳的固定条件:载酶量为每克氧化石墨烯材料承载60 mg柚苷酶,固定化温度为20℃,pH值为4.0,固定化吸附时间为9 h,优化后氧化石墨烯固定化柚苷酶的酶活为433.70 U/g,重复使用7次后仍保留78.62%的酶活。
壳聚糖;海藻酸钠;活性炭;氧化石墨烯;固定化;柚苷酶
柑橘类果汁中含有柚皮苷、新橙皮苷等为代表的黄烷酮糖苷类化合物和以柠檬苦素、诺米林等为代表的三萜类化合物的苦味物质[1]。含量较多的苦味物质为柚皮苷(4′-5,7′-三羟基二氢黄酮-7-鼠李糖葡萄糖苷)。目前大多利用生物酶法脱苦,该法具有高效、专一、条件温和、脱苦效果好等优势。柚苷酶(EC 3.2.1.40)具有α-L-鼠李糖苷酶和β-D-葡萄糖苷酶的活性,主要被应用于果汁的脱苦及制药工业[2]。柚苷酶分解柚苷主要分两步完成,柚皮苷被鼠李糖苷酶水解为α-L-鼠李糖和普鲁宁,普鲁宁的苦味约为柚皮苷的三分之一;普鲁宁又在β-D-葡萄糖苷酶的作用下被水解为无苦味的柚皮素和葡萄糖[2]。
但由于目前纯柚苷酶制剂成本较高,游离酶又无法回收再利用,而固定化酶既可保持酶的高效性又可回收再使用。雷生娇等[3-5]选择壳聚糖、海藻酸钠、介孔分子筛MCM-41等材料,采用交联-吸附或包埋的方法对柚苷酶固定化,取得了一些效果。毕金峰[6]利用活性炭固定化转移α-葡萄糖苷酶,研究发现固定化酶的酶活较高,稳定性好。Zhao等[7]以还原氧化石墨烯(reduced graphene oxide)为载体,采用非共价吸附的方法对葡萄糖氧化酶和葡萄糖淀粉酶进行共同固定化,得到固定化双酶体系,同氧化石墨烯固定化双酶相比,固定化酶的活性得到显著提高。氧化石墨烯的基面上主要是酚羟基和环氧基团,羧基分布在边缘处[8]。石墨烯氧化物,有巨大的比表面积和丰富的官能团,有很好的亲水性,是理想的固定化酶载体[9]。
为了找到可以提高固定化柚苷酶的酶活性和重复使用率较佳的固定化材料,本研究选取了壳聚糖、海藻酸钠、活性炭和氧化石墨烯4种材料,分别进行固定化柚苷酶的研究比较,首次将氧化石墨烯用于固定化柚苷酶。并选出较佳的材料进行固定化条件优化,为固定化柚苷酶的应用发展提供研究基础。
1 材料与方法
1.1 材料与试剂
柚苷酶,CAS号9068-31-9,369 U/g;柚皮苷,经HPLC检测纯度为98%,美国Sigma-Aldrich公司;考马斯亮蓝G-250,北京鼎国昌盛生物技术有限责任公司;壳聚糖(脱乙酰度≥95.0%),Ruibio C4415,Reagent Grade;一缩二乙二醇(diethylene glycol,DEG)(化学纯)、活性炭、氧化石墨烯,国药集团化学试剂有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
雷磁PHS-3C型pH计,上海仪电科学仪器股份有限公司;Epoch超微量微孔板分光光度计,BioTek Instruments公司;FA2004型电子天平,上海舜宇恒平科学仪器有限公司;SC-15A型电热恒温水浴锅,宁波是海曙天恒仪器厂;DHG-9070A型电热恒温鼓风干燥箱,上海一恒科技有限公司;Anke TGL-16GA型冷冻离心机,上海安亭科学仪器厂。
1.3 实验方法
1.3.1 载体的制备
活性炭和氧化石墨烯直接固定化,无需制备成微球。
1.3.1.1 壳聚糖微球的制备
称取3.5 g壳聚糖,用100 mL φ(醋酸)=2.0%的水溶液溶解,配制成ρ(壳聚糖)=3.5 g/100 mL的胶体溶液,并将溶液超声处理20 min,驱除气泡、使其充分溶解。在另一烧杯中配制一定质量浓度的NaOH和乙醇混合凝结液1 000 mL。用10 mL的注射器吸取壳聚糖胶体溶液,逐滴滴入上述凝结液中制成微球,滴加完后于室温(25℃)条件下放置3 h,用去离子水反复洗涤壳聚糖微球直至中性,再用蒸馏水冲洗3次,抽干,4℃冷藏备用[3-10]。凝胶化的壳聚糖微球表面含有丰富的氨基基团,以共价键结合的方式,可以得到稳定的固定化酶,外界条件的改变不易导致酶分子的脱落[11]。
1.3.1.2 海藻酸钠微球的制备
制备方法同壳聚糖微球的制备,只是将凝结液变为一定质量浓度的CaCl2溶液。在注射器推动力和电场力作用下,原料液滴入低温CaCl2溶液,迅速固化,形成海藻酸钙凝胶微球,浸泡,清洗,真空避光,室温干燥[12]。
1.3.2 不同材料固定化柚苷酶
分别称取不同质量的载体材料(壳聚糖、海藻酸钠微球1.0 g,活性炭过120目筛且取0.5 g,氧化石墨烯取0.05 g),加入到4 mL 1.0 mg/mL的柚苷酶酶液(pH 4.0,0.2 mol/L醋酸缓冲液)中,25℃恒温振荡(180 r/min)2 h,4℃冰箱中吸附6.0 h。再用pH 4.0的醋酸缓冲液洗去固定化酶表面游离酶,收集游离酶液。即得到固定化柚苷酶,4℃冰箱保存。
1.3.3 固定化柚苷酶活力的测定
采用中林改良Davis法[13-14]。利用柚皮苷在碱性条件下及40℃温度中,能与一缩二乙二醇发生反应。柚皮苷起显色反应(黄色),生成一种叫柚皮苷二氢查尔酮的物质。利用此反应,可以配制出柚皮苷的标准溶液,并绘制出标准曲线。
柚苷酶活力测定。取2 mL柚苷标准溶液400 μg/mL和0.2 mol/L的pH 4.0醋酸缓冲液2 mL置于试管中,在40℃恒温摇床中预热4~5 min,然后向该试管置入0.1 g固定化柚苷酶,保温30 min,再置沸水中5 min终止酶活,取该反应液通过超微量微孔板分光光度计分析柚苷含量,计算酶活。
固定化柚苷酶活力的定义为在40℃,pH 4.0条件下,每分钟每克固定化酶分解柚皮苷的微克数表示为一个酶活力[15],单位U。
1.3.4 固定化柚苷酶载酶率的测定
采用考马斯亮蓝测蛋白的方法[16-17]。所有材料固定化柚苷酶后,所收集的游离酶液用pH 4.0醋酸缓冲液定容至10 mL,同时取4 mL 1.0 mg/mL的标准柚苷酶酶液同样定容至10 mL,在590 nm处用考马斯亮蓝法测蛋白含量。根据不同材料固定后剩余游离柚苷酶与未固定化标准柚苷酶计算出不同材料固定化柚苷酶的载酶率。
2 结果与分析
2.1 不同载体对固定化柚苷酶的影响
2.1.1 固定化柚苷酶酶活的比较
壳聚糖和海藻酸钠分别以微球的形式吸附柚苷酶,酶活分别达到14.34 U/g和12.18 U/g,活性炭也具有较强的吸附能力,其固定化酶活达20.50 U/g,而氧化石墨烯由于有较大的比表面积和非共价键的吸附方式既可以稳定地固定化柚苷酶,又可在反应时逐步释放柚苷酶分子,其固定化酶活高达410.50 U/g,是其他3种材料的20倍以上。
2.1.2 固定化柚苷酶载酶率的比较
壳聚糖微球由于本身不太稳定,操作时柚苷酶酶液容易使其小部分分散,致使吸附不能完全,载酶率为28.34%。海藻酸钠微球透明有弹性,载酶率高达91.81%。活性炭分子亦有极强的吸附能力,载酶率为76.11%。氧化石墨烯本身具有的很强共价键吸附能力,使其载酶率达85.61%。
2.1.3 固定化柚苷酶重复使用率的比较
壳聚糖固定化柚苷酶由于本身吸附的不稳定性,以及在反应时受外在条件如温度、pH值的影响,使其在多次重复使用后相对酶活下降迅速。在重复使用第2次时酶活为第1次的74.31%,第3次为39.96%,第4次为36.73%,第5次为33.80%,第6次为19.13%,第7次使用时已降到15.02%的相对酶活。
海藻酸钠固定化柚苷酶重复使用情况见图1。

图1 不同使用次数对海藻酸钠固定化柚苷酶相对酶活的影响Fig.1 Effect of using times on relative activity of alginate immobilized naringinase
由图1可见,由于其较强的耐热耐酸等稳定性,海藻酸钠固定化柚苷酶在使用7次后相对酶活保持在51.78%的水平,随着使用次数的增多逐步下降。
活性炭固定化柚苷酶重复使用情况见图2。
由图2可见,由于活性炭的比表面积较小,不能很好地释放柚苷酶分子,相对酶活迅速下降,3次使用后相对酶活已下降到38.13%,使用7次后为10.57%。
氧化石墨烯固定化柚苷酶重复使用情况见图3。由图3可见,氧化石墨烯固定化柚苷酶的非共价键吸附方式可以稳定地吸附柚苷酶分子,又可以逐步有效地释放柚苷酶分子,达到较好的重复利用效果,3次使用后仍可以保持在89.18%相对酶活水平,使用7次后仍有72.38%相对酶活。氧化石墨烯大比表面积的石墨片与生物分子均匀附着,并不改变附着的生物分子的天然生化特性,固定化的β-半乳糖苷表现出优异的重复利用性,经过10次重复使用保留92%以上的酶活性,以及理想的性能[18]。
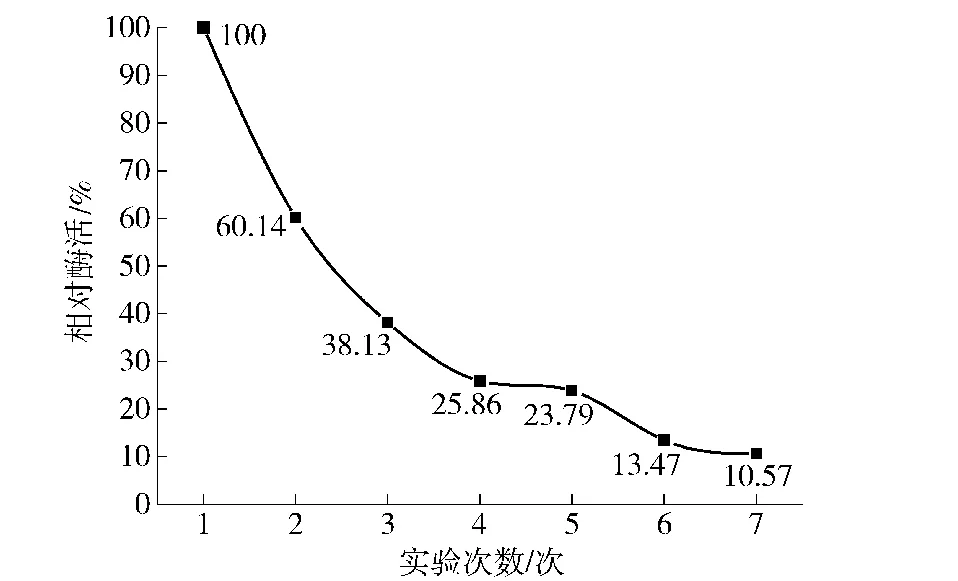
图2 不同使用次数对活性炭固定化柚苷酶的相对酶活的影响Fig.2 Effect of using times on relative activity of activated carbon immobilized naringinase
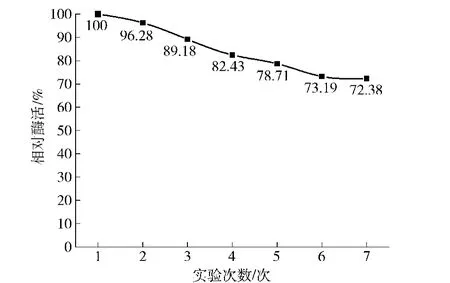
图3 不同使用次数对氧化石墨烯固定化柚苷酶相对酶活的影响Fig.3 Effect of using times on relative activity of graphene oxide immobilized naringinase
2.2 氧化石墨烯固定化柚苷酶工艺条件优化
对比壳聚糖、海藻酸钠、活性炭和氧化石墨烯固定化柚苷酶的酶活、载酶率和重复使用时的相对酶活情况。可以看出氧化化石墨烯固定化柚苷酶有最高的酶活410.5 U/g,是其他材料的20多倍。载酶率海藻酸钠为92.81%,氧化化石墨烯为85.61%次之。经过重复使用后壳聚糖、海藻酸钠、活性炭的相对酶活达到51.78%甚至更低,氧化化石墨烯经过7次使用过后仍保持72.38%的相对酶活。综合评定氧化石墨烯为较佳固定化柚苷酶材料。为了更好地利用这种新型材料,对其固定化柚苷酶工艺条件进行优化。
2.2.1 给酶量对固定化柚苷酶活力的影响
取氧化石墨烯粉末0.05 g分别加入到4 mLρ(柚苷酶)分别为0.25,0.50,0.75,1.00,1.25,1.75 mg/mL的酶液中(pH 4.0,0.2 mol/L醋酸缓冲液)中,25℃恒温振荡(180 r/min)2 h,4℃冰箱中吸附6.0 h。在4℃,12 000 r/min条件下冷冻离心10 min,分离游离酶液。即得氧化石墨烯固定化柚苷酶,4℃冰箱中保存后并测酶活,见图4。
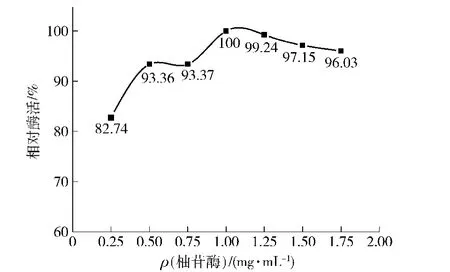
图4 给酶量对氧化石墨烯固定化柚苷酶活力的影响Fig.4 Effect of different amounts of enzyme on activity of graphene oxide immobilized naringinase
由图4可见,在柚苷酶质量浓度在0.25~1.00 mg/mL时,随着质量浓度的增加氧化石墨烯分子间的空隙还未完全吸附完全,当质量浓度超过1.00 mg/mL时,随着质量浓度的增加氧化石墨烯分子已经吸附饱和状态,继续增加会降低酶活,因此0.05 g氧化石墨烯固定化柚苷酶的较佳质量浓度为1.00 mg/mL,即每克氧化石墨烯材料的载酶率为80 mg。
2.2.2 不同pH值对氧化石墨烯固定化柚苷酶酶活的影响
确定氧化石墨烯固定化柚苷酶的较佳质量浓度为1.00 mg/mL,配制pH值为2.0,3.0,4.0,5.0,6.0,7.0,8.0的磷酸缓冲液,用来配制对应pH值的质量浓度为1.00 mg/mL柚苷酶溶液4 mL,加入氧化石墨烯粉末0.05 g,25℃恒温振荡(180 r/min)2 h,4℃冰箱中吸附6.0 h。在4℃,12 000 r/min条件下冷冻离心10 min,分离游离酶液。即得氧化石墨烯固定化柚苷酶,4℃冰箱中保存后并测酶活,见图5。
由图5可见,在pH值小于4.0的酸性条件下氧化石墨烯固定化柚苷酶活力下降迅速,在pH值大于4.0甚至升至中性条件下氧化石墨烯固定化柚苷酶活力下降更加迅速,最适的pH值为4.0。

图5 pH值对氧化石墨烯固定化柚苷酶活力的影响Fig.5 Effect of different pH values on activity of graphene oxide immobilized naringinase
2.2.3 不同温度对氧化石墨烯固定化柚苷酶酶活的影响
确定氧化石墨烯固定化柚苷酶的较佳质量浓度为1.00 mg/mL,较佳pH值为4.0。分别取氧化石墨烯粉末0.05 g加入到4 mL、pH 4.0、1.00 mg/mL柚苷酶溶液,在20,25,30,35,40,45,50℃条件下,恒温振荡(180 r/min)2 h,4℃冰箱中吸附6.0 h。在4℃,12 000 r/min条件下冷冻离心10 min,分离游离酶液。即得氧化石墨烯固定化柚苷酶,4℃冰箱中保存后并测酶活,见图6。
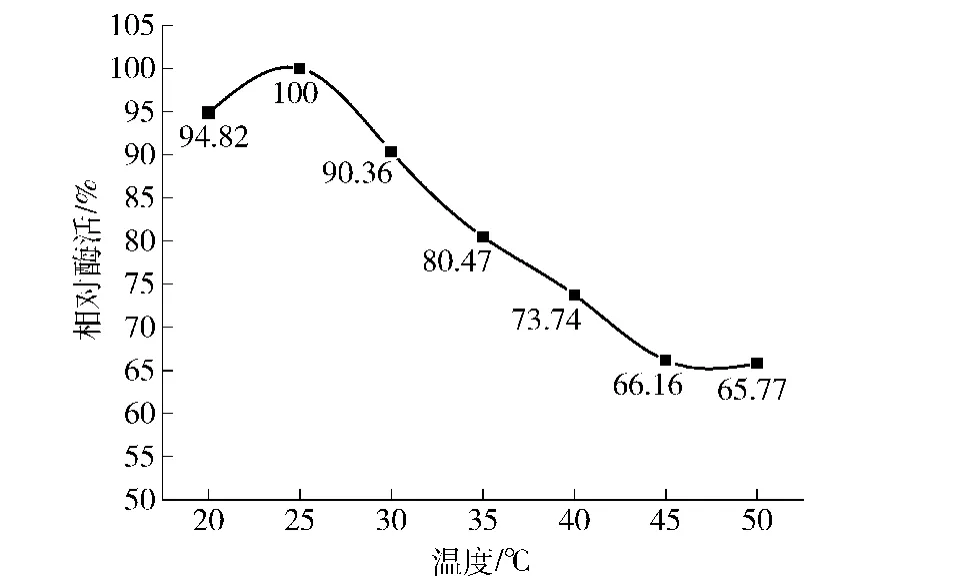
图6 温度对氧化石墨烯固定化柚苷酶活力的影响Fig.6 Effect of different temperatures on activity of graphene oxide immobilized naringinase
由图6可知,在氧化石墨烯吸附柚苷酶时,当温度超过室温25℃时,随着温度的升高,相对酶活迅速下降,当温度低于室温时,氧化石墨烯的吸附能力也有所下降,较佳的吸附温度为25℃。
2.2.4 不同吸附时间对氧化石墨烯固定化柚苷酶酶活的影响
确定氧化石墨烯固定化柚苷酶的较佳质量浓度为1.00 mg/mL,较佳pH值为4.0,较佳吸附温度为25℃。分别取氧化石墨烯粉末0.05 g加入到4 mL、pH 4.0、1.00 mg/mL柚苷酶溶液,在25℃条件下,恒温振荡(180 r/min)2 h,4℃冰箱中分别吸附0,3,6,9,12,15,18 h后,在4℃,12 000 r/min条件下冷冻离心10 min,分离游离酶液。即得氧化石墨烯固定化柚苷酶,4℃冰箱中保存后并测酶活,见图7。

图7 吸附时间对氧化石墨烯固定化柚苷酶活力的影响Fig.7 Effect of different adsorption time on activity of graphene oxide immobilized naringinase
由图7可见,大多数吸附时间固定化酶的相对酶活能达到87.52%以上,当吸附时间在6 h时,达到最大的相对酶活,较佳吸附时间为6 h。
2.2.5 氧化石墨烯固定化柚苷酶条件优化
根据单因素实验结果,选择对固定化酶酶活力影响较大的因素:氧化石墨烯与柚苷酶酶质量比、pH值、吸附温度、吸附时间进行L9(34)正交试验,确定较佳固定化条件。正交试验因素与水平设计及结果分析见表1。
由表1可知,影响固定化酶比活力的因素主次依次为C、D、B、A,即pH值为氧化石墨烯固定化柚苷酶最重要的影响因素。按照各因素的最好水平选取最优固定化工艺为A1B1C2D3,根据正交试验所得的较佳工艺条件,进行3次平行实验,测得氧化石墨烯固定化柚苷酶酶活平均值为(433.70±1.14)U/g,高于于正交试验中9组实验的酶活最高组。
根据方差分析可知,A、B、C、D四因素的F比分别为0.11,0.50,4.78,2.62。查表可知F0.05(2,8)= 4.41,F0.01(2,8)=8.65。对于C因素F比>F0.05(2,8)=4.41,F比<F0.01(2,8)=8.65,pH值影响显著,其他因素均不显著。各个因素对实验指标影响的主次与极差分析相同,即以0.05 g氧化石墨烯加入4 mL质量浓度为0.75 mg/mL(每克氧化石墨烯载酶量60 mg)、pH 4.0的柚苷酶溶液中,在20℃(固定化温度)恒温振荡(180 r/min)2 h,4℃冰箱中吸附9 h。
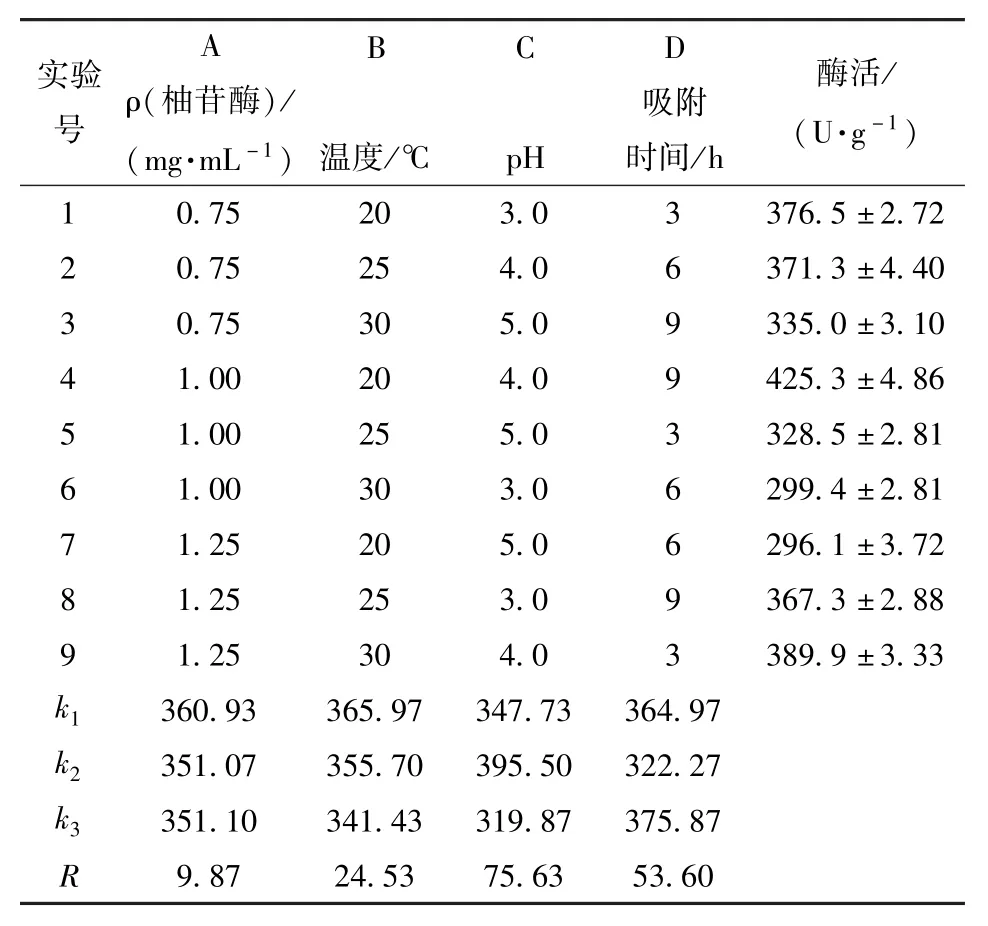
表1 正交试验设计及结果Tab.1 Orthogonal experimental design and results
3 结论
分别以壳聚糖、海藻酸钠、活性炭和氧化石墨烯4种材料对柚苷酶进行固定化,通过对固定化酶活、载酶率和重复使用率的指标考察,选出较佳的固定化材料为氧化石墨烯。通过单因素实验确定了较佳值,并通过正交试验进一步确定实验因素。氧化石墨烯固定化柚苷酶的较佳条件为每克氧化石墨烯载酶量60 mg、缓冲液pH为4.0、固定化温度为20℃、吸附时间为9 h。本研究基本确定了一种新型固定化材料氧化石墨烯,并优化了氧化石墨烯固定化柚苷酶的条件。
[1]单杨,李高阳.现代生物技术在柑橘工业应用的研究进展[J].食品与机械,2007,23(5):142-145.
[2]雷生姣,潘思轶.柚(皮)苷酶的研究进展[J].食品科学,2009(19):314-318.
[3]雷生姣,余海立,黄超,等.交联壳聚糖载体固定化柚苷酶工艺[J].食品科学,2013,34(23):233-238.
[4]雷生姣,潘思轶,肖敏,等.MCM-41固定化柚苷酶脱苦葡萄柚汁[J].食品工业科技,2012,33(1):189-193.
[5]雷生姣,潘思轶.交联海藻酸钠固定化柚(皮)苷酶[J].食品工业科技,2014,35(1):232-236.
[6]毕金峰.活性炭固定化α-转移葡萄糖苷酶的研究[J].河南工业大学学报:自然科学版,2006,26(5):11-14.
[7]Zhao F,Li H,Jiang Y,et al.Co-immobilization of multi-enzyme on control-reduced graphene oxide by noncovalent bonds:an artificial biocatalytic system for the one-pot production of gluconic acid from starch[J]. Green Chemistry,2014,16(5):2558-2565.
[8]Kim J,Cote L J,Kim F,et al.Graphene oxide sheets at interfaces[J].Journal of the American Chemical Society,2010,132(23):8180-8186.
[9]Zhang Jiali,Zhang Feng,Yang Haijun,et al.Graphene oxide as a matrix for enzyme immobilization[J].Langmuir,2010,26(9):6083-6085.
[10]孙素芳,张燕,吕树芳,等.壳聚糖固定化酶载体小球的研究及制备方法的改进[J].河北大学学报:自然科学版,2009,29(2):168-172.
[11]夏莹.壳聚糖微球旳制备及其固定化多功能淀粉酶0PMA-N的研究[D].长春:吉林大学,2014.
[12]吴秋惠,吴皓,王令充,等.海藻酸钠微球的制备及其在药物载体中的应用进展[J].中华中医药杂志,2011,26(8):1791-1794.
[13]龙俊敏.柚苷酶活力测定方法的研究[J].江西林业科技,2012(3):28-30.
[14]蒋超,蔡慧农,倪辉,等.利用DNS法快速分析及优化柚皮苷的酶解过程[J].微生物学通报,2014,41(2):408-415.
[15]崔培梧.Penicillium sp.1523液态发酵生产柚苷酶及酶的固定化研究[D].中南林业科技大学,2009.
[16]王孝平,邢树礼.考马斯亮蓝法测定蛋白含量的研究[J].天津化工,2009,23(3):40-42.
[17]裴显庆.用考马斯亮蓝染色方法测定蛋白质含量[J].肉类研究,1990(1):36-37.
[18]Devesh K,Mahe T,Srivastava O N,et al.Immobilization of β-galactosidase onto functionalized graphene nano-sheets using response surface methodology and its analytical applications[J].PloS One,2012,7(7):1-13.
Comparative Study of Different Materials Immobilized Naringinase
DUAN Zhitao1,XIA Jinlan2,SHAN Yang1,3,*
(1.Longping Branch Graduate School,Central South University,Changsha 410125,China;2.School of Resource Process and Bioengineering,Central South University,Changsha 410083,China;3.Citrus Resources Comprehensive Utilization of Local and National Joint Project Laboratory/ Hunan Agricultural Product Processing Institute,Changsha 410125,China)
Chitosan,sodium alginate,activated carbon,and graphene oxide were selected to immobilizenaringinase.By comparing the activities of immobilized naringinase and the enzyme-carrying rates of the enzyme carriers,it was found that graphene oxide was the optimal material.The enzyme-carrying rate of graphene oxide was 85.61%and theenzyme activity of graphene oxide immobilized naringinase was 410.50 U/g.The enzyme activity remained 72.38%relative activity after 7 times using.Simultaneously,the effects of different conditions on catalytic activity of graphene oxide immobilized naringinase were studied.It was obtained that the optimal load amount of naringinase per gram of graphene oxide 60 mg,optimal temperature 20℃,optimal pH 4.0,and immobilization adsorption time 9 h.The activity of graphene oxide immobilized naringinase reached 433.70 U/g under the optimized conditions,which remained 78.62%relativity activity after 7 times using.
chitosan;sodium alginate;activated carbon;graphene oxide;immobilization;naringinase
李 宁)
TS201.1
A
10.3969/j.issn.2095-6002.2015.03.008
2095-6002(2015)03-0043-06
段志涛,夏金兰,单杨.不同材料固定化柚苷酶的比较[J].食品科学技术学报,2015,33(3):43-48.
DUAN Zhitao,XIA Jinlan,SHAN Yang.Comparative study of different materials immobilized naringinase[J].Journal of Food Science and Technology,2015,33(3):43-48.
2015-01-22
湖南省科技领军人才培养项目(2013RS4078)。
段志涛,男,硕士研究生,研究方向为农产品加工及贮藏工程;
*单 杨,男,研究员,博士,主要从事农产品加工及贮藏方面的研究。
。

