外源茉莉酸诱导方式对长白落叶松针叶内防御蛋白活力的影响1)
王杰 孟昭军 王琪 严善春 张晓娇
(东北林业大学,哈尔滨,150040) (黑龙江省森林保护研究所) (东北林业大学) (鄂尔多斯市东胜区园林绿化事业局)
责任编辑:程 红。
诱导抗虫性是指植物在遭受植食性昆虫取食后所表现出来的一种抗虫特性[1],当其被取食者为害到一定程度时,植物通过增减某些化合物质或释放挥发物影响植食者行为或降低其嗜好的反应,是一种类似于免疫反应的抗性现象[2-4]。目前已发现多种信号物质,可以人工诱导植物的系统抗性,茉莉酸是其中重要的一种。茉莉酸(JA)是一种具有多种生理功能的植物激素,除调节植物的基础发育外,还在植物的愈伤反应、昆虫取食和水分胁迫反应中起信号传递的作用,诱导植物直接和间接防御反应的发生[5]。在番茄中,外源茉莉酸或茉莉酸甲酯刺激与食草动物取食产生相同的防御蛋白多酚氧化酶(PPO)、过氧化物酶(POD)、蛋白酶抑制剂(PIs)、和脂氧合酶[6]。外源茉莉酸(JA)处理可诱导枸杞叶产生显著的防御反应,表现为蛋白酶抑制剂活性、木质素含量、超氧化物歧化酶(SOD)和苯丙氨酸解氨酶(PAL)活性显著增加[7]。茉莉酸诱导通过增加棉叶单宁和PIs含量、提高棉叶PAL、PPO和POD活性等增强棉花幼苗的抗虫性[8]。茉莉酸处理使青杨叶POD、PPO、PAL、胰凝乳蛋白酶抑制剂(CI)、胰蛋白酶抑制剂(TI)活性增加[9],防御性次生代谢物含量或挥发性有机物释放量增加,对害虫的抗性提高。
长白落叶松(Larix olgensis)是东北、内蒙古等地的主要造林树种,其人工林常受落叶松毛虫(Dendrolimus superans)、舞毒蛾(Lymantria dispar)等害虫的严重危害[10]。外源茉莉酸类化合物能诱导长白落叶松抗虫性增强,使其针叶内多酚氧化酶和苯丙氨酸解氨酶活性明显增加,蛋白酶抑制剂活性明显增强[11]。但用外源茉莉酸类化合物局部处理落叶松能否产生类似全株处理的抗性增强诱导效果?尚未见报道。本研究用不同浓度茉莉酸对长白落叶松进行全株或局部诱导,分析诱导后长白落叶松针叶内防御蛋白活性的时序变化,探讨茉莉酸不同浓度和不同处理方式对长白落叶松诱导抗性的影响,为落叶松林提供较为适宜的害虫治理对策奠定基础。
1 材料与方法
1.1 供试落叶松苗及处理
2012年4月末,将4年生长白落叶松苗种植于直径为23 cm、深25 cm的塑料桶中,摆放于黑龙江省平山森林植物检疫隔离试种苗圃空地上,自然光照条件下培育备用。7月,对培育的落叶松苗进行诱导处理。将茉莉酸(≥95%,Sigma-Aldrich)用无水乙醇和蒸馏水稀释为0.01、0.01、1.00 mmol·L-1的溶液。将长白落叶松苗随机分为7个处理组,分别为对照、3个浓度茉莉酸全株处理、3个浓度茉莉酸局部处理,每个处理组90株。全株处理组:用500 mL手动小喷壶将不同浓度药液均匀喷施在长白落叶松苗的全部枝条上。局部处理先将落叶松苗套袋,露出落叶松苗一侧的4个枝条,然后进行喷施,至液滴下流,待干后,重复喷施,直至药品喷完为止。每株喷施5 mL(表1)。

表1 长白落叶松苗处理方法
1.2 落叶松针叶采集
分别在喷施茉莉酸后第1、3、5、10、15、20、25天取样。取样时,全株处理组采集每株全部针叶,每3株松苗的针叶样品充分混合为一个重复,记为JA。局部处理组分为喷茉莉酸和未喷茉莉酸2个部分采集针叶,每3株松苗的喷药部分针叶样品充分混合为一个重复,记为JA局喷;未喷药部分充分混合为一个重复,记为JA局。对照组采集每株全部针叶,每3株松苗的针叶样品充分混合为一个重复,记为CK。各处理组均设置3个重复。采摘的针叶置于冰箱-40℃保存,用于针叶内防御蛋白活性的测定。
1.3 测定方法
每个样品准确称取1.0 g针叶鲜样置于研钵内,在液氮充分冷冻条件下碾碎用以测定防御酶活性。①SOD活性测定参照王晶英等[12]的氮蓝四唑染色法,测定方法略有改动。将NBT氧化50%时所需的SOD量定义为1个酶活力单位(U·g-1),对照组为3 mL反应液加入1 mL磷酸缓冲液。②TI、CI活力测定参照徐伟[13]的方法,以1 min内OD290变化0.01为1个酶活力单位(U·g-1)。③PAL活性测定采用苯丙氨酸比色法[14],以1 min内OD290变化0.01为1个酶活力单位(U·g-1)。④PPO活性测定采用咖啡酸比色法[15],以1 min内OD470变化0.01为1个酶活力单位(U·g-1)。
1.4 数据分析
数据处理使用SPSS17.0软件,采用多因素方差分析茉莉酸不同浓度、不同处理方式对SOD、PAL、PPO、TI和CI活性的影响,以LSD(最小极差法)在0.05水平下检验不同处理之间的差异显著性。
2 结果与分析
2.1 茉莉酸不同处理对长白落叶松针叶内SOD活性的影响
用3个浓度茉莉酸全株喷施后,长白落叶松针叶内SOD活性在3、5、10、20 d均显著高于对照(P<0.05);其中JA1诱导的SOD活性,在第3天和第5天活性最高,之后显著下降;JA0.1在第10天活性显著高于其他2个浓度处理组(P<0.05);JA0.01在20 d时显著高于其他2个浓度组(表2)(P<0.05)。
JA局喷第1天时,JA0.1局喷SOD活性显著低于CK和其他2个浓度(P<0.05);JA局喷第3天和第5天时,3个浓度均显著高于对照或与对照无显著差异,且JA1局喷活性显著高于其他2个浓度(P<0.05),随即显著下降。10 d时,只有JA0.1局喷显著高于CK(P<0.05);15 d时,JA0.1局喷和JA0.01局喷均显著高于对照(P<0.05);到20 d时,只有JA0.01局喷显著高于对照(P<0.05);25 d时,3个浓度诱导的SOD活性,与对照无显著差异,或显著低于CK(表2)。局喷样株上未喷施JA的针叶,除5 d的JA0.1局外,3~20 d 3个浓度的JA局的SOD活性均显著高于对照(P<0.05)(表2)。
JA1局喷在1、10、15 d显著低于JA1(P<0.05),而JA1局在第5天显著低于JA1(P<0.05),在15、20、25 d则显著高于JA1(P<0.05),在其他时间JA1局喷、JA1局与JA1差异不显著。JA0.1局喷在第1、10天时显著低于JA0.1(P<0.05),在15 d时则显著高于JA0.1(P<0.05),在3、20、25 d与JA0.1无显著差异;JA0.1局在5、25 d显著低于JA0.1(P<0.05),而在10、15、20 d时显著高于JA0.1(P<0.05),在1、3 d则与JA0.1无显著差异。JA0.01局喷只在1、10 d时显著低于JA0.01(P<0.05),其余试验天数JA0.01局喷和JA0.01局则显著高于JA0.01或与JA0.01无显著差异(表2)。总之,用0.01 mmol·L-1茉莉酸局部喷施长白落叶松可系统诱导SOD活性显著增强,诱导效果可持续20 d。
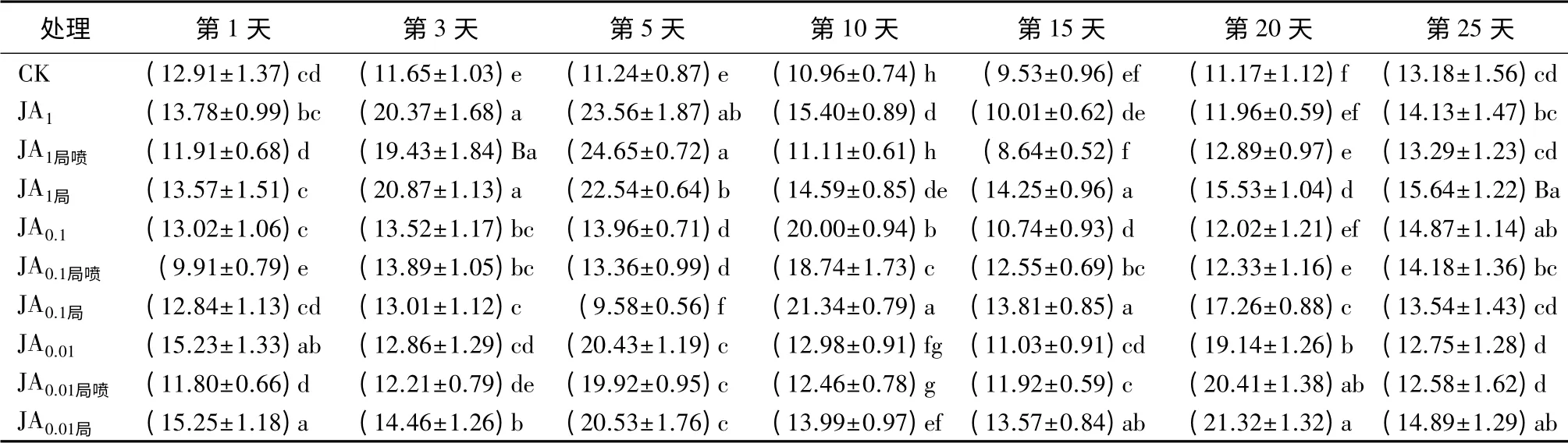
表2 茉莉酸诱导后长白落叶松针叶内SOD活性的时序变化 U·g-1
2.2 茉莉酸不同处理对长白落叶松针叶内防御酶活性的影响
2.2.1 对PAL活性的影响
用3个浓度茉莉酸全株喷施后,针叶内PAL活性在3、5、10、25 d均显著高于对照(P<0.05);其中JA1诱导的PAL活性,在第1天活性最高,显著高于JA0.1(P<0.05),之后显著下降;JA0.1在15、25 d的活性也显著高于CK,在15 d时活性显著高于其他2个喷施浓度,25 d时显著高于JA1(P<0.05);JA0.01在1、25 d活性显著高于CK(P<0.05),第1天时活性最高,显著高于JA0.1(P<0.05),25 d时显著高于JA1(P<0.05)(表3)。
JA局喷在第5天显著高于对照,第1天JA1局喷显著高于CK和JA0.1局喷(P<0.05),随即显著下降;JA0.1局喷在15和25天显著高于CK,15天时显著高于其他2个喷施浓度,25天时显著高于JA1局喷(P<0.05);JA0.01局喷在第1和25天显著高于CK,且第1天显著高于JA0.1局喷,25 d时显著高于JA1局喷(P<0.05)(表3);局喷样株上未喷施JA的针叶内,3个浓度诱导的PAL活性均显著高于对照或与对照无显著差异,变化趋势与JA局喷相近(表3)。

表3 茉莉酸诱导后长白落叶松针叶内PAL活性的时序变化 U·g-1
JA1局喷诱导的PAL活性在5、25 d显著低于JA1,JA1局则在1、3、15、25 d显著低于JA1(P<0.05)。JA0.1局喷在1、5、10、20 d时显著低于JA0.1,25 d时则显著高于JA0.1(P<0.05);而JA0.1局则在3、10 d时显著低于JA0.1,25 d时显著高于JA0.1(P<0.05)。JA0.01局喷只在3、5 d时显著低于JA0.01,在1、10、15 d则显著高 于JA0.01(P<0.05);JA0.01局则显著 高于JA0.01(P<0.05),或与JA0.01无显著差异(表3)。总之,用3种浓度茉莉酸局部喷施长白落叶松均可系统诱导PAL活性显著变化,诱导效果可持续25 d。
2.2.2 对PPO活性的影响
用3个浓度茉莉酸全株喷施后,JA1诱导的PPO活性,呈现先增后降的趋势,第10天时活性最高,15 d时开始降低,5、10、15、20 d显著高于CK,10、15 d显著高于其他2个喷施浓度(P<0.05);JA0.1诱导的PPO活性,在1、3、5、10、25 d显著高于CK(P<0.05),第3天时活性最高,显著高于其他2个喷施浓度,第15天时最低;JA0.01诱导的PPO活性,在3、15、20、25 d时活性显著高于CK,在20 d时活性最高,显著高于其他2个喷施浓度(P<0.05)(表4)。
JA1局喷同样大致呈现先增后降的趋势,在第10天时活性达到最高,显著高于其他处理,且除第1和20天外,其他天数均显著高于对照(P<0.05);JA0.1局喷在第3天时活性显著高于其他处理(P<0.05),除第20天外,其他天数均显著高于CK或与CK无显著差异;JA0.01局喷只在第20天时活性显著高于CK和其他2个喷施浓度(P<0.05),其余则与CK无差异或显著低于CK(表3);局喷样株上未喷施JA的针叶内,除1 d的JA0.01局和20、25 d的JA0.1局外,3个浓度的JA局诱导的PPO活性显著高于CK或与CK无明显差异,变化趋势与JA局喷相近(表4)。
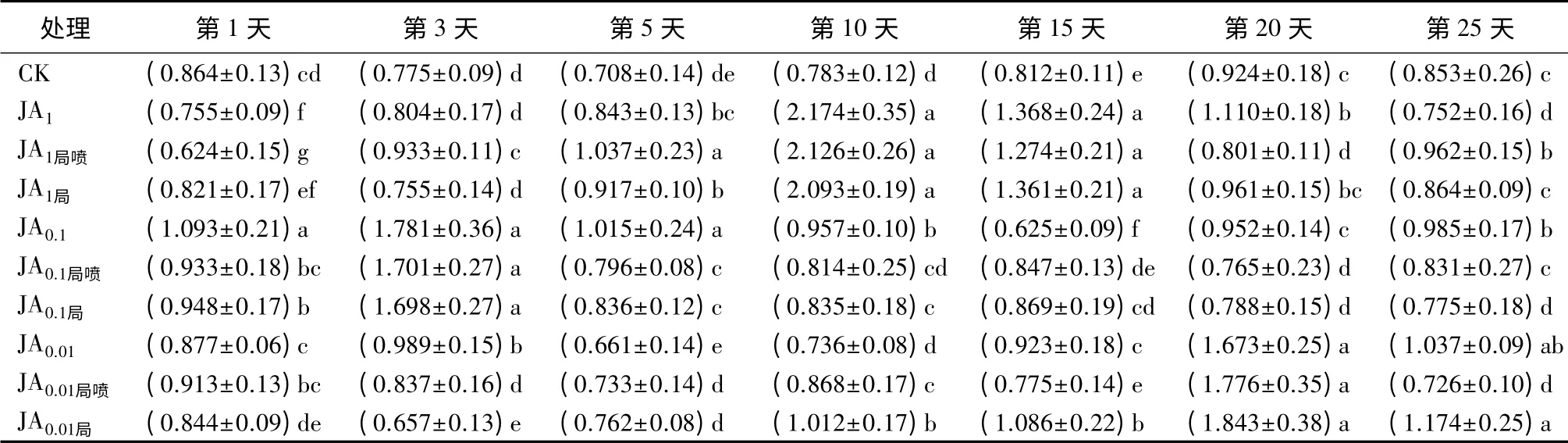
表4 茉莉酸诱导后长白落叶松针叶内PPO活性的时序变化 U·g-1
JA1局喷诱导的PPO活性在1、20 d显著低于JA1,而在3、5、25 d时则显著高于JA1(P<0.05);JA1局只在1、3 d显著低于JA1(P<0.05)。JA0.1局喷在1、5、10、20、25 d时显著低于JA0.1(P<0.05),而在3、15 d时显著高于JA0.1(P<0.05),或与JA0.1无显著差异;JA0.1局同样只在3、15 d时显著高于JA0.1(P<0.05),或与JA0.1无显著差异。在1、20 d时JA0.01全株和局部处理之间无显著差异;JA0.01在5、10 d显著低于JA0.01局喷和JA0.01局,在15 d时显著低于JA0.01局(P<0.05)(表4)。总之,用3种浓度茉莉酸局部喷施长白落叶松均可系统诱导PPO活性显著变化,诱导效果可持续25 d。
2.3 茉莉酸不同处理对长白落叶松针叶内蛋白酶抑制剂活性的影响
2.3.1 对TI活性的影响
用3个浓度茉莉酸全株喷施后,针叶内TI活性在3、5、15、20 d均显著高于CK,JA0.1在1、10、25 d同样显著高于CK(P<0.05);其中JA1诱导的TI活性,在5 d时活性最高,之后显著下降;JA0.1在第10天活性显著高于其他2个喷施浓度(P<0.05);JA0.01在20 d时显著高于其他2个喷施浓度(P<0.05)(表5)。
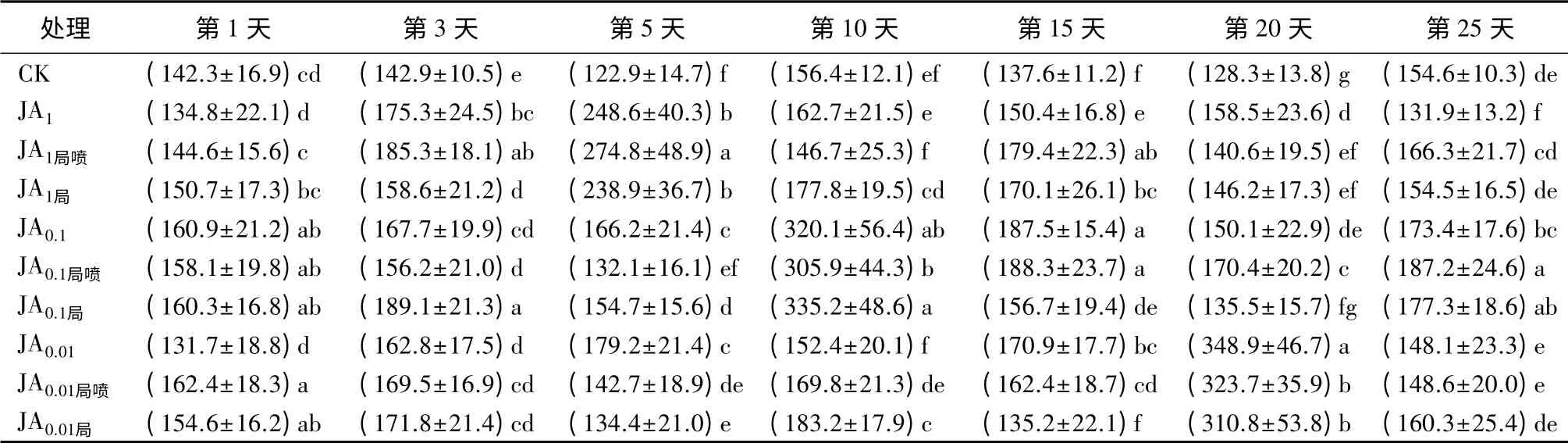
表5 茉莉酸诱导后长白落叶松针叶内TI活性的时序变化 U·g-1
JA局喷在3、15 d显著高于对照(P<0.05);JA1局喷在5 d时显著高于对照(P<0.05)且出现最大值;JA0.1局喷在1、10、20、25 d时同样显著高于CK(P<0.05),最大值则出现在第10天;JA0.01局喷则在1、5、10、20 d显著高于对照(P<0.05),最大值出现在第20天(表5)。局喷样株上未喷施JA的针叶内,3个浓度的JA局诱导的TI活性均显著高于对照,变化趋势与JA局喷相近(表5)。
用茉莉酸全株或局部处理后,3种不同处理方式针叶内TI活性的波动趋势相近,但波动幅度不同。用1 mmol·L-1茉莉酸处理后,JA1局喷只在10、20 d时显著低于JA1(P<0.05);JA1局则在3、20 d时显著低于JA1(P<0.05)。用0.1 mmol·L-1茉莉酸处理后,JA0.1局喷只在第5天显著低于JA0.1(P<0.05);JA0.1局在5、15、20 d时显著低于JA0.1(P<0.05)。用0.01 mmol·L-1茉莉酸处理后,JA0.01局喷在5、20 d显著低于JA0.01(P<0.05);JA0.01局在5、15、20 d显著低于JA0.01(P<0.05)(表5)。可见,用0.01 mmol·L-1茉莉酸局部喷施长白落叶松可系统诱导PPO活性显著增强,诱导效果可持续20 d。
2.3.2 对CI活性的影响
用3个浓度茉莉酸全株喷施后,JA1诱导的CI活性在1、3、15 d时显著高于CK(P<0.05),且1、3 d活性最高;JA0.1诱导的CI活性在3、5、10 d时显著高于CK(P<0.05),且在第5天出现最大值并显著高于其他2个处理组;JA0.01诱导的CI活性除第25天外均显著高于对照,且在10、15、20 d时均显著高于其他2个处理组(P<0.05),最大值出现在第15天(表6)。
JA局喷15 d时,3个浓度均显著高于对照(P<0.05);JA1局喷除3、10 d外显著高于对照或与对照无显著差异,第1天时出现最大值,且显著高于其他2个处理组(P<0.05);JA0.1局喷仅在第10天时显著低于对照(P<0.05),在第5天时出现最大值,且显著高于其他2个处理组(P<0.05);JA0.01局喷只在第1天时显著低于对照,在10、15、20 d时显著高于其他2个处理组(P<0.05),最大值出现在第15天(表6)。局喷样株上未喷施JA的针叶内,除10 d的JA0.1局和15 d的JA1局外,3个浓度的JA局诱导的CI活性均显著高于对照或与对照无显著差异(表6)。
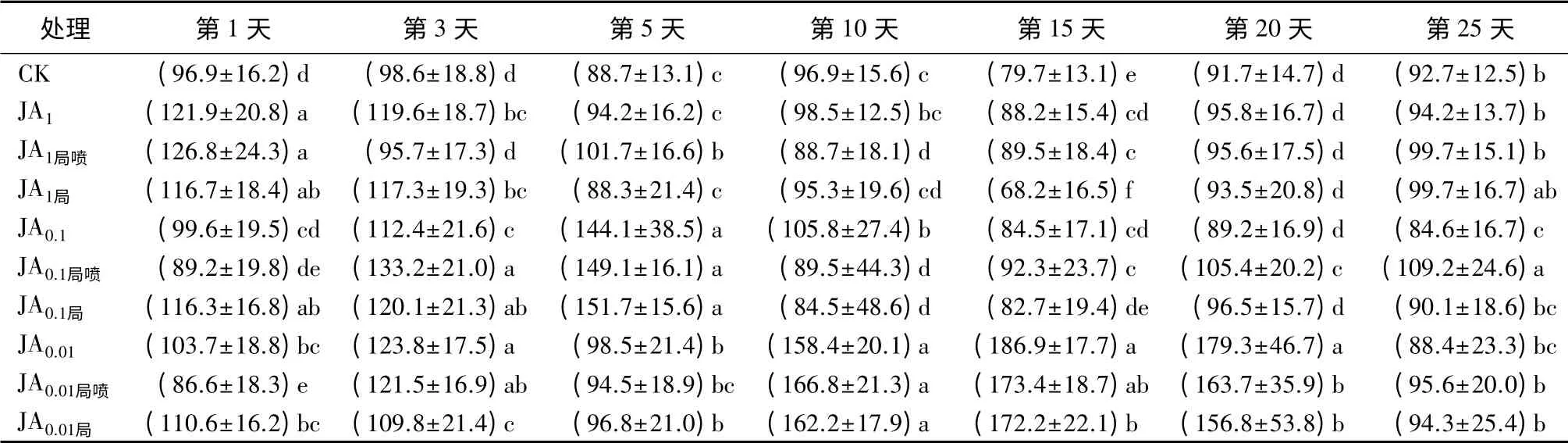
表6 茉莉酸诱导后长白落叶松针叶内CI活性的时序变化 U·g-1
用1 mmol·L-1茉莉酸处理后,3个处理组针叶内CI活性在1、20、25 d无显著差异;JA1在3、10 d时显著高于JA1局喷,在15 d时显著高于JA1局(P<0.05)。用0.1 mmol·L-1茉莉酸后,JA0.1只在第10天时显著高于JA0.1局喷和JA0.1局(P<0.05)。用0.01 mmol·L-1茉莉酸处理后,3个处理组针叶内CI活性在5、10、25 d时无显著差异;JA0.01在1、25天显著高于JA0.01局喷,在3、15、20 d显著高于JA0.01局(P<0.05)(表6)。可见,用0.01 mmol·L-1茉莉酸局部喷施长白落叶松可系统诱导CI活性显著增强,诱导效果可持续20 d。
3 结论与讨论
茉莉酸信号能在植物的不同部位之间转移,从而诱导调控植物的系统化学防御。用外源茉莉酸局部喷施长白落叶松,可以系统诱导增强其防御蛋白的活性,且诱导效果与全株处理的诱导效果相近。其他研究报道,外源茉莉酸可诱导枸杞、青杨叶内防御蛋白酶活性显著增加[7,9],能系统性增强玉米叶片的化学防御水平[16],与本研究结果一致。
长白落叶松对茉莉酸诱导存在浓度依赖性,高浓度茉莉酸能快速诱导长白落叶松产生较强的化学防御能力,但其持效时间短于低浓度茉莉酸诱导效果。杨世勇等[17]研究发现,1.00 mmol·L-1茉莉酸能显著诱导棉花叶片POD、PPO、PAL活性显著升高,且诱导效果优于0.10和10.00 mmol·L-1。0.10 mmol·L-1茉莉酸处理后48 h玉米叶片总酚含量明显高于0.01、0.05、0.20 mmol·L-1浓度处理[18]。本研究结果显示,0.10、1.00 mmol·L-1高浓度茉莉酸在1~10 d内即可诱导长白落叶松产生较强的诱导抗性,而在15~25 d时其诱导的抗性强度显著低于0.01 mmol·L-1浓度的诱导效果。说明长白落叶松的防御应答能力受资源供给的制约,可能是因为在15~25 d时高浓度茉莉酸诱导超出长白落叶松的应答阈值和资源供给。
局部喷施茉莉酸能诱导长白落叶松产生系统化学防御,达到全株喷施效果,在实际生产应用中能够降低成本,减少工作量,且便于操作,对生态安全地防控害虫具有重要实践意义。建议在实际应用中可根据害虫的生物学特性,选用0.10或0.01 mmol·L-1浓度的茉莉酸诱导液。茉莉酸局部诱导对其他针叶树种是否有相似的效果?还有待于进一步研究。
[1]娄永根,程家安,植物的诱导抗虫性[J].昆虫学报,1997,40(3):320-331.
[2]Agrawal A A,Laforsch C,Tollnan R.Transgenerational induction of defenses in animals and plants[J].Narure,1999,401:60-63.
[3]Agrawal A A.Induced responses to herbivory and increased plant performance[J].Science,1998,279:1201-1202.
[4]Odjakova M,Hadjiivanova C.The complexity of pathogen defense in plants[J].Bulg JPlant Physiol,2001,27(1/2):101-109.
[5]Browse J,Howe G A.New weapons and a rapid response against insect attack[J].Plant Phyisoligy,2008,146(3):832-838.
[6]Thaler J S.Induced resistance in agricultural crops:Effects of jasmonic acid on herbivory and yield of tomato plants[J].Environmental Entomology,1999,28(1):30-37.
[7]段文昌,段立清,李海平,等.外源茉莉酸及枸杞瘿螨危害诱导的枸杞防御反应[J].昆虫学报,2012,55(7):804-809.
[8]杨世勇,王蒙蒙,谢建春.茉莉酸对棉花单宁含量和抗虫相关酶活性的诱导效应[J].生态学报,2013,33(5):1615-1625.
[9]越慧芳,段立清,李海平,等.外源茉莉酸诱导的青杨叶片保护性酶活性变化及其对舞毒蛾幼虫生长发育的影响[J].昆虫学报,2013,56(3):270-275.
[10]赵振平.舞毒蛾的生物学特性及无公害防治技术[J].安徽农学通报,2009,15(10):171-172.
[11]孟昭军.外源茉莉酸类化合物对两种落叶松的诱导抗虫性研究[D].哈尔滨:东北林业大学,2008.
[12]王晶英,敖红,张杰.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003:169-180.
[13]徐伟.兴安落叶松诱导抗虫性研究[D].哈尔滨:东北林业大学,2006.
[14]Zong Na,Wang Chenzhu.Larval feeding induced defensive responses in tobacco:comparison of two sibling species of Helicoverpa with different diet breadths[J].Planta,2007,226(1):215-224.
[15]Felton G W,Donato K K,Broadway R M,et al.Impact of oxidized plant phenolics on the nutritional quality of dietary protein to a noctuid herbivore,Spodoptera exigua[J].Journal of Insect Physiology,1992,38(4):277-285.
[16]Feng Yuanjiao,Wang Jianwu,Luo Shiming,et al.Costs of jasmonic acid induced defense in aboveground and belowground parts of corn(Zea mays L.)[J].J Chem Ecol,2012,38:984-991.
[17]杨世勇,宋芬芳,谢建春.茉莉酸诱导棉花幼苗抗虫性对棉铃虫相对生长率的影响[J].西北农林科技大学学报:自然科学版,2013,41(5):66-74.
[18]冯远娇,王建武,骆世明.外源茉莉酸处理地下部对玉米化学防御反应影响的时间和浓度效应[J].应用生态学报,2009,20(8):1883-1890.

