葡萄皮渣中原花青素对临床常见分离菌的抗菌效应分析*
方 莉,王 静,许 媛,蔡 燕,廖 涛,唐 中△
(1.川北医学院附属医院检验科,四川南充637000;2.川北医学院医学检验系,四川南充637000)
原花青素(procyanidins,PC)是植物中广泛存在的一类多酚化合物的总称,由不同数量的儿茶素或表儿茶素结合而成[1]。原花青素在葡萄籽和松树皮中含量较高,能够有效清除体内自由基,具有抗氧化活性、抗辐射、抗癌、减轻过敏反应、改善视力、预防心脑血管疾病等多种生理活性。单静敏等[2]研究还显示原花青素对细菌有抑菌和杀菌作用。开发和研制天然植物药,是目前医药和食品研究中的一个重点。我国是葡萄生产大国,作为PC 的来源,PC 提取物得到了深入和广泛的关注[3]。
大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌是临床常见的致病革兰阴性杆菌,金黄色葡萄球菌是临床上最常分离的致病革兰阳性球菌,由于抗菌药物的滥用,耐甲氧西林金黄色葡萄球菌(methicillin-resistant Saureus,MRSA)的检出率不断上升,MRSA 除对β-内酰胺类抗菌药物在内的多种抗菌药物耐药外,甚至发现有对万古霉素耐药的菌株。近年来,MRSA 以其高致病性和越发严重的多重耐药性成为人类健康的巨大威胁,已引起广泛重视[4]。当今细菌耐药的步伐已远远超过了新药的研制的速度,及时准确地掌握病原菌耐药性的动态对指导临床合理使用抗菌药物、控制和延缓病原菌耐药性传播具有重要的意义,本实验拟了解葡萄皮渣中的PC 对临床常见分离菌的抑菌效果,旨在从医药治疗感染方面提供新的切入点。
1 材料与方法
1.1 材料
1.1.1 菌株 选择川北医学院附属医院检验科住院患者临床送检标本中分离的菌株,并经梅里埃全自动细菌鉴定分析仪鉴定的大肠杆菌30 株、铜绿假单胞菌28 株、鲍曼不动杆菌15株、屎肠球菌32株、粪肠球菌25株、MRSA 70株;质控菌株为金黄色葡萄球菌ATCC25923。
1.1.2 仪器、试剂及培养基
1.1.2.1 仪器实时荧光定量PCR仪(ROCHE Lightcycler480Ⅱ)、法国梅里埃全自动细菌鉴定及药敏分析仪、生物安全柜、电热恒温培养箱、高压灭菌锅。
1.1.2.2 试剂 MRSA 耐药基因检测试剂盒、梅里埃GP、GN 细菌鉴定卡、GPS药敏卡;PC(用来源于河北昌黎县凤凰酒庄的酿酒葡萄皮渣提取,采用60%乙醇溶剂浸提法提取,紫外分光光度计测定、pH 值示差法计算提取率,DA-201型大孔吸附树脂纯化);二甲基亚砜(DMSO);MH 琼脂(杭州天和生物制剂有限公司);血平板(重庆庞通公司)。
1.2 方法
1.2.1 菌株最低抑菌浓度(MIC)值的测定
1.2.1.1 菌液制备 将待测细菌接种于血平板上,置电热恒温培养箱中(35±1)℃培养18~24h,次日挑取单菌落用生理盐水将各株细菌浓度调整为0.5 麦氏单位(约1×108CFU/mL)。
1.2.1.2 PC的稀释将PC用DMSO配制成浓度为160、140、120、100、80、60mg/mL 梯度,实验时各终浓度分别为8、7、6、5、4、3mg/mL。
1.2.1.3 培养基制备 将已稀释的不同浓度的PC 按1∶20分别加入经高压灭菌并在45~50 ℃水浴中平衡的MH 琼脂中,充分混匀倾倒灭菌平皿,琼脂厚度约4mm,PC的最终浓度分别为3、4、5、6、7、8mg/mL。再制备不含PC与DMSO,以及仅含DMSO 的MH 琼脂平板接种细菌作阳性对照,不含药也不接种细菌的MH 琼脂平板作阴性对照。
1.2.1.4 接种方法 将浓度为0.5 麦氏单位的菌悬液,按1∶10稀释,吸取稀释后的菌悬液约2μL接种于含药和不含药的MH 琼脂平板表面,直径为5~8mm 的菌斑。
1.2.1.5 培养细菌及观察 将接种好的平板置于(35±1)℃培养24h,MIC即为肉眼观察在平板表面的细菌生长完全被抑制时的最低抗菌药物浓度。
1.2.2 PCR法检测MRSA 的mecA基因及nuc基因对经梅里埃全自动细菌鉴定分析仪鉴定的70株MRSA,按照上海之江生物科技提供的MRSA 耐药基因检测试剂盒说明书进行操作。PCR 反应条件:37 ℃2min;94 ℃2min;94 ℃15s,60℃60s,40个循环;单点检测荧光在60 ℃。荧光通道检测选择FAM 通道和HEX 通道。结果判断:mecA基因、nuc基因检测同时为阳性,判断为MRSA;mecA基因阴性、nuc基因阳性,判断为甲氧西林敏感型金黄色葡萄球菌(MSSA);mecA基因阳性、nuc基因阴性,判断为耐甲氧西林菌株(非金黄色葡萄球菌)。
1.2.3 MRSA 对16种抗菌药物的药敏试验 对经鉴定的70株MRSA 配制成0.5麦氏单位的浓度,按法国梅里埃药敏鉴定方法利用GPS药敏卡在梅里埃全自动细菌鉴定及药敏分析仪作葡萄球菌的药敏分析。
1.3 统计学处理 采用SPSS16.0软件分析试验结果,计数资料以率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 PC对革兰阴性菌的抑菌作用 用浓度分别为3、4、5、6、7、8mg/mL的PC 处理后,30株大肠杆菌、28株铜绿假单胞菌、15株鲍曼不动杆菌的生长均未受到抑制,3~8mg/mL 的PC对大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌无抑菌作用。
2.2 PC对革兰阳性菌的抑菌作用
2.2.1 PC对肠球菌的抗菌效应 32株屎肠球菌在PC 3mg/mL浓度中全部生长,无抑菌效果;在浓度为4~8mg/mL PC的培养基中有2株屎肠球菌的生长被完全抑制,此浓度下对屎肠球菌的抑菌率为6.3%。25株粪肠球菌在3~8mg/mL 的PC中全部生长,PC对粪肠球菌无抑菌作用。
2.2.2 PC对MRSA 的抗菌效应
2.2.2.1 实时荧光PCR 检测临床分离的MRSA 菌株 PCR检测临床分离的70株MRSA 菌株,检测结果显示mecA基因、nuc基因均为阳性。说明梅里埃细菌鉴定分析仪与实时荧光PCR 法检测MRSA 菌株的结果符合率为100%,见表1。

表1 实时荧光PCR 法检测70株MRSA 菌株中mecA 基因、nuc基因的检测结果
2.2.2.2 MRSA 对16种抗菌药物的耐药情况 70株MRSA对β-内酰胺类抗菌药物苯唑西林、苄青霉素的耐药率为100%;对喹诺酮类环丙沙星、左氧氟沙星、莫西沙星,林可酰胺类克林霉素,大环内酯类红霉素,氨基糖苷类庆大霉素、四环素、利福平耐药率均大于60%;而对甘氨酰环素类替加环素、人工合成的唑烷酮类利奈唑胺,链阳菌素类喹奴普汀/达福普汀和万古霉素全部敏感,见表2。

表2 70株MRSA 对16种抗菌药物的耐药情况
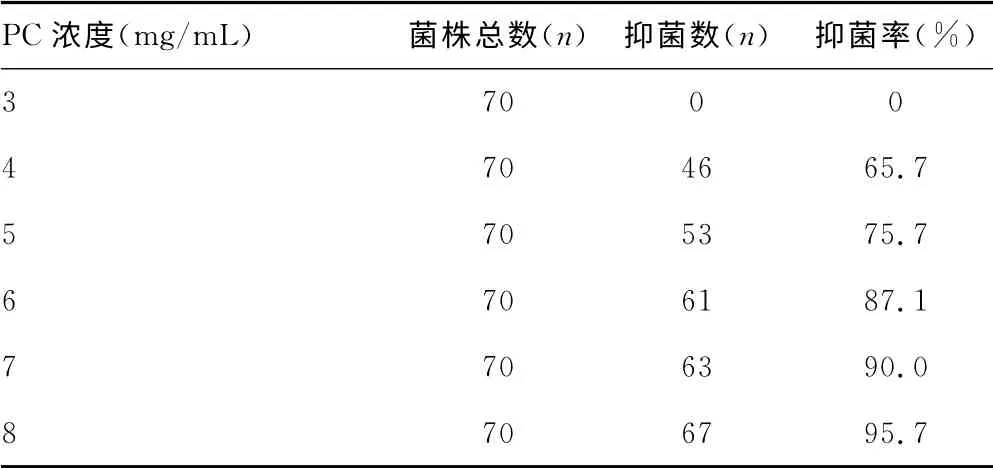
表3 PC对MRSA 的抑菌率
2.2.2.3 PC对MRSA 的抗菌效应 浓度为3~8mg/mL 的PC 对70株MRSA 菌株的抑菌效果见表3。其中67株MRSA的MIC值为4~8mg/mL,MIC50为4.221mg/mL、MIC90为6.260mg/mL。MRSA 在阴、阳性对照平板及PC 中生长情况见图1。

图1 各组平板MRSA 的生长情况
3 讨 论
本研究显示,葡萄皮渣中PC对常见革兰阴性杆菌如大肠杆菌、铜绿假单胞菌及鲍曼不动杆菌无抑菌作用,当PC 浓度达8mg/mL时,其生长率均为100%;对革兰阳性球菌如MRSA、肠球菌有一定的抑菌效果,特别是对MRSA 抑菌作用明显,当PC浓度为4mg/mL 时,MRSA的抑菌率为65.7%,5 mg/mL抑菌率为75.7%,6 mg/mL 抑菌率为87.1%,7mg/mL抑菌率为90.0%,8mg/mL 抑菌率为95.7%。分析70株MRSA 对16 种抗菌药物的药物敏感情况显示:MRSA除了对所有β-内酰胺类抗菌药物耐药外,对喹诺酮类、林可酰胺类、大环内酯类、四环素类抗菌药物耐药率明显高于其他抗菌药物;对甘氨酰环素类、人工合成的唑烷酮类、链阳菌素类药物均敏感,对广泛使用的万古霉素也都敏感。但近年来,我国MRSA 感染率日渐增加,MRSA 检出率也逐渐增高。武成彪[5]研究显示,MRSA 分离率占金黄色葡萄球菌的71.6%。随着万古霉素的广泛应用,耐万古霉素金黄色葡萄球菌(VRSA)和万古霉素中介金黄色葡萄球菌(VISA)已出现[6]。由于MRSA 的多重耐药性,对其用药的原则应根据临床结合药敏结果进行用药,谨慎使用头孢菌素类抗菌药物,尽量不用或少用广谱抗菌药物;此外,在积极预防和控制医院感染的同时,还应从其耐药机制等多方面研制抗菌药物,以对抗万古霉素耐药的MRSA。
天然植物提取物PC资源丰富,毒副作用轻微,不致癌、无抗原性,具有抗氧化活性,抗辐射、抗癌、预防心脑血管疾病等多种生理活性,已被临床广泛应用并有一定疗效。PC 的抗菌机制仍不十分清楚,有研究表明其对细菌的增殖产生抑制作用,其抑制作用可能通过抑制细菌代谢所需要的酶类,而对细菌没有直接杀灭作用[7]。PC 中的多酚成分有一定的疏水性,通过降低细胞膜的稳定性与细菌的细胞壁和脂多糖接口进行交互,阻止细胞壁的合成从而杀灭细菌[8]。有研究通过扫描电子显微镜观察到,表面光滑的MRSA 细胞经过PC 处理后,表面变粗糙,细胞个体变肿大,内容物相对减少,说明其对细胞膜和细胞壁有破坏作用[9]。本研究证实PC 对肠球菌有一定药效,对MRSA 抑菌效果明显,而对革兰阴性菌无抑制作用,说明PC可作为一种潜在的新药对抗革兰阳性球菌。特别是对MRSA 的明显抑菌效果,可为临床治疗感染MRSA 患者提供新的方向。本研究仅做了体外药物抗菌研究,还需进一步进行体内动物实验验证,关于其确切机制有待深入的研究和探讨。
[1] 周坦洋,罗芙蓉,白彬.葡萄籽原花青素生物药理活性的研究进展[J].哈尔滨医科大学学报,2012,46(1):94-96.
[2] 单静敏,曹雁平,肖俊松,等.葡萄籽和苹果原花青素对变形链球菌和金黄色葡萄球菌的抑制作用[J].食品科学,2011,32(17):123-127.
[3] 毕玲,傅柏平.葡萄籽原花青素提取物的研究进展[J].中国新药杂志,2008,17(17):1478-1481.
[4] 刘敏,刘井波,张正.MRSA 分子演化和致病因子研究进展[J].中国实验诊断学,2009,13(11):1654-1658.
[5] 武成彪.耐甲氧西林金黄色葡萄球菌医院感染现状及耐药性分析[J].疾病监测与控制,2010,4(11):677-678.
[6] Sievert DM,Rudrik JT,Patel JB,et al.Vancomycin-resistant Staphylococcus aureus in the United States,2002-2006[J].Clin Infect Dis,2008,46(5):668-674.
[7] 刘学军,姜新亚,张玲玲.葡萄籽原花青素对粘性放线菌影响的实验研究[J].实用口腔医学杂志,2011,27(6):761-764.
[8] Shrestha B,Theerathavaj ML,Thaweboon S,et al.In vitro antimicrobial effects of grape seed extract on peri-implantitis microflora in craniofacial implants[J].Asian Pac J Trop Biomed,2012,2(10):822-825.
[9] Al-Habib A,Al-Saleh E,Safer AM,et al.Bactericidal effect of grape seed extract on methicillin-resistant Staphylococcus aureus(MRSA)[J].J Toxicol Sci,2010,35(3):357-364.

