猪伪狂犬病病毒和猪圆环病毒2型多重PCR检测方法的建立与初步应用
郭晓秋,曲哲会,刘 涛(信阳农林学院动物科学系,河南信阳464000)
猪伪狂犬病病毒和猪圆环病毒2型多重PCR检测方法的建立与初步应用
郭晓秋,曲哲会,刘涛
(信阳农林学院动物科学系,河南信阳464000)
摘要:为了建立可同时检测猪伪狂犬病病毒(PRV)和猪圆环病毒2型(PCV-2)的多重PCR检测方法,本研究根据GenBank中登录的PRV gE基因和PCV-2 ORF2基因的核苷酸序列,分别设计了2对特异性引物PRV-S/PRV-A和PCV-2-S/PCV-2-A,产物分别为270 bp和189 bp。检测结果显示,该方法具有较高特异性,检测PRV和PCV-2的DNA最低量均为1×10-4μg/μL。对136份临床上疑似为PRV和PCV-2感染病料样品进行检测的结果表明,本研究建立的多重PCR检测方法可用于临床上PRV和PCV-2引起的单纯或混合感染的传染病病原学诊断。
关键词:猪伪狂犬病病毒;猪圆环病毒2型;多重PCR
猪伪狂犬病(PR)是由猪伪狂犬病病毒(Pseu⁃dorabies virus,PRV)引起的一种急性传染病,临床上以妊娠期母猪感染后引起流产、死胎及木乃伊胎,仔猪感染后出现神经症状为主要特征,且病死率可达100%。猪圆环病毒病(Porcine circovirus diseases,PCVD)是指由圆环病毒2型(PCV-2)为主要病原、单纯或继发(或混合)感染其他致病微生物而引起的一系列综合征的总称。PCV-2是引起仔猪断奶后多系统衰竭综合征(PMWS)和母猪繁殖障碍、断奶和育肥猪的呼吸道疾病,猪皮炎和肾病综合征(PDNS)以及猪的先天性震颤的主要病原。近年来,PR和PCVD已经成为威胁我国养猪业最主要的传染病之一,不仅导致饲料转化率降低,生长缓慢,而且由PR和PCV-2引起的混合感染或继发感染其他猪病的暴发与流行,造成治疗费用增加,严重者可引起大批猪只死亡,给养猪业带来了空前巨大的经济损失,严重制约了养猪业的持续健康发展。
由于常规的病原学和血清学诊断方法存在操作繁杂,耗时长,灵敏度低等不足,难以用于混合感染时两种疾病的早期快速诊断。而多重PCR技术可对多个目的基因同时进行扩增的诊断方法,具有快速、敏感、高效、易于操作等优点,已广泛用于多种疫病的实验室诊断中。基于以上原因,本研究依据PRV和PCV-2保守基因序列,设计并合成了2对特异性引物,建立了可以同时检测PRV和PCV-2的多重PCR检测方法,通过初步临床应用,可完全满足临床上由PRV和PCV-2引起的单纯或混合感染的准确诊断。
1 材料与方法
1.1病毒株与病料猪伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV-2)、猪圆环病毒1型(PCV-1)、猪瘟病毒(CSFV)、猪细小病毒(PPV)和猪繁殖与呼吸综合征病毒(PRRSV)均为北京世纪元亨动物防疫技术有限公司的PCR检测试剂盒阳性对照。136份疑似为PRV和PCV-2感染的病料(包括有血清、淋巴结、肺脏、脾脏和脑组织)为2012-2013年期间信阳农林学院动物疫病检测实验室收集保存。
1.2主要试剂细胞/组织基因DNA提取试剂盒(离心柱型)和Gen Clean琼脂糖凝胶DNA回收试剂盒(离心柱型),购自上海捷瑞生物工程有限公司;2×Power Taq PCR MasterMix和DNA Marker DL-2 000,购自百泰克生物技术(北京)有限公司;琼脂糖为BBI公司生产;其他试剂均为国产分析纯。
1.3引物设计利用DNAMAN软件分别对GenBank 中12株PRV和12株PCV-2基因序列进行同源性比较,分别选择PRV gE基因和PCV-2的ORF2基因保守区域,利用生物软件Primer 5.0设计2对引物,具体序列如下,PRS:5′-ATGGGCATCGGCGACTACCT-3′;PRV-A:5′-GCGAGAAGAGCTGGGAGTGGA-3′;PCV-2-S:5′-GTTATGGTATGGCGGGAGG-3′;PCV-2-A:5′-CCGCTGTGCCCTTTGA-3′,预计PRV扩增片段为270 bp,PCV-2扩增片段为189 bp。引物由上海生工生物工程技术服务有限公司合成。

表1 PCR检测引物序列
1.4病料样品的处理及基因组DNA的提取选择发病动物血清、肺脏、脾脏、淋巴结和流产胎儿为检测样品,具体处理方法参照文献[1]。参照组织/细胞基因组DNA提取试剂盒(离心柱型)使用说明书提取病料中的基因组DNA。
1.5单项PCR反应PCR反应体系(25 μL):PCR反应液12.5 μL、DNA模板3 μL、PRV-S(10 μmol/L)/PRV-A(10 μmol/L)(或PCV-2-S/PCV-2-A)各0.75 μL、加无菌去离子水至25 μL。PCR反应程序:95℃5 min,95℃30 s、55℃30 s、72℃ 30 s、共35个循环,72℃7 min。PCR产物经1%琼脂糖凝胶电泳后,紫外灯下观察结果。
1.6PRV和PCV-2的多重PCR检测按照单项PCR反应体系,其中引物PRV-S、PRV-A(10 μmol/L)、PCV-2-S(10 μmol/L)、PCV-2-A(10 μmol/L)各0.75 μL。反应条件同单项PCR反应。分别对PRV阳性对照、PCV-2阳性对照以及PRV和PCV-2混合物进行检测。
1.7特异性试验利用该多重PCR检测方法同时对CSFV、PRRSV、PCV-1和PPV进行检测,以PRV和PCV-2混合物作为阳性对照,以确定该方法的特异性。
1.8敏感性试验利用微量分光光度计分别对提取的PRV和PCV-2阳性对照DNA进行含量测定,然后稀释、混合成浓度均为1 μg/μL,按照10倍进行倍比稀释,利用该多重PCR检测方法对DNA含量依次为1 μg/μL~1×10-6μg/μL进行检测,以确定该方法的敏感性。
1.9初步临床应用按照步骤1.4将2012-2013年收集的136份疑似PRV或PCV-2感染病料进行处理,按照该多重PCR检测方法进行检测,同时以PRV和PCV-2的单项PCR检测方法和商品试剂盒进行检测,将检测结果进行比较、分析,以确定该方法的临床应用效果。
2 结果
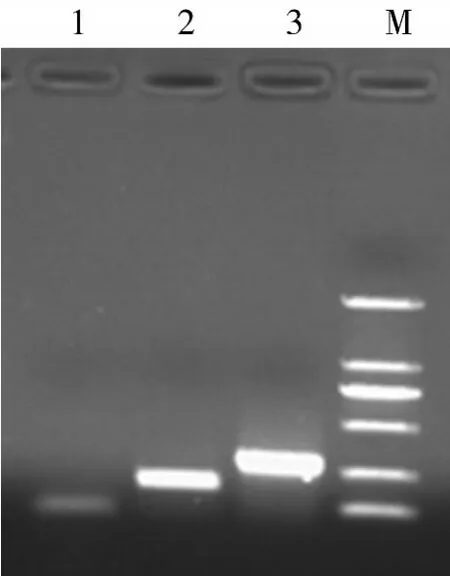
图1 单项PCR分别检测PRV和PCV- 2结果
2.1单项PCR检测PRV和PCV-2结果如图1所示,以提取PRV阳性对照的DNA为模板,以引物PRV-S/PRV-A为检测引物进行PCR扩增,结果显示,扩增出特异的270 bp的条带,经过序列测定,与AP207700、AY170318和AY249861的同源性分别为98.15%、99.22%和98.81%。以提取PCV-2阳性对照的DNA为模板,以引物PCV-S/PCV-A为检测引物进行PCR扩增,结果显示,扩增出特异的189 bp的条带,经过序列测定,与AF027217、AY641542和GU124593同源性分别为97.77%、98.24%和97.93%。
2.2多重PCR检测PRV和PCV-2结果如图2所示,以提取的PRV和PCV-2混合物DNA为模板,以及分别提取PRV和PCV-2的DNA为模板,利用引物PRV-S/PRV-A和PCV-2-S/PCV-2-A混合物进行多重PCR检测,分别出现了与预计相符(270 bp和189 bp)的特异片段,2种病毒混合物检测后,同时出现了大小差异明显的270 bp和189 bp片段。
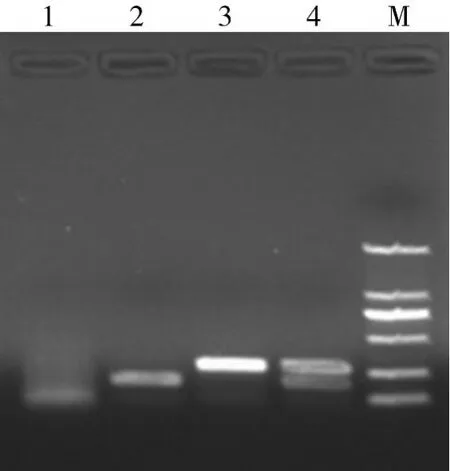
图2 多重PCR检测PRV、PCV- 2及混合物结果
2.3特异性试验结果结果如图3所示,PRV和PCV-2的DNA混合物,经多重PCR检测,出现了270 bp和189 bp特异2条目的片段,而CSFV和PRRSV的RNA反转录产物、PPV和PCV-1的DNA为模板,多重PCR检测结果均为阴性。说明PRV和PCV-2的多重PCR检测方法具有良好的特异性。
2.4敏感性试验结果利用微量分光光度计,将分别提取的PRV和PCV-2的DNA进行含量测定,然后稀释、混合成总浓度均为1 μg/μL,并进行10倍稀释,依次为1×10-1μg/μL、1×10-2μg/μL、1×10-3μg/μL、1× 10-4μg/μL、1×10-5μg/μL,分别进行多重PCR检测。结果如图4所示,PRV和PCV-2的DNA最小检测量均为1×10-4μg/μL。
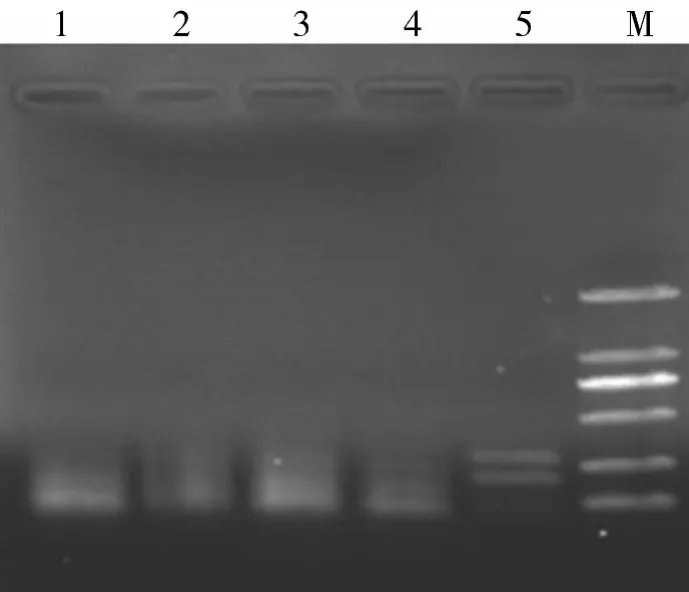
图3 多重PCR检测方法的特异性试验结果
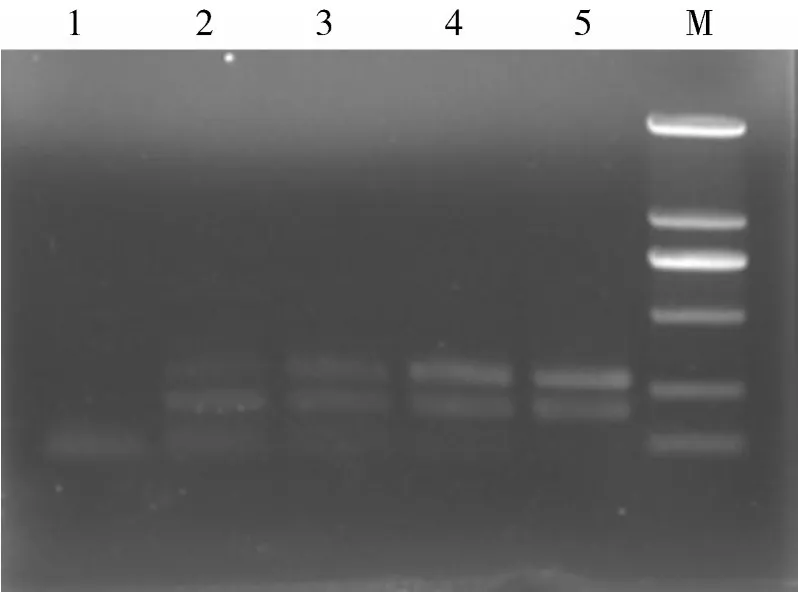
图4 多重PCR检测方法的敏感性试验结果

表2 136份临床病料多重PCR、单项PCR及商品试剂盒检测结果的比较
2.5多重PCR检测方法对临床病料检测结果分别利用多重PCR检测方法,PRV和PCV-2的单项PCR检测方法以及PRV和PCV-2商品试剂盒对136份临床疑似PRV和PCV-2单纯或混合感染的病料进行检测,具体结果见表2,PRV和PCV-2多重PCR检测结果与单项结果符合率为100%,PRV和PCV-2多重PCR检测结果与PRV和PCV-2商品试剂盒检测结果比较来看,PCV-2单纯感染检测结果符合率为100%,PRV单纯感染检测结果符合率为95.92%,PRV和PCV-2混合感染检测结果符合率为96.00%。说明本研究建立的PRV和PCV-2多重PCR检测结果完全可以满足临床诊断的要求。
3 讨论
随着分子生物学的不断发展,PCR检测方法以其灵敏性高、特异性强、操作时间短等特点,已经广泛应用于动物传染病病原体检测方面[2-4]。但由于临床经常出现多病原的混合感染的病例,因此研究快速而灵敏地鉴别诊断多种病原体的诊断方法尤为重要。多重PCR技术可对在同一体系中的多个目的基因进行扩增的,不仅具有单项PCR方法的快速、敏感、高效、易于操作等优点,而且对临床混合感染的鉴别诊断尤为有效,并且与单项PCR相比,大大节省诊断试剂费用和操作时间[5]。本研究建立的PRV和PCV-2的多重PCR检测方法,通过特异性、敏感性和初步临床应用来看,可以特异、准确地检测PRV和PCV-2的DNA,PCR产物分别为270 bp和189 bp,通过与Marker DL-2 000比较,可明显分别位于250 bp的上下,最低可以检测到DNA量均为1× 10-4μg/μL,通过对临床采集136份病料检测,PRV 和PCV-2多重PCR检测结果与单项结果及PRV和PCV-2商品试剂盒检测结果比较来看,该方法完全可以满足临床病原体诊断的要求。
PCR检测方法的准确性与目的基因的选择及引物设计有很大关系,本研究选择了PRV的gE基因和PCV-2的ORF2基因作为参考基因。虽然目前已有PRV的PCR检测方法的建立,但引物设计大多选择gB基因、gD基因和TK基因等保守部分[5-7],无法避免疫苗毒的干扰造成结果假阳性问题。本研究选择gE基因是PRV的主要毒力因子,作用在于能降低PRV对猪神经系统的侵袭能力,而且是PRV复制所必需的,而且目前国内使用的PRV弱毒疫苗至少为gE基因缺失苗,所以利用gE基因序列作为参考基因,选择保守区域设计合成的引物,建立的PCR检测方法完全解决了疫苗毒对检测结果的干扰问题。PCV有PCV-1和PCV-2 2个血清型。PCV-1在猪体内普遍存在,无致病性,PCV-2具有致病性,是引起PMWS、PDNS以及猪的先天性震颤等混合感染的主要病原。PCV-1和PCV-2的基因同源性较高,如果引物设计不当,容易造成误检,所以本研究比较GenBank中多个PCV-1和PCV-2的基因序列同源性,设计了特异检测引物PCV-2-S/PCV-2-A,经特异性试验表明,可以鉴别PCV-1和PCV-2。
参考文献:
[1]贾资,张素芳,周斌,等.猪瘟和猪繁殖与呼吸综合征混合感染的快速检测及地域流行性分析[J].中国病毒学,2004,19 (5):514-5l6.
[2]贾赟,芦银华,张素芳,等.猪圆环病毒2型、猪繁殖与呼吸综合征病毒及猪细小病毒混合感染的流行病学调查[J].中国病毒学,2004,19(5):467-470.
[3] Junghyun K,Chanhee C . A comparison of virus isolation,poly⁃merase chain reaction,immunohistochemistry,and in situ hybrid⁃ization for the detection of porcine circovirus 2 and porcine parvo⁃virus in experimentally and naturally coinfected pigs [J].J Vet Di⁃agn Invest,2004,16:45-50.
[4] Henegariu O,Heerema N,Dlouhy S,et al.Multiplex PCR:Criti⁃cal parameters and step- by- step protocol[J] . Biotechniques,1997,23(3):504-511.
[5]陈光达,许信刚,童德文.PCV-2、PPV和PRV多重PCR检测方法的建立及初步应用[J].西北农林科技大学学报(自然科学版),2011,39(11):1-6.
[6]程亮亮,祁克宗,占松鹤,等.高致病性猪繁殖与呼吸综合征病毒和伪狂犬病病毒双重PCR检测方法的建立及初步应用[J].动物医学进展,2013,3(10):85-88.
[7]申世川,王一成,姜平,等.猪主要DNA病毒多重二温式PCR检测方法的建立及初步应用[J].畜牧与兽医,2012,44(2):60-64.
Thedevelopment and preliminary application of multiplex PCR for detection of PRV and PCV- 2
GUO Xiao-qiu,QU Zhe-hui,LIU Tao
(Department of Animal Science,Xingyang College of Agriculture and Forestry,Xinyang 464000,China)
Abstract:To establish the assay for detections of pseudorabies virus(PRV)and Porcine circovirus type 2(PCV-2),a multi⁃plex RT-PCR was developed with two pair specific primers of PRV-S/PRV-A and PCV-2-S/PCV-2-A designed for detecting PRV and PCV-2 based on the gE gene and ORF2 gene sequences in GenBank respectively.The results showed that the assay was able to detect PRV and PCV-2 simultaneously by amplifying DNA fragments of 270 bp and 189 bp,respectively.The sensitivity of the assay was 1×10-4μg/μL of DNA. Our result of the 136 tested clinical sample suggest that the Multiplex PCR detection meth⁃ods can be used to detect the PRV and PCV-2.
Key words:Pseudorabies Virus;Porcine circovirus type 2;Multiplex PCR Corresponding author:LIU Tao
通讯作者:刘涛,E-mail:decai178@163.com
作者简介:郭晓秋(1979-),女,讲师,硕士,主要从事动物营养与饲料的教学与科研工作,E-mail:guoxiaoqiu_1979@163.com
基金项目:信阳市科技攻关项目(20130017)
收稿日期:2014-03-30
中图分类号:S852.4
文献标志码:A
文章编号:0529- 6005(2015)10- 0034- 04

