Th17及CD4+CD25+调节性T细胞在急性白血病外周血中的表达及预后意义
杨占甲(河南省郑州人民医院输血科,河南郑州450000)
Th17及CD4+CD25+调节性T细胞在急性白血病外周血中的表达及预后意义
杨占甲
(河南省郑州人民医院输血科,河南郑州450000)
摘要:目的研究Th17细胞及CD4+CD25+Foxp3+调节性T细胞(Treg)在急性白血病(AL)外周血中的表达水平,并初步探讨其与疾病预后的关系。方法选取2011年6月-2013年6月在该院诊断为AL的40例患者为研究组,同时选取来该院体检的健康人群为对照组(40例),采用流式细胞术检测AL患者及正常体检者外周血中Th17细胞及CD4+CD25+Foxp3+细胞水平,采用酶联免疫吸附(ELISA)法检测两组外周血中IL-17和TGF-β水平;用逆转录-聚合酶链反应(RT-PCR)检测两组外周血中转录因子RORγT及Foxp3 mRNA水平。此外,该实验检测AL化疗后缓解的Th17及CD4+CD25+Foxp3+细胞及相关因子水平。结果研究组外周血中Th17(CD3+CD4+IL-17+)细胞比例为(1.51±0.27)%,显著高于对照组[(0.36±0.23)%],差异有统计学意义(t=20.51,P=0.000);研究组外周血中CD4+CD25+Foxp3+细胞比例为(3.37±0.48)%,显著高于对照组[(1.26± 0.27)%],差异有统计学意义(t=24.23,P=0.000)。研究组血清IL-17为(28.12±6.33)pg/ml,显著高于对照组[(14.41±6.21)pg/ml],差异有统计学意义(t=9.78,P=0.000);研究组血清TGF-β为(38.41±8.44)pg/ml,显著高于对照组[(24.49±7.42)pg/ml],差异有统计学意义(t=7.83,P=0.000)。研究组外周血中RORγT mRNA的表达显著高于对照组,差异有统计学意义(t =12.27,P=0.000);研究组外周血中Foxp3 mRNA的表达显著高于对照组,差异有统计学意义(t=7.89,P=0.000)。与化疗前比较,化疗6个月后研究组Th17细胞及CD4+CD25+Foxp3+细胞水平降低,血清IL-17以及TGF-β水平下降,差异有统计学意义(P<0.01)。结论AL患者的Th17细胞、CD4+CD25+Foxp3+细胞及其分泌蛋白IL-17、TGF-β和转录因子显著增加,定期检测外周血中Th17、Treg细胞及其分泌蛋白有助于对患者的免疫状态进行监测和预后评判。
关键词:Th17;调节性T细胞;IL-17;TGF-β;急性白血病
急性白血病(acute leukemia,AL)是临床上发病比较急骤的一种常见的严重血液性疾病,包括急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和急性非淋巴细胞白血病(acute nonlymphocyticl eukemia,ANLL)[1]。AL的临床表现多种多样,最为常见的是出血,出血部位可遍及全身,以口腔、鼻腔、皮下多见。血小板减少是出血的重要原因,而脑出血常常导致死亡。如果抢救不及时,很容易危及生命,因此对AL发病机制以及临床诊疗的研究至关重要。
CD4+T细胞是人体重要的免疫细胞,在抗原与抗原提呈细胞(antigen presenting cell,APC)存在时,可以主要分化为Th1、Th2、Th17和调节性T细胞(Treg)[1-4]。其中,Th17是一群在TCR通路和细胞因子IL-6及TGF-β刺激下分化的亚群[5];而Treg细胞则是一类调控机体免疫功能的细胞群,能维持免疫系统对自身成分的耐受,使机体保持免疫稳态,这类细胞表达Foxp3、CD25及CD4。经研究证实Th17 和Treg细胞的平衡在感染、肿瘤、器官移植、同种异体胎儿免疫等疾病方面,有抑制各种途径的病理生理免疫应答作用[6-10]。目前,对Th17及CD4+CD25+Foxp3+Treg细胞与AL的预后关系研究尚少,因此,本实验通过比较AL患者与正常体检者外周血中Th17、Treg细胞及分泌的因子水平,并同时检测化疗前后Th17、Treg细胞的变化,探讨其与疾病预后关系。
1 资料与方法
1.1临床资料
选择2012年8月-2014年8月在河南省郑州人民医院诊断为AL的患者40例为研究组。其中男性21例,女性19例;年龄32~58岁,平均(41.21± 12.13)岁;ANLL 25例,ALL 15例。经化疗完全缓解17例,男性6例,女性11例;年龄36~54岁,平均(45.26±9.24)岁。AL的诊断和疗效标准参考第2版《血液病诊断及疗效标准》。对照组40例来自本院健康体检者,无心、肝、肺、肾等重要脏器疾病,血常规及肝肾功能检查正常,其中男性23例,女性17例;年龄31~56岁,平均(43.12±11.25)岁。两组性别、年龄比较差异无统计学意义(P>0.05)。
1.2主要试剂
采用上海英骏公司Trizol试剂盒提取RNA,采用美国Femantes公司cDNA逆转录试剂盒对RNA进行逆转录,聚合酶链反应(polymerase chain reaction,PCR)试剂盒购于南京生兴生化科技有限公司,大鼠抗人CD3-APC、CD4-FITC、IL-17-PE、CD25-APC、FoxP3-PE流式抗体购自美国eBioscience公司,红细胞裂解液购自武汉博士德公司,破膜固定剂(Fix/Perm Cell Permeabilization Kit)购自美国Invitrogen公司,蛋白质转运抑制剂(Golgi Stop)购自BD公司,淋巴细胞培养用的不完全1640培养液、胎牛血清以及青霉素-链霉素(P-S双抗)等购自上海麦仓生物科技有限公司,使用前按照89∶10∶1比例配制成完全1640培养液。
1.3治疗
研究组化疗方案:①ANLL患者采用DA(柔红霉素+阿糖胞苷)或HA(高三尖杉酯碱+阿糖胞苷)方案;②ALL患者采用VCDP(长春新碱+环磷酰胺+柔红霉素+泼尼松)方案。
1.4方法
1.4.1Th17和Treg细胞流式染色两组患者在早晨空腹采集抗凝和不抗凝静脉血各2 ml,加入红细胞裂解液后,以完全1640培养液调节细胞浓度至1×106/ml。Th17细胞染色:离心并重悬于100μl PBS中,加入CD3-APC(0.2 mg/ml)和CD4-FITC (0.25 mg/ml)抗体,混匀后室温避光孵育40 min,PBS 洗1遍,加入破膜固定工作液1 ml后,4℃避光孵育40 min。离心后,重悬于100μl Permeabilization buffer中,加入IL-17-PE(0.25 mg/ml),4℃避光孵育30 min,PBS缓冲液洗1遍,以400μl缓冲液重悬细胞后用流式细胞仪(FACS Calibur,美国BD公司)检测。Treg细胞染色:离心并重悬于100μl PBS中,加入CD25-APC(0.25 mg/ml)和CD4-FITC(0.25 mg/ml)抗体,混匀后室温避光孵育40 min,PBS洗1遍,加入破膜固定工作液1 ml后4℃避光孵育40 min。离心后,重悬于100μl Permeabilization buffer中,加入2μl FC受体阻断剂,4℃避光孵育20 min,加入抗FoxP3-PE(0.15 mg/ml)抗体,置4℃避光孵育40 min,PBS缓冲液洗1遍,以400μl缓冲液重悬细胞后用流式细胞仪检测。
1.4.2检测血清IL-17及TGF-β浓度酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法检测血清IL-17及TGF-β浓度,所有试剂盒购自深圳达科为有限公司,检测流程严格按照试剂盒说明书进行操作。
1.4.3检测外周血中转录因子RORγT mRNA 和Foxp3 mRNA水平采用逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)法,外周血离心后提取上层血浆200μl,加入1 ml Trizol充分匀浆,按照说明书进行操作,所得RNA溶于20μl DEPC处理水。提取的总RNA经紫外分光光度计进行定量分析。然后采用Femantes逆转录试剂盒逆转录成cDNA,置于-20℃冰箱保存备用。本实验PCR反应条件:95℃预变性20 s,60℃变性20 s,70℃退火1 s,共40个循环。RORγT引物序列为:正向5'-GCAATGGAAGTGGTGCTGGTT-3',反向:5'-AGGATGCTTTGGCGATGAGTC-3';Foxp3引物序列为:正向5'-CACGCATGTTTGCCTTCTTCAGA-3',反向:5'-GTAGGGTTGGAACACCTGCTGGG-3';内参GAPDH引物序列为:正向5'-ATCTGGCACCACACC TTC-3',反向:5'-AGCCAGGTCCAGACGCA-3'。使用ABI公司的7300型号Real-Time PCR仪器进行扩增,所得结果采用2-ΔΔCt法进行相对定量分析[11]。
1.5统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1两组患者外周血中Th17及Treg细胞比例比较
流式细胞术检测显示,对照组外周血中Th17细胞比例为(0.36±0.23)%,显著低于研究组[(1.51± 0.27)%],差异有统计学意义(t =20.51,P=0.000);对照组外周血中Treg细胞比例为(1.26±0.27)%,显著低于研究组[(3.37±0.48)%],差异有统计学意义(t=24.23,P=0.000)。见图1。
2.2两组患者血清细胞因子IL-17及TGF-β水平比较
ELISA法结果显示,研究组血清IL-17为(28.12±6.33)pg/ml,显著高于对照组[(14.41±6.21)pg/ml],差异有统计学意义(t =9.78,P=0.000);研究组血清TGF-β为(38.41±8.44)pg/ml,显著高于对照组[(24.49±7.42)pg/ml],差异有统计学意义(t = 7.83,P=0.000)。见图2。
2.3两组患者外周血中转录因子RORγT mRNA 及Foxp3 mRNA水平比较
RT-PCR检测两组患者外周血细胞中Th17及Treg细胞特异性转录因子水平,结果发现研究组外周血RORγT mRNA及Foxp3 mRNA的表达显著高于对照组,差异有统计学意义(t1=12.27,t2=7.89,P= 0.000)。说明Th17及Treg细胞在AL中发挥重要作用。见图3。
2.4急性白血病患者化疗前后各指标比较
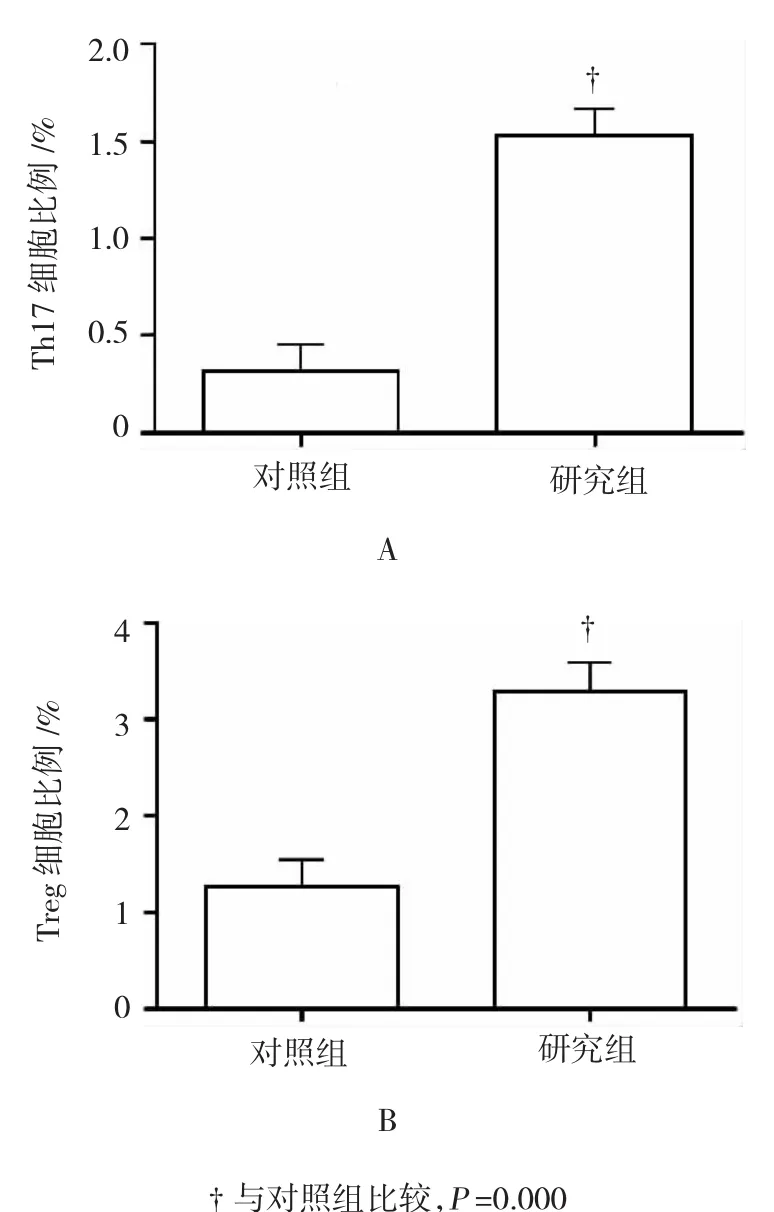
图1 两组患者外周血中Th17及Treg细胞比例
化疗后,40例AL患者中有17例效果显著为缓解组,其余23例为无效组。缓解组治疗后Th17和Treg细胞比例显著降低(见表1)。缓解组治疗后血清IL-17及TGF-β水平显著降低,差异有统计学意义(见表2)。缓解组治疗后外周血中RORγT mRNA 及Foxp3 mRNA水平显著降低,差异有统计学意义(见表3)。
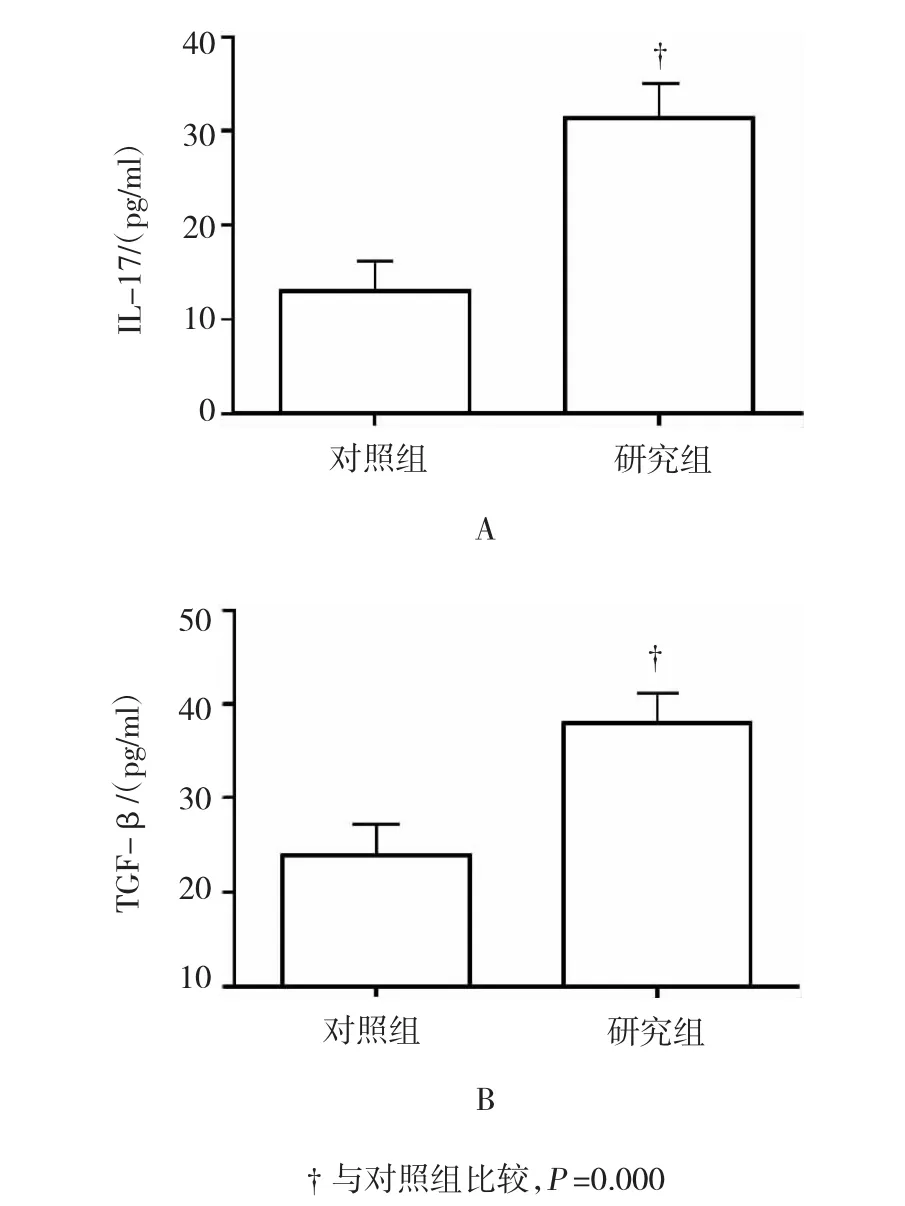
图2 两组患者血清IL-17及TGF-β水平
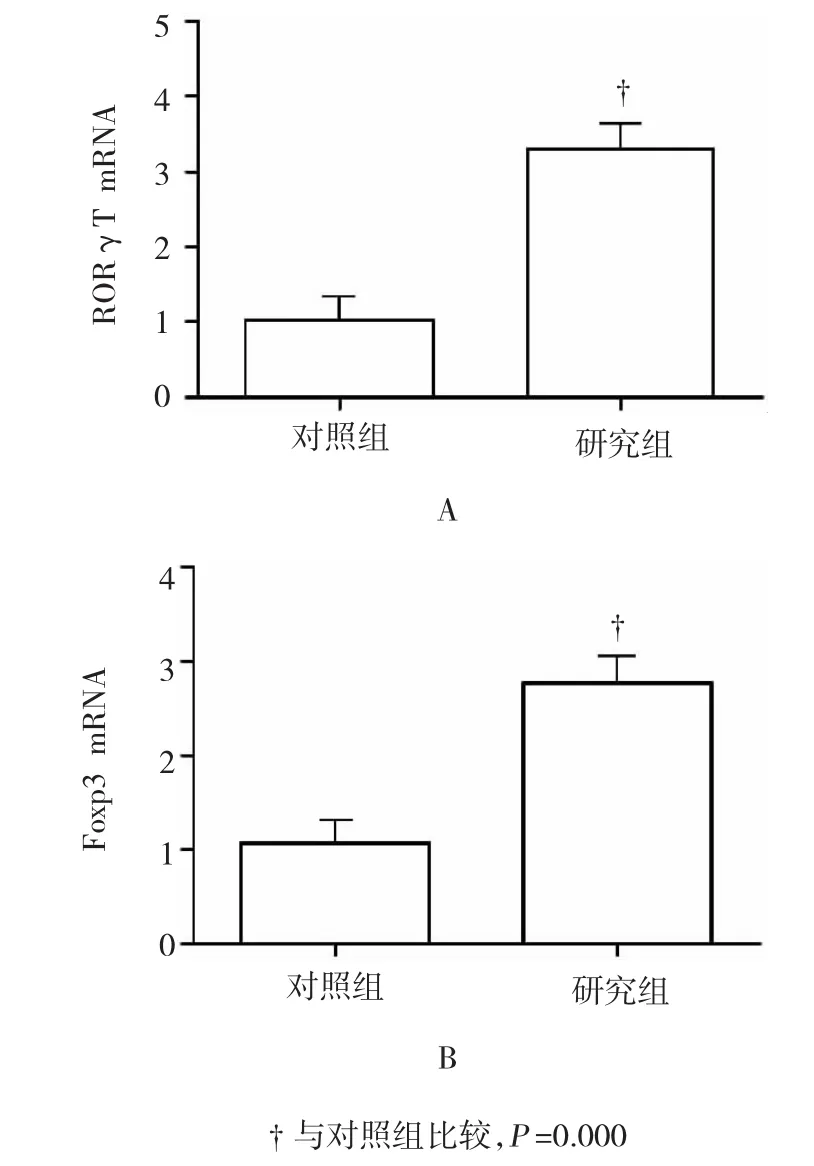
图3 两组人群外周血中RORγT及Foxp3 mRNA的水平
表1 AL患者化疗前后Th17及Treg细胞比例的比较(%±s)

表1 AL患者化疗前后Th17及Treg细胞比例的比较(%±s)
注:1)与治疗前比较,t=4.90,P=0.000;2)与治疗前比较,t=7.02,P=0.000
组别 Th17细胞 Treg细胞缓解组(n=17)治疗前 1.45±0.23 3.21±0.34化疗后 1.01±0.291) 2.08±0.572)无效组(n=23)治疗前 1.65±0.26 3.47±0.51化疗后 1.71±0.31 3.61±0.77
表2 AL患者化疗前后血清IL-17及TGF-β水平的比较(pg/ml,±s)
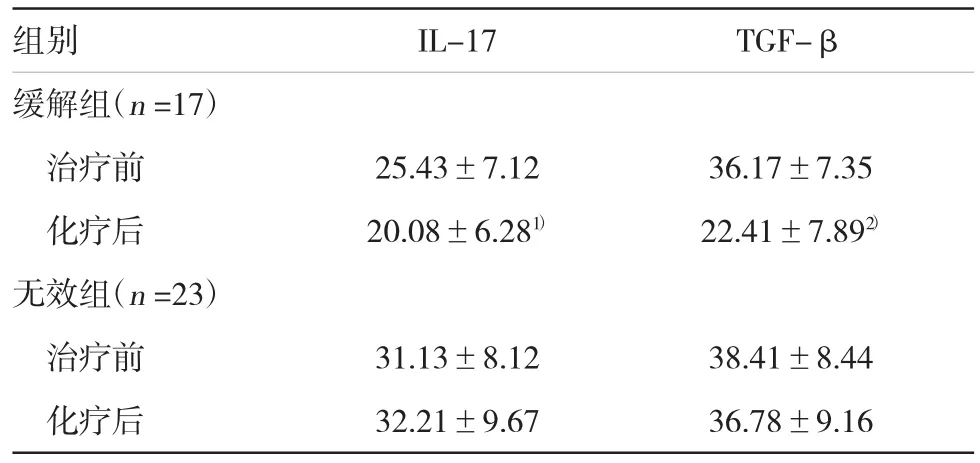
表2 AL患者化疗前后血清IL-17及TGF-β水平的比较(pg/ml,±s)
注:1)与治疗前比较,t=2.32,P<0.05;2)与治疗前比较,t=5.26,P=0.000
组别 IL-17 TGF-β缓解组(n=17)治疗前 25.43±7.12 36.17±7.35化疗后 20.08±6.281) 22.41±7.892)无效组(n=23)治疗前 31.13±8.12 38.41±8.44化疗后 32.21±9.67 36.78±9.16
表3 AL患者化疗前后外周血中RORγT mRNA及Foxp3 mRNA水平的比较(±s)
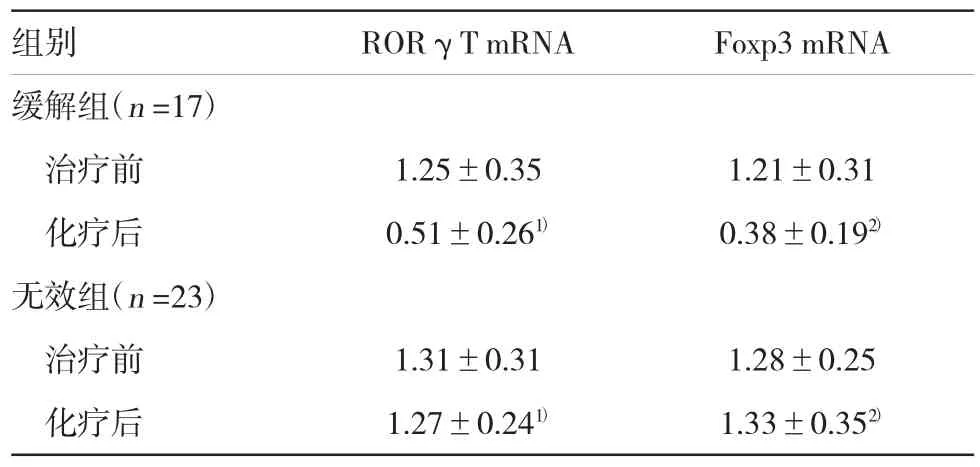
表3 AL患者化疗前后外周血中RORγT mRNA及Foxp3 mRNA水平的比较(±s)
注:1)与治疗前比较,t=7.00,P=0.000;2)与治疗前比较,t=9.41,P=0.000
组别 RORγT mRNA Foxp3 mRNA缓解组(n=17)治疗前 1.25±0.35 1.21±0.31化疗后 0.51±0.261) 0.38±0.192)无效组(n=23)治疗前 1.31±0.31 1.28±0.25化疗后 1.27±0.241) 1.33±0.352)
3 讨论
AL是造血干细胞的恶性克隆性疾病,发生、发展与机体免疫水平异常有密切关系,尤其是细胞免疫的异常。Th17及CD4+CD25+Treg细胞是CD4+T淋巴细胞经APC诱导分化的两大类极其重要的免疫细胞亚群。其中,Th17是一群在TGF-β、IL-6诱导下产生的细胞亚群,在自身免疫性疾病和机体防御反应中有重要意义[10]。而Treg细胞是近年来发现的一种新型免疫抑制细胞,来源于胸腺外周血中持续性抗原刺激、IL-10和/或TGF-β等细胞因子条件下诱导产生,该亚群具有极其重要的免疫调节功能,参与机体多种生理、病理的免疫调节作用[8,10,12]。
近年来,Th17及Treg细胞在肿瘤相关疾病中的作用受到广泛关注。DUAN等[9]认为在肺癌中,Th17 及Treg细胞显著增加,两者有相关性。CHEN等[13]发现在维吾尔族的宫颈癌患者中,Th17及Treg细胞显著增加,Th17/Treg细胞比率改变,打破体内Th17/reg细胞平衡。但是Th17及Treg细胞在AL患者的表达及其化疗后的变化报道较少。
本实验在AL患者的Th17及Treg细胞水平显著高于正常人群。提示Th17及Treg细胞参与AL患者的免疫应答,并可能对患者的免疫功能有重要调节作用,参与AL的进展。IL-17及TGF-β分别是Th17及Treg细胞特异性分泌的功能因子,检测两组患者血清IL-17及TGF-β水平发现,研究组血清IL-17及TGF-β的表达高于对照组,提示Th17及Treg细胞可能通过分泌相应的功能因子参与AL的致病过程。而RORγT和Foxp3不仅是Th17和Treg细胞的特异性标志,同时还是决定Th17及Treg细胞功能的关键转录基因[14],因此,本实验检测两组患者外周血中RORγT mRNA及Foxp3 mRNA水平,发现研究组外周血中RORγT mRNA及Foxp3 mRNA水平高于对照组,进一步验证该结果。LI等[15]发现胃癌患者外周血中Th17及Treg细胞显著增加,并表达高水平的IL-17及TGF-β,与临床病理参数相关,从侧面支持本实验结果。
为观察Th17及Treg细胞是否参与AL的预后,笔者对化疗后缓解的17例AL患者进行分析。结果发现缓解组患者的Th17及Treg细胞、相关因子及转录因子显著降低,而无效组患者治疗前后各项指标比较差异无统计学意义。提示AL治疗效果及预后在很大程度上与患者体内免疫细胞Th17、Treg的表达水平及功能因子有关。
综上所述,Th17、Treg细胞及其相关因子在AL的致病过程中发挥重要功能,其增加可能是临床上AL并发症及死亡的重要原因,并且与AL的预后有密切关系,对临床诊疗及预后有重要的指导意义。
参考文献:
[1] ZANETTI M. Tapping CD4 T cells for cancer immunotherapy: the choice of personalized genomics[J]. J Immunol, 2015, 194(5): 2049-2056.
[2] ANTIGNANO F, ZAPH C. Regulation of CD4 T-cell differentiation and inflammation by repressive histone methylation[J]. Immunol Cell Biol, 2015, 93(3): 245-252.
[3] PROTTI MP, MONTE LD, LULLO GD. Tumor antigen-specific CD4+T cells in cancer immunity: from antigen identification to tumor prognosis and development of therapeutic strategies[J]. Tissue Antigens, 2014, 83(4): 237-246.
[4] ASSUDANI DP, HORTON RBV, MATHIEU M, et al. The role of CD4+T cell help in cancer immunity and the formulation of novel cancer vaccines[J]. Cancer Immunol Immunother, 2007, 56(1): 70-80.
[5] BETTELLI E, CARRIER Y, GAO W, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J]. Nature, 2006, 441(7090): 235-238.
[6] GRATZ IK, CAMPBELL DJ. Organ-specific and memory treg cells:specificity, development, function, and maintenance[J]. Front Immunol, 2014, 5: 333.
[7] MORIKAWA H, SAKAGUCHI S. Genetic and epigenetic basis of Treg cell development and function: from a FoxP3-centered view to an epigenome-defined view of natural Treg cells[J]. Immunol Rev, 2014, 259(1): 192-205.
[8] WANG M, TIAN T, YU S, et al. Th17 and Treg cells in bone related diseases[J]. Clin Dev Immunol, 2013, 13: 203-210.
[9] DUAN MC, ZHONG XN, LIU GN, et al. The Treg/Th17 paradigm in lung cancer[J]. J Immunol Res, 2014, 18: 730-735.
[10] KLEINEWIETFELD M, HAFLER DA. The plasticity of human Treg and Th17 cells and its role in autoimmunity[J]. Semin Immunol, 2013, 25(4): 305-312.
[11] LIVAK KJ, SCHMITTGEN TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J]. Methods, 2001, 25(4): 402-408.
[12] HOU F, MA DX, CUI BX. Treg cells in different forms of uterine cancer[J]. Clin Chim Acta, 2013, 415: 337-340.
[13] CHEN ZF, DING JB, PANG NN, et al. The Th17/Treg balance and the expression of related cytokines in uygur cervical cancer patients[J]. Diagn Pathol, 2013, 8: 61.
[14] BARBI J, PARDOLL D, PAN F. Metabolic control of the Treg/Th17 axis[J]. Immunol Rev, 2013, 252(1): 52-77.
[15] LI Q, LI Q, CHEN J, et al. Prevalence of Th17 and Treg cells in gastric cancer patients and its correlation with clinical parameters[J]. Oncol Rep, 2013, 30(3): 1215-1222.
(童颖丹编辑)
Expressions of Th17 cells and CD4+CD25+T regulatory cells in peripheral blood of acute leukemia patients and their prognostic significance
Zhan-jia YANG
(Department of Blood Transfusion, Zhengzhou People's Hospital, Zhengzhou, Henan 450000, P.R. China)
Abstract:【Objective】To study the expressions of Th17 cells and CD4+CD25+Foxp3+regulatory T cells in the peripheral blood in acute leukemia (AL) patients and to explore their links with the prognosis of AL. 【Methods】A total of 40 AL patients in our hospital were enrolled into study group, 40 healthy volunteers were used as control group. Flow cytometry was used to detect peripheral blood Th17 cells and CD4+CD25+Foxp3+cell levels, and the serum levels of IL-17 and TGF-β were detected by ELISA. RT-PCR assay was used to analyze mRNA levels of ROR γ T and Foxp3 in both groups.【Results】The Th17 cell ratio in the patients with acute leukemia was significantly higher than that in the control group (t= 20.51, P= 0.000). The CD4+CD25+Foxp3+cell ratio in the patients with acute leukemia was significantly higher than that in thebook=67,ebook=73control group(t = 24.23, P = 0.000). The serum levels of IL-17 and TGF-β in the patients with acute leukemia were significantly higher than those in the control group (P= 0.000). In addition, the mRNA levels of ROR γ T and Foxp3 in the patients with acute leukemia were significantly higher than those in the control group (P= 0.000). After chemotherapy, the levels of Th17 and CD4+CD25+Foxp3+cells, the serum levels of IL-17 and TGF-β, and transcription factors in the patients with acute leukemia were decreased with statistical differences (P< 0.01).【Conclusions】Th17 cells and CD4+CD25+Foxp3+cells and related genes are increased in patients with acute leukemia. Periodic testing of Th17 and regulatory T cells may help monitoring immune status and evaluation of outcomes of AL patients.
Key words:Th17; regulatory T cells; IL-17; TGF-β; acute leukemia
收稿日期:2015-03-26
文章编号:1005-8982(2015)23-0066-05
中图分类号:R733.7
文献标识码:A

