大分割全乳放射治疗在保乳术后应用的系统评价
闫茂慧,申良方(.浙江省肿瘤医院放疗科,浙江杭州300;.中南大学湘雅医院肿瘤放疗科,湖南长沙40008)
大分割全乳放射治疗在保乳术后应用的系统评价
闫茂慧1,申良方2
(1.浙江省肿瘤医院放疗科,浙江杭州310022;2.中南大学湘雅医院肿瘤放疗科,湖南长沙410008)
摘要:目的评估大分割全乳放射治疗(WBI)在早期乳腺癌保乳术后应用的安全性和有效性。方法制订纳入和排除标准。制订检索词,检索外文数据库PubMed、Embase、SCI及the Coehrane Library,检索中文数据库中国生物医学文献数据库、中国知网、万方数据库及维普中文科技期刊数据库,手工检索及互联网查找。采用χ2检验分析各研究结果间的异质性,采用Rev Man 5.1.0软件进行Meta分析,采用相对危险度(RR)为合并效应量的统计指标,通过敏感性分析评价Meta分析结果的稳定性和可靠性。结果共纳入4项随机对照试验研究,包括5 884例患者,其中大分割WBI组2 948例,常规分割WBI组2 936例。大分割与常规分割组的5年局部复发率[RR=0.83(95%CI:0.64,1.08),P=0.160]、10年局部复发率[RR=0.86(95%CI:0.65,1.13),P=0.270]、5年总生存率[RR=1.02(95%CI:1.00,1.03),P=0.090]比较,差异无统计学意义。两种放射治疗方法的5年晚期放疗损伤:任何乳房外形改变[RR=1.01(95%CI:0.85,1.19),P=0.950]、心肌缺血性改变[RR=0.67(95%CI:0.43,1.05),P=0.080]、放射性肺纤维化[RR=1.28(95%CI:0.73,2.26),P=0.390]、肋骨骨折[RR=1.03(95%CI:0.62,1.73),P= 0.900]的发生率比较,差异无统计学意义。两种放射治疗方法的5年整体美容效果优良率[RR=0.98(95%CI:0.92,1.05),P=0.640]、10年整体美容效果优良率[RR=0.98(95%CI:0.87,1.10),P=0.730]比较,差异无统计学意义。结论早期乳腺癌保乳术后行大分割全乳放射治疗,可获得与常规分割相当的局部复发率、总生存率、未增加远期放射治疗损伤及降低整体美容效果优良率。
关键词:乳腺癌;保乳术;大分割全乳放射治疗;常规分割全乳放射治疗;系统评价
对早期乳腺癌(Ⅰ、Ⅱ期)患者,保乳术后辅助放射治疗(简称放疗)等同于乳腺癌根治术的疗效[1-8]。放疗是早期乳腺癌保乳治疗的重要组成部分。目前,全乳放疗(whole-breast irradiation,WBI)加瘤床局部补量(tumor bed boosts,TBB)广泛应用于早期乳腺癌保乳术后外照射,最常用的是给予患侧WBI剂量50 Gy,常规分割1.8~2.0 Gy/次,每周5次,予以瘤床区域局部补量10~16 Gy[9-12]。常规分割放疗应用于早期乳腺癌保乳术后,已取得较好的疗效,但由于其疗程较长,使患者的后续治疗时间延迟,给患者带来较大的经济负担。因此,一些试验对非常规分割全乳放疗疗效进行评估,研究是否有可行的短疗程放疗方案替代常规分割放疗[13-20]。大分割全乳放疗是通过增加分次放疗剂量(>2 Gy),减少分割次数,较常规分割缩短放疗疗程,可以更好地与后续治疗衔接,为患者带来生活和经济上的便利,也使得放疗仪器和医疗资源得到更合理和充分的应用,为更多患者提供治疗。
为探讨早期乳腺癌保乳术后行大分割全乳放疗的疗效,本文根据大量随机对照试验研究结果,采用系统评价方法,分析疗效指标,客观评价大分割全乳放疗在保乳术后应用的有效性和安全性,以期为临床提供一定的参考依据。
1 资料与方法
1.1纳入和排除标准
1.1.1设计类型随机对照试验(randomized controlled trial,RCT),无论是否采用盲法或隐藏分组。
1.1.2研究对象纳入标准:①经临床症状、体征、X线、病理、组织学及细胞学等诊断为原发早期乳腺癌患者,无远处转移,无并发其他严重疾病;②无年龄、种族、民族和国籍限制;③术前未行特殊治疗;④行保乳术+腋窝淋巴结清扫或前哨淋巴结清扫;⑤根据内科治疗原则,术后行化疗和/或内分泌治疗。排除标准:①术前行辅助放、化疗;②曾患过其他肿瘤。
1.1.3干预措施①治疗组:保乳术后行大分割全乳放疗;②对照组:保乳术后行常规分割全乳放疗。
1.1.4结局指标①局部复发率;②总生存率;③晚期放疗损伤发生率:依据肿瘤放射治疗组(radiation theropy oncology group,RTOG)/晚期放疗损伤分级标准;④整体美容效果优良率:依据RTOG美容效果评价标准(不评价有乳腺癌复发、第2肿瘤发生及二次手术的患者)。
1.2检索策略
以breast neoplasm/breast tumor/human mammary carcinoma/human mammary noplasm/breast cancer and segmental mastectomy/partial mastectomy/limited resection mastectomy/lumpectomy/local excision mastectomy/breast conserving surgery andhypofractionation/larger fraction and radiation therapy/radiotherapy/irradiation为检索词,并限制在随机对照试验、临床试验中,检索外文数据库PubMed、Embase、the Science Citation Index及the Coehrane Library。以乳腺癌/乳腺肿瘤和保乳术/乳房肿瘤切除术/乳房部分切除术和大分割放疗/大分割全乳放疗/非常规分割放疗和放射治疗/放射疗法为检索词,检索中文数据库中国生物医学文献数据库、中国知网、万方数据库及维普中文科技期刊数据库。检索截止日期为2014年12月。
检索词分为目标疾病和干预措施两部分,并根据具体数据库进行调整,所有检索采用主题词[MeSH (Medline),EMTREE(Embase)]与自由词相结合的方式,所有检索策略通过多次预检索后确定。手工检索相关医学杂志,并手工检索纳入文献的参考文献索引。用Google Scholar和Medical Martix搜索引擎在互联网上查找相关文献,并追查已纳入文献的参考文献。
1.3文献筛选
1.3.1初筛由2位研究者独立、仔细阅读检索到的全部文献的题目和摘要,根据文献研究类型、研究对象临床特点和干预措施,排除明显不符合标准的文献,并对排除文献给出排除理由。
1.3.2全文筛选对可能合格的文献进一步获取全文,制订全文筛选表格。根据纳入标准、研究设计类型、研究对象特点、干预措施和结局指标等,确定是否纳入。2位研究者需交叉核对纳入实验的结果,对有分歧的实验通过讨论或由第3位研究者判断和仲裁。
1.4质量评价
按照Cochrane协作网的偏倚风险评价工具进行评价。①随机分配方法:随机分配序列的产生是否正确;②分配方案隐藏:分配方案的隐藏是否完善;③盲法:盲法是否完善;④结果数据的完整性:结果数据是否完善;⑤选择性报告研究结果:研究报告是否提示无选择性报告结果;⑥其他偏倚来源:研究是否存在引起高度偏倚风险的其他因素。针对上面每一项研究结果,对上述6条作出是(低级偏倚)、否(高度偏倚)和不清楚(缺乏相关信息或偏倚情况不确定)的判断。其中①②⑤用于评估每一篇纳入研究的偏倚风险,其余3条则需针对每一篇纳入研究中的不同研究结果进行评估,强调同一研究中不同结果受偏倚影响程度不同。
1.5数据收集
对已纳入的文献进行数据收集,主要包括:①纳入研究的基本信息:题目、第一作者、发表年份、文献来源、病例入组年份、随访时间;②研究方法:随机分组方法、分组方法隐藏、盲法、结局数据的完整性、结局指标选择性报告、其他偏倚来源;③研究对象特征:临床分期、各组人数、年龄、手术方式、淋巴结清扫范围及数目、术后化疗和/或内分泌治疗方案;④干预措施:放射治疗总剂量、分割次数、时间、范围;⑤结局指标:局部复发率、总生存率、晚期放疗损伤发生率、整体美容效果优良率。制作数据提取表进行预实验,并对数据提取表进行修改和完善。
1.6统计学方法
1.6.1异质性检测各纳入研究结果间的异质性采用χ2检验,若纳入研究具有同构型(P>0.10)时,采用固定效应模型进行分析;若纳入研究存在异质性(P≤0.10)时,分析导致异质性的原因,并对可能导致异质性的因素进行亚组分析;若经这些分析和处理后仍有异质性,可使用随机效应模型计算合并统计量;如果各组间异质性过大,则采用描述性分析。
1.6.2合并统计量采用Cochrane协作网提供的软件Rev Man 5.1.0进行Meta分析。根据实验组事件发生率(experimental event rate,EER)和对照组事件发生率(control event rate,CER),采用相对危险度(relative risk,RR)为合并效应量的统计指标,RR= EER/CER;根据Z检验得到统计量的概率(P)值,以及95%可信区间(comfidence interval,CI),判断合并统计量是否有统计学意义。
1.6.3敏感性分析评价Meta分析结果的稳定性和可靠性,使用不同统计方法重新分析数据,如用随机效应模型代替固定效应模型,或固定效应模型代替随机效应模型。如果敏感性分析对Meta分析的结果没有本质改变,其分析结果的可靠性大大增加。
2 结果
共检索到相关文献615篇。通过阅读标题和摘要,有584篇因重复发表、综述类、会议类文章、信件、非临床试验、非随机对照或非临床对照试验、研究目的与本研究不符被排除。仔细阅读全文后,24篇文献因研究对象的纳入标准或干预措施与本研究不符,以及无本研究的结局指标而被排除。有6篇文献(英文)[15-20],共4项实验研究,包括5 884例患者符合纳入标准。见表1、2。
2.1质量评价(偏倚风险评估)
2.1.1随机分配方法4个研究采用计算机产生随机序列。
2.2.2分配方案隐藏3个研究通过电话或传真实施分配隐藏,1个研究未描述。
2.2.3盲法1个研究采用单盲,2个研究采用非盲,1个研究未描述盲法。
2.2.4数据的完整性4个研究描述缺失资料,因组间缺失的人数和原因相似,所以不影响结果数据的完整性。
2.2.5选择性报告研究结果4个研究未描述选择性报告研究结果。
2.2.6其他偏倚来源4个研究不能排除其他偏倚来源。总结同一研究和所有纳入研究的每个结局指标偏倚风险的标准,偏倚风险评价的结果总结为偏倚风险不确定。见表3。
2.2统计分析结果
2.2.1局部复发率4个研究比较保乳术后大分割与常规分割全乳放疗后5年局部复发率,共纳入5884例患者,大分割组2 948例,常规分割组2 936例;异质性检验结果提示研究资料具有同构型(P=0.580,I2=0%),故采用固定效应模型;Meta分析合并统计量结果:RR=0.83(95%CI:0.64,1.08),P=0.160。2个研究比较10年局部复发率,共纳入2 170例患者,大分割组1 088例,常规分割组1 082例;异质性检验结果提示研究资料具有同构型(P=0.570,I2=0%),故采用固定效应模型;Meta分析合并统计量结果:RR=0.86(95%CI:0.65,1.13),P=0.270,即保乳术后大分割与常规分割全乳放疗后5和10年局部复发率比较,差异无统计学意义。见图1。
2.2.2总生存率3个研究比较保乳术后大分割与常规分割全乳放疗后5年总生存率,共纳入4 948例患者,大分割组2 482例,常规分割组2 466例;异质性检验结果提示研究资料有同构型(P =0.230,I2= 32%),故采用固定效应模型;Meta分析合并统计量结果:RR=1.02(95%CI:1.00,1.03),P=0.090,即保乳术后大分割与常规分割全乳放疗后5年总生存率比较,差异无统计学意义。见图2。

表1 纳入研究的基本资料
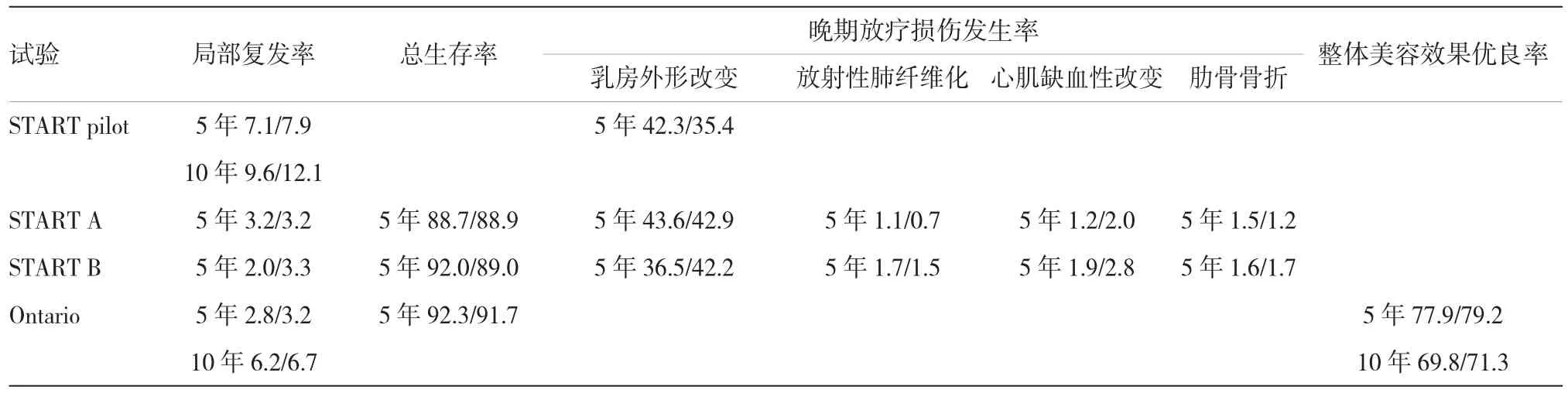
表2 纳入研究的结局指标(大分割组/常规分割组)%

表3 方法质量评价
2.2.3晚期放疗损伤发生率3个研究比较保乳术后大分割与常规分割全乳放疗后5年任何乳房外形改变发生率,共纳入4 507例患者,大分割组2 257例,常规分割组2 250例;异质性检验结果提示研究资料有异质性(P=0.005,I2=81%),故采用随机效应模型;Meta分析合并统计量结果:RR=1.01(95%CI:0.85,1.19),P=0.950,差异无统计学意义(见图3)。2个研究比较保乳术后大分割与常规分割全乳放疗后5年晚期放疗损伤,包括心肌缺血性改变、放射性肺纤维化和肋骨骨折的发生率,共纳入3 714例患者,大分割组1860例,常规分割组1854例。心肌缺血性改变:异质性检验结果提示研究资料有同构型(P= 0.740,I2=0%),故采用固定效应模型;Meta分析合并统计量结果:RR=0.67(95%CI:0.43,1.05),P=0.080。放射性肺纤维化:异质性检验结果提示研究资料有同构型(P=0.650,I2=0%),故采用固定效应模型;Meta分析合并统计量结果:RR=1.28(95%CI:0.73,2.26),P=0.390。肋骨骨折:异质性检验结果提示研究资料有同构型(P=0.640,I2=0%),故采用固定效应模型;Meta分析合并统计量结果:RR=1.03(95%CI:0.62,1.73),P=0.900,即保乳术后大分割与常规分割全乳放疗后5年晚期损伤,包括心肌缺血性改变、放射性肺纤维化及肋骨骨折的发生率比较,差异无统计学意义。见图4。
2.2.4美容效果优良率1个研究比较保乳术后大分割与常规分割全乳放疗后5和10年美容效果优良率,共纳入1 234例患者,大分割组622例,常规分割组612例。分析结果为:5年RR=0.98(95%CI:0.92,1.05),P=0.640;10年RR=0.98(95%CI:0.87,1.10),P=0.730,即保乳术后大分割与常规分割全乳放疗后的5和10年美容效果优良率比较,差异无统计学意义。见图5。
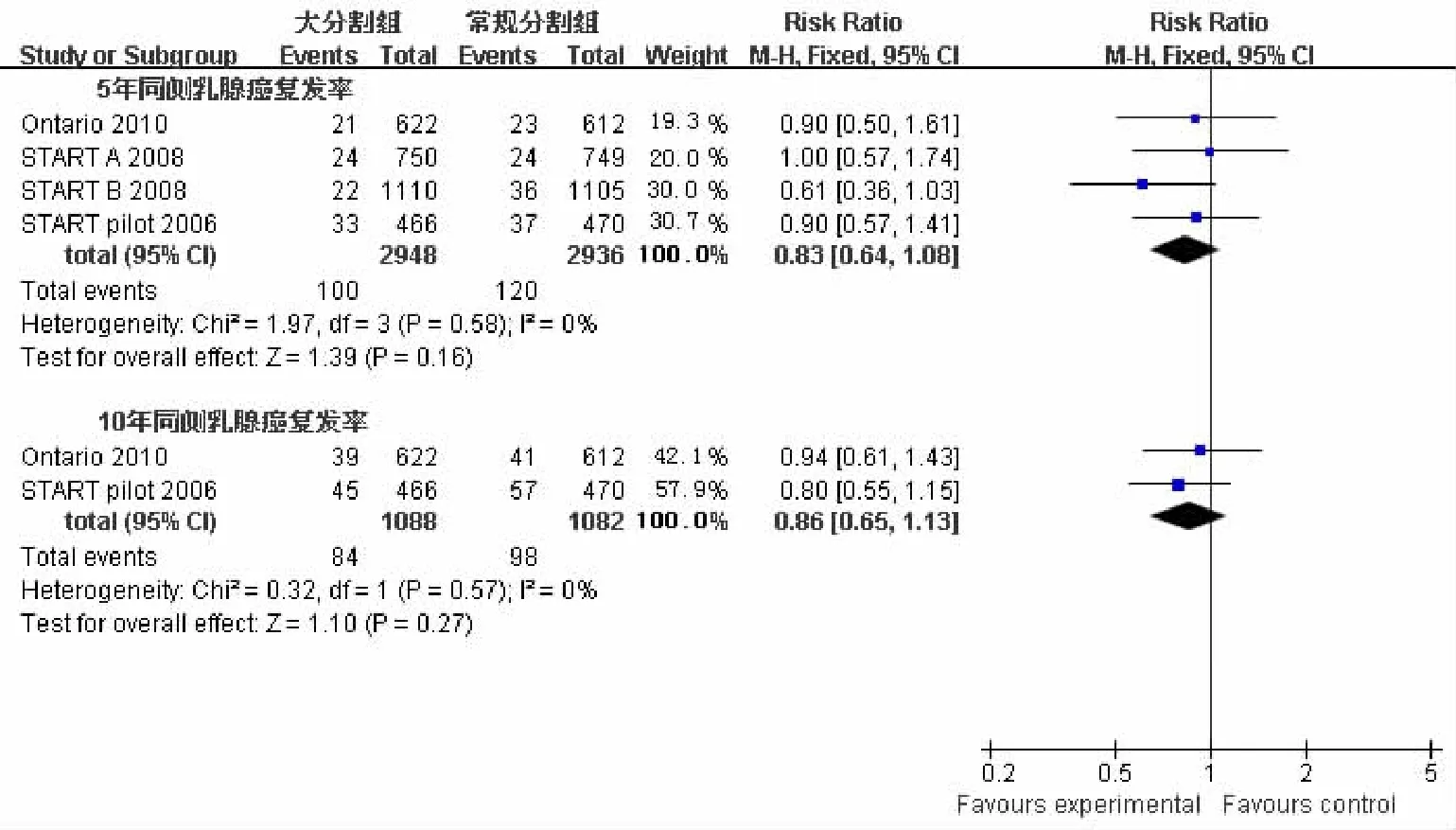
图1 局部复发率
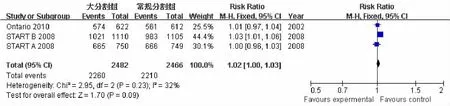
图2 5年总生存率
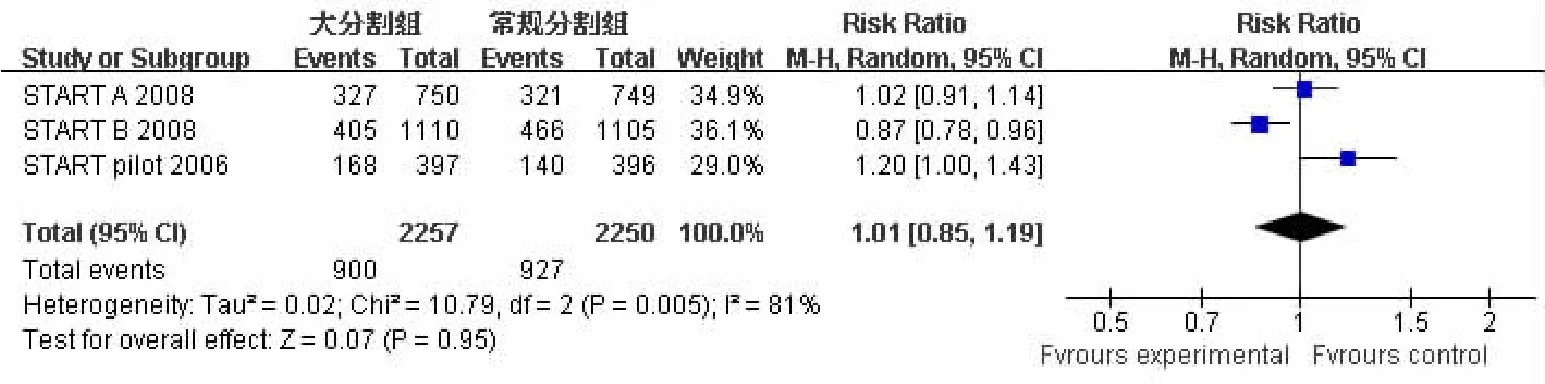
图3 乳房外形改变发生率
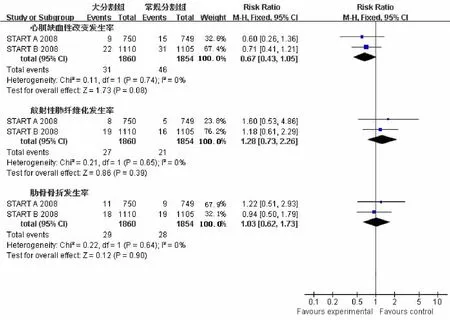
图4 晚期放疗损伤发生率
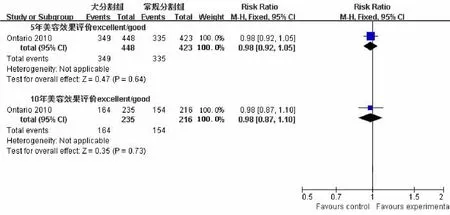
图5 美容效果优良率
3 讨论
随着早期乳腺癌检出率的不断提高,以及患者对生活质量的要求日益提高,保乳治疗较传统根治术创伤小,美容效果好,减轻患者心理和情绪负担的优势也更为突出。大量前瞻性设计的随机对照试验随访结果显示,早期乳腺癌保乳术后放疗与根治术在长期肿瘤局部控制率、总生存率方面比较,差异无统计学意义[1-8]。保留乳房治疗已经成为欧美国家Ⅰ、Ⅱ期乳腺癌的标准治疗,在国内也逐步成熟。放疗是早期乳腺癌保乳治疗的重要组成部分。术后放疗可以降低肿瘤局部复发率,提高患者的远期生存率,并且生存率的提高与肿瘤局部控制率相关联[2]。
分次放射治疗的生物学原理和照射剂量-生物效应的量效关系,是研究放射治疗生物学合理性和处方剂量科学性的基础。在影响分次放射治疗的生物学因素中,4Rs概念是重要的环节,是指细胞放射损伤的修复(repair of radiation damage)、周期内细胞的再分布(redistribution wityin the cell cycle)、氧效应及乏氧细胞的再氧合(oxygen effect and reoxygenation)以及再群体化(repopulation)。研究分次放射治疗的生物学基础原理是把1次剂量分成数次时,可由分次剂量之间亚致死损伤的修复以及在总治疗时间足够长的条件下,由干细胞的再群体化而保护正常组织。但如果总治疗时间太长也会同时影响肿瘤治疗效果;同时由于分次照射之间肿瘤细胞的再氧合和再分布而对肿瘤有敏化作用[21]。在临床研究中,通过生物剂量等效换算来比较不同分割方案,以及改变原有治疗方案或开展新的治疗模式与常规治疗进行生物剂量等效估算,以获得最好的治疗效益并使患者的利益得到保护。生物剂量的概念是指对生物体辐射反应程度的测量,其与物理剂量是不同的概念,因为随每次照射剂量的大小,生物效应也发生改变,所以实际生物效应剂量与物理剂量并不一致[22]。因此,在研究放射治疗方案时,需要以生物剂量概念为基础,了解重要器官和组织的耐受性和耐受剂量,比较不同分次剂量、分次数和总治疗时间对放疗疗效的影响。目前广泛应用线性二次模型[21]来研究实际的生物效应剂量(biological effective dose,BED)值,BED=nd×[1+d/(α/β)](n:分次数,d:分次剂量,nd:总剂量)。其中α/β值的意义在于:①反映不同组织分次敏感性的差异,低α/β值的组织较高α/β值的组织分次剂量敏感性强;②其在数值上相当于一个特征性剂量,在该剂量照射下DNA双链断裂与2个单链断裂组合发生几率相等[21]。正常组织(结缔组织、神经组织)晚期放疗反应的α/β值为1.5~3.0 Gy;皮肤、黏膜组织急性放疗反应的α/β值为10.0 Gy[22]。在20世纪80年代中期,DOUGLAS[23]首次提出局部晚期和复发乳腺癌的α/β值约为4~5 Gy;相关临床数据的放射生物学分析结果显示,乳腺腺癌对分次剂量较鳞癌(α/β≥6 Gy)敏感,其分次剂量敏感性与正常组织晚期放疗反应相似[24-28];近期通过START pilot和START A随机对照试验研究得出乳腺癌的α/β值为4.6 Gy(95%CI:1.1,8.1)。以放射生物学为理论依据,在保证理想的肿瘤局部控制率和患者生存期的前提下,应用合理的大分割放疗,理论上讲通过分次的较高剂量(>2Gy)照射更有利于提高乳腺肿瘤放射治疗疗效;通过减少分次数缩短放疗疗程,弥补放疗期间肿瘤细胞再群体化所损失的效益[22];但晚反应组织的分次剂量敏感性较高(α/β=1.5~3.0 Gy),因此大分割放疗后可能会出现较高的晚期放疗反应发生率。
任何方式的放疗技术的应用都应该考虑到3个方面:局部肿瘤控制率、患者生存期和并发症。本研究中,早期乳腺癌保乳术后行大分割与常规分割全乳放疗的5和10年局部复发率、5年总生存率比较,差异无统计学意义(P=0.160、0.270和0.090),表明早期乳腺癌保乳术后行大分割全乳放疗在肿瘤控制率和患者生存率上可取得与常规分割放疗相同的疗效。随着人们对生活质量的要求越来越高,乳腺癌患者对放疗损伤、乳房美容效果要求的提高越来越期待。本研究中,乳房外形改变纳入研究的放疗总剂量为40~42.9 Gy,分次剂量为2.67~3.3 Gy,大分割组与常规分割组任何乳房外形改变的5年发生率比较,差异无统计学意义(P=0.950);5年晚期放疗损伤、心肌缺血性改变、放射性肺纤维化、肋骨骨折的发生率比较,差异无统计学意义(P=0.080、0.390和0.900)提示,早期乳腺癌保乳术后行大分割与全乳放疗,并没有增加晚期放疗损伤,与相关研究结果一致[16,18-19]。比较治疗侧与非治疗侧乳房,根据乳房大小及形状、乳晕/乳头位置及形状、皮肤颜色、乳房水肿、手术疤痕、毛细血管扩张等,将放疗后整体乳房美容效果评价分为4级。0级:无改变/优;1级:轻度改变/良;2级:中度改变/中;3级:重度改变/差。本研究的大分割组与常规分割组5和10年美容效果优良率比较,差异无统计学意义(P=0.590和0.580)表明早期乳腺癌保乳术后行大分割全乳放疗在乳房美容效果上可取得与常规分割放疗相同的疗效。
在保证局部肿瘤控制率、患者生存期和并发症方面取得较理想疗效的基础上,大分割放疗的应用尽量选择优势放疗技术,获得合理均匀的剂量分布并尽量减少心肺的受照剂量。与传统放疗技术相比,乳腺癌保乳术后调强放疗(intensity-modulated radiotherapy,IMRT)的优势表现在:①提高靶区剂量分布的均匀性,特别是对乳房内高剂量区的减少尤为明显;②明显减小传统放疗中常见的照射野交接区冷点和热点的区域或出现的几率;③减少肺组织和心脏的照射容积和照射剂量,结合呼吸控制技术尤为明显。应用IMRT行大分割全乳放疗,有助于提高肿瘤的局部控制率和更好地保护正常组织,更有利于大分割全乳放疗的研究和开展。DONOVAN等[29]通过随机对照试验研究IMRT与普通放疗的疗效比较,结果显示,IMRT较普通放疗显著降低放疗后乳腺外观改变(浮肿、色素沉着)的发生率(P =0.008),但两组在乳房硬度、患者生活质量方面比较,差异无统计学意义。HARDEE等[30]应用IMRT与三维适形放疗行大分割全乳放疗,比较两者的放疗疗效,结果显示,IMRT行大分割全乳放疗明显降低急性放疗反应的发生。本研究纳入的试验采用普通外照射,有待更多随机对照试验应用IMRT技术探讨大分割全乳放疗的疗效。
美国放射治疗及肿瘤学会[31]提出大分割全乳放疗适应于年龄≥50岁、保乳术后pT1~2N0、未接受过化疗、射野中心轴处方剂量±7%。对于不予以瘤床补量的大分割放疗方案,推荐42.5 Gy/16 F;瘤床补量的大分割放疗方案没有统一共识。目前,临床上保乳术后大分割全乳放疗的适应证还没有统一的标准,对乳腺癌患者不同的年龄、乳房大小、临床分期、淋巴结转移、术后切缘以及激素受体等,需要进一步的临床试验进行多因素分析,评价疗效,得出适应行大分割放疗的统一纳入标准。为提高治疗疗效,降低放疗损伤,满足患者对生活质量的更高要求,有必要深入探索以放射生物学为基础的更优放疗方案和放疗技术。
本研究纳入的4个研究均制订详细、恰当的纳入和排除标准,患者的年龄、肿瘤大小、淋巴结检测数目等基线资料可比。异质性检测除分析乳房外形改变采用随机效应模型外,其他分析提示研究数据具有同构型,采用固定效应模型进行Meta分析。用随机效应模型检测敏感性,两种统计模型的计算结果是基本一致的,说明本研究具有较好的可靠性。4个研究为随机对照试验研究,采用计算机产生随机序列;3个研究通过电话或传真实施分配隐藏,1个研究未描述;1个研究采用单盲,2个研究采用非盲,1个研究未描述盲法;4个研究描述缺失资料,因组间缺失的人数和原因相似,所以不影响结果数据的完整性;4个研究未描述选择性报告研究结果;4个研究不能排除其他偏倚来源。以上方法学方面的缺陷,不排除其存在选择性偏倚和实施偏倚的可能性。本研究检索虽未限制语种,但经检索后纳入文献均为英文,发表偏倚也不可避免,并且可能会影响结果的普遍性。根据推荐分级的评价、制定与评估标准[32],①本系统评价方法学质量评价:偏倚风险不确定;②证据的间接性:无;③研究结果的异质性检验:同质性;④估计结果的精确度:可信区间较理想,较精确;⑤发表偏倚:不能排除,本系统评价证据质量分级为中级证据。在筛选纳入研究过程中,一些随机对照研究临床分期未明确给出,未被纳入本研究中,使论证强度受到一定限制。各研究的病例纳入条件和治疗方案并不相同。Ontario实验[15,20]的研究病例纳入条件为浸润性乳腺癌保乳术后、切缘阴性、腋窝淋巴结阴性的患者,但排除较大乳房患者(最大径>25 cm),只有少数患者接受辅助化疗,并且未行瘤床补量;关于START A和START B实验的研究病例纳入条件范围较宽,未限制腋窝淋巴结转移、乳房大小,并行瘤床补量,以上因素都可能在一定程度上影响结果[16-17]。因此,在应用研究结果时需谨慎。在今后的研究中建议在方法学上充分随机,充分实施分配隐藏,减少偏倚的产生,按照随机对照试验报告统一标准进行实验报告,尽可能采用国际公认的测量指标,以求更全面地评估保乳术后大分割全乳放疗的疗效,指导临床决策。鉴于纳入的研究少,使论证强度受到一定的限制,有必要进一步开展高质量、大样本临床随机对照试验进一步评价疗效。
综上所述,大分割与常规分割全乳放疗,在局部复发率、总生存率、远期放疗损伤及美容效果优良率方面有相同的疗效。但大分割放疗较常规放疗明显减少放疗次数,为患者在经济和生活方面带来方便,也为更多患者提供治疗机会。
参考文献:
[1] DARBY S, MCGALE P, TAYLOR C, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials[J]. Lancet, 2011, 378(9804): 1707-1716.
[2] BLICHERT-TOFT M, NIELSEN M, D譈RING M, et al. Long-term results of breast conserving surgery vs. mastectomy for early stage invasive breast cancer: 20-year follow-up of the Danish randomized DBCG-82-TM protocol[J]. Acta Oncol, 2008, 47(4): 672-681.
[3] CLARKE M, COLLINS R, DARBY S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials[J]. Lancet, 2005, 366(9503): 2087-2106.
[4] FISHER B, ANDERSON S, BRYANT J, et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer[J]. N Engl J Med, 2002, 347(16): 1233-1241.
[5] VERONESI U, CASCINELLI N, MARIANI L, et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer[J]. N Engl J Med, 2002, 347(16): 1227-1232.
[6] POGGI MM, DANFORTH DN, SCIUTO LC, et al. Eighteen-year results in the treatment of early breast carcinoma with mastectomy versus breast conservation therapy: the national cancer institute randomized trial[J]. Cancer, 2003, 98(4): 697-702.
[7] VAN DONGEN JA, VOOGD AC, FENTIMAN IS, et al. Long-term results of a randomized trial comparing breast-conserving therapy with mastectomy: european organization for research and treatment of cancer 10801 trial[J]. J Natl Cancer Inst, 2000, 92(14): 1143-1150.
[8] ARRIAGADA R, L魭MG, GUINEBRETI魬RE JM, et al. Late local recurrences in a randomised trial comparing conservative treatment with total mastectomy in early breast cancer patients[J]. Ann Oncol, 2003, 14(11): 1617-1622.
[9] Hypofractionated radiotherapy in the treatment of early breast canser[J]. World J Radio, 2010, 2(6): 197-202.
[10] YOHN J, HAVILAND J. Hypofractionated adjuvant whole breast radiotherapy: progress and prospects[J]. Acta Oncol, 2010, 49(8): 1288-1292.
[11] BARTELINK H, HORIOT JC, POORTMANS P, et al. Recurrence rates after treatment of breast cancer with standard radiotherapy with or without additional radiation[J]. N Engl J Med, 2001, 345(19): 1378-1387.
[12] MORROW M. Rational local therapy for breast cancer[J]. N Engl J Med, 2002, 347(16): 1270-1271.
[13] CAUDRELIER JM, TRUONG PT. Role of hypofractionated radiotherapy in breast locoregional radiation[J]. Cancer Radiother, 2015, 19(4): 241-247.
[14] The FAST Trialists Group. First results of the randomised UK FAST Trial of radiotherapy hypofractionation for treatment of early breast cancer (CRUKE/04/015)[J]. Radiother Oncol, 2011, 100(1): 93-100.
[15] WHELAN TJ, PIGNOL JP, LEVINE MN, et al. Long-term results of hypofractionated radiation therapy for breast cancer[J]. N Engl J Med, 2010, 362(6): 513-520.
[16] BENTZEN SM, AGRAWAL RK, AIRD EGA, et al. The UK standardisation of breast radiotherapy (START) trial A of radiotherapy hypofractionation for treatment of early breast cancer: a randomised trial[J]. Lancet Oncol, 2008, 9(4): 331-341.
[17] The START Trialists' Group. The UK standardisation of breast radiotherapy (START) trial B of radiotherapy hypofractionation for treatment of early breast cancer: a randomised trial [J]. Lancet, 2008, 371(9618): 1098-1107.
[18] OWEN JR, ASHTON A, BLISS JM, et al. Effect of radiotherapy fraction size on tumour control in patients with early-stage breast cancer after local tumour excision: long-term results of a randomised trial[J]. Lancet Oncol, 2006, 7(6): 467-471.
[19] YARNOLD J, ASHTON A, BLISS J, et al. Fractionation sensitivity and dose response of late adverse effects in the breast after radiotherapy for early breast cancer: long-term results of a randomised trial[J]. Radiother Oncol, 2005, 75(1): 9-17.
[20] WHELAN TJ, MACKENZIE R, JULIAN J, et al. Randomized trial of breast irradiation schedules after lumpectomy for women with lymph nodenegative breast cancer[J]. J Natl Cancer Inst, 2002, 94(15): 1143-1450.
[21]殷蔚伯,谷铣之.肿瘤放射治疗学[M].第4版.北京:中国协和医科大学出版社, 2008: 261-280.
[22] THAMES HD, BENTZEN SM, TURESSON I, et al. Time-dose factors in radiotherapy: a review of the human data[J]. Radiother Oncol, 1990, 19(3): 219-235.
[23] DOUGLAS BG. Superfractionation: its rationale and anticipated benefits[J]. Int J Radiat Oncol Biol Phys, 1982, 8(7): 1143-1153.
[24] GOLDHIRSCH A, GLICK JH, GELBER RD, et al. Meeting highlights: international consensus panel on the treatment of primary breast cancer. in:seventh international conference on adjuvant therapy of primary breast cancer [J]. J Clin Oncol, 2001, 19(18): 3817-3827.
[25] EIFEL P, AXELSON JA, COSTA J, et al. National institutes of health consensus development conference statement: adjuvant therapy for breast cancer[J]. J Natl Cancer Inst, 2001, 93(13): 979-989.
[26] KURTZ J. The curative role of radiotherapy in the treatment of operable breast ancer[J]. Eur J Cancer, 2002, 38(15): 1961-1974.
[27] GOLDHIRSCH A, WOOD WC, GELBER RD, et al. Meeting highlights: updated international expert consensus on the primary therapy of early breast cancer[J]. J Clin Oncol, 2003, 21(17): 3357-3365.
[28] OVERGAARD M, NIELSEN HM, OVERGAARD J. Is the benefit of postmastectomy irradiation limited to patients with four or more positive nodes, as recommended in international consensus reports? A subgroup analysis of the DBCG 82 randomized trials [J]. Radiother Oncol, 2007, 82(3): 247-253.
[29] DONOVAN E, BLEAKLEY N, DENHOLM E, et al.Randominsed trial of standard 2D radiotherapy (RT) versus intensity modulated radiotherapy (IMRT) in patients prescribed breast radiotherapy[J]. Radiother Oncol, 2007, 82(3): 254-264.
[30] HARDEE ME, RAZA S, BECKER SJ, et al. Prone hypofractionated whole-breast radiotherapy without a boost to the tumor bed: comparable toxicity of IMRT versus a 3D conformal technique[J]. Int J Radiat Oncol Bid Phys, 2012, 82(3): 415-423.
[31] SMITH BD, BENTZEN SM, CORREA CR, et al. Fractionation for whole breast irradiation: an american society for radiation oncology (astro) evidence-based guideline[J]. Int J Radiat Oncol Biol Phys, 2011, 81(1): 59-68.
[32]刘鸣.系统评价、Meta-分析设计与实施方法[M].北京:人民卫生出版社, 2011: 136-137.
(申海菊编辑)
Hypofractionated whole-breast radiotherapy after breast-conserving surgery: a systematic review
Mao-hui YAN1, Liang-fang SHEN2
(1. Department of Radiation Oncology, Zhejiang Cancer Hospital, Hangzhou, Zhejiang 310022, P.R. China; 2. Department of Radiation Oncology, Xiangya Hospital of Central South University, Changsha, Hunan 410008, P.R. China)
Abstract:【Objective】To evaluate the risk of local recurrence, overall survival, cosmetic results and radiation damage of hypofractionated whole-breast radiotherapy after breast-conserving surgery (BCS) for early breast cancer.【Methods】The searching algorithm was used to search the foreign language databases as PubMed, Embase, SCI and the Coehrane Library, and the Chinese databases as CBM, CNKI, Wanfang database and VIP. The last search was updated in December 2014. In accordance with the type of study design, study characteristics, interventions and outcome measures, all randomized controlled trials were considered eligible which compared hypofractionated whole-breast radiotherapy with conventional whole-breast radiotherapy after BCS in patients with early breast cancer. In addition, each previous systematic review and Meta-analysis of randomized trials in this were identified. Manual searches were done by reviewing articles and abstracts. RevMan 5.1.0 software was used for statistical analysis. The χ2test was used to compare heterogeneity. Sensi-book=58,ebook=64tivity analysis was used to evaluate the stability and reliability of the results.【Results】A search of four trials with pooled total of 5,884 patients was included.①There was no significant difference in 5-year or 10-year ipsilateral breast cancer recurrence (P= 0.160, 0.270) between the patients with hypofractionated and conventional whole-breast radiotherapy.②There was no significant difference in 5-year overall survival (P = 0.090) between the patients with hypofractionated and conventional whole-breast radiotherapy.③There was no significant difference in 5-year long-term radiation damage [change in breast appearance (P= 0.950), ischemic heart disease (P= 0.080), symptomatic lung fibrosis (P= 0.390) or symptomatic rib fracture (P= 0.900)] between the patients with hypofractionated and conventional whole-breast radiotherapy.④There was no significant difference in 5-year or 10-year cosmetic result of excellent/good(P= 0.640, 0.730) between the patients with hypofractionated and conventional whole-breast radiotherapy.【Conclusions】There is no significant difference in ipsilateral breast cancer recurrence, overall survival, long-term radiation damage (any change in breast appearance, ischemic heart disease, symptomatic lung fibrosis or symptomatic rib fracture) or the cosmetic result of excellent/good between the patients with hypofractionated and conventional whole-breast radiotherapy.
Key words:breast cancer; breast-conserving surgery; hypofractionated whole-breast irradiation; conventional whole-breast irradiation; systematic review
[通信作者]申良方,E-mail:slf1688@sina.com;Tel:0731-84327377
收稿日期:2015-06-09
文章编号:1005-8982(2015)23-0057-09
中图分类号:R737.9
文献标识码:A

