巨噬细胞泡沫化对炎症反应的影响*
宋 辉 杨 芳
巨噬细胞泡沫化对炎症反应的影响*
宋 辉 杨 芳#
目的:观察巨噬细胞泡沫化对促炎因子水平的影响。方法:取6-8周龄C57BL/6J雄性小鼠骨髓细胞,采用L929培养分化成巨噬细胞。在巨噬细胞悬液中加入不同浓度氧化型低密度脂蛋白(ox-LDL),分为空白对照组(0μg/ml)、10μg/ml组和25 μg/ml组,再培养24h后观察各组细胞泡沫化程度,检测分析各组泡沫细胞中促炎因子白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)mRNA的表达水平。结果:所取骨髓细胞被成功分化为巨噬细胞。不同浓度ox-LDL均能诱导巨噬细胞的泡沫化,25μg/ml组巨噬细胞泡沫化程度高于10μg/ml组(P<0.01)。与空白对照组相比,25μg/ml组的IL-1β和TNF-α mRNA表达水平均显著降低(P<0.05)。结论:巨噬细胞泡沫化可以抑制炎症反应。
巨噬细胞;泡沫化;促炎因子;小鼠
冠心病是世界上死亡率最高的疾病之一,其主要病理机制是动脉粥样硬化(Atherosclerosis,AS)[1]。研究[2]证实,AS是一种炎症反应,其特点为脂质和胆固醇在大、中动脉血管内膜的聚集。炎症反应主要由动脉内皮细胞激活和白细胞渗透引起[3],细胞因子和化学因子在其中发挥了很大的作用[1],当血液中富含载脂蛋白B(Apo-B)的脂蛋白浓度升高并在血管内膜聚集时,内皮细胞被激活并分泌多种细胞因子和化学因子,如单核细胞趋化蛋白-1(MCP-1)、巨噬细胞集落刺激因子(M-CSF)、转录生长因子-β(TGF-β)等,招募血液中的单核巨噬细胞和T细胞渗入到血管内膜;T 细胞进入血管内膜分化并分泌细胞因子提呈辅助性T细胞1(Th1) 和Th2,包括干扰素-γ(IFN-γ)、转录生长因子-α(TGF-α)、白介素-12(IL-12)和肿瘤坏死因子-β(TNF-β)[4]。单核巨噬细胞分化成巨噬细胞并吞噬被修饰的低密度脂蛋白,即氧化型低密度脂蛋白(ox-LDL),最终形成巨噬细胞源性泡沫细胞[5,6]。在巨噬细胞内,被吞噬的ox-LDL合成胆固醇脂并聚集为脂滴,形成泡沫细胞,巨噬细胞的泡沫化一直被认为是一个促炎反应过程[7]。虽然对AS与炎症反应的研究较多,但是巨噬细胞泡沫化过程中炎性细胞相互作用如何引起炎症反应仍是目前探讨的热点。本实验观察巨噬细胞泡沫化对炎症反应的影响。
1 材料与方法
1.1 实验动物、主要试剂及仪器
C57BL/6J雄性小鼠(6-8周龄,体重22-25g)购自武汉大学动物实验中心,取其骨髓细胞用于巨噬细胞的分化。15% L929 培养液为15% 培养小鼠成纤维细胞系所得的上清液(含有M-CSF类似物)与85% IMDM液体培养基的混合物,IMDM液体培养基(货号:SH30228.01B)购自Hyclone公司,ox-LDL购自美国Biomedical Technologies公司,乙二胺四乙酸(EDTA)粉 (货号:E6758)、油红染料粉(货号:O9755)、10% 福尔马林溶液(货号:F8775)、TRIzol溶液(货号:T9424)均购自美国Sigma公司,荧光抗体CD11b(货号:12-0112-41)、F4/80(货号:12-0113-41)购自美国eBioscience公司。60%异丙醇(货号:IT7048)购自上海生工公司。细胞滤网(货号:352350)购自中国Corning公司,牛巴氏计数板(货号:717805)购自广州华奥瑞公司,C6流式细胞仪购自美国BD Biosciences公司,Bio-Rad CFX384荧光定量检测仪、q-PCR试剂盒(货号:1725140)购自美国Bio-Rad公司。
1.2 实验方法
1.2.1 骨髓细胞的获取及计数:颈椎脱臼法处死实验小鼠后抽取骨髓细胞。用 70μm孔径的细胞滤网过滤后加2倍体积红细胞裂解液冰上裂解10min,400g离心5min取沉淀。用10ml含15% L929培养液重悬细胞。吸取细胞悬液10μl,滴满牛巴氏计数板,10×10倍光镜下计数骨髓细胞数/ml[=(四大格内细胞总数/4)×104×稀释倍数]。
1.2.2 骨髓细胞培养及巨噬细胞鉴定:将上述骨髓细胞用15% L929培养液制成2×106/ml悬液,加入12孔板中(每孔1 ml)。37℃、5% CO2培养箱中培养3天后更换新培养基继续培养。6天后,用EDTA消化细胞,400g离心5min,PBS重悬后加入荧光抗体CD11b-PE和F4/80-FITC,常温暗室孵育10min。400g离心5min,取沉淀用100μl PBS重悬。上流式细胞仪检测培养细胞膜上标志蛋白CD11b、F4/80的表达(CD11b和F4/80双阳性为巨噬细胞)。本次培养骨髓细胞成功分化为巨噬细胞,其纯度为98.1%,见图1。
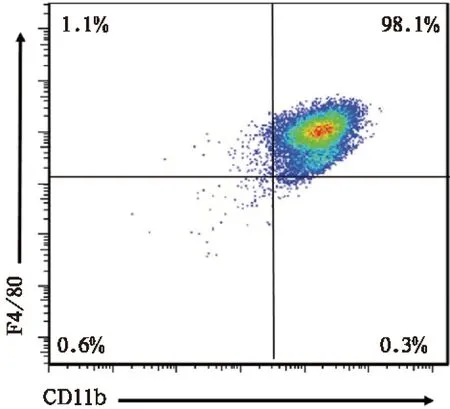
图1 骨髓细胞培养分化为巨噬细胞的流式细胞图
1.2.3 实验分组与处理:将成功分化的巨噬细胞用100%的IMDM培养液制成2×106/ml细胞悬液,加入不同浓度ox-LDL分成3组,包括空白对照组(0μg/ml)、10μg/ml组和25μg/ml组,混匀后加入12孔板,每组6个复孔,于37℃、5% CO2中培养箱中培养24h。
1.2.4 观察巨噬细胞泡沫化:取出12孔板,PBS洗2次后10%福尔马林固定30min,再用PBS洗2次后加入60%异丙醇,室温放置5min。每孔加入500μl油红染料(将30mg油红粉末溶于10ml异丙醇中制成),室温放置10min后,用去离子水洗2次,10×25倍光镜下观察,泡沫化巨噬细胞内聚集的脂滴经油红染料染成红色。随机选取10个视野,计数红染细胞,并计算百分率。
1.2.5 IL-1β和TNF-α mRNA检测:取出12孔板,PBS洗2次后,每孔加入500μl TRIzol裂解液,按常规方法提取细胞总RNA并测定RNA浓度,逆转录合成cDNA。
各种引物序列见表1。实时荧光定量PCR:反应体系共10μl,反应条件:94 ℃ 5min预变性,95 ℃ 45s,60 ℃ 1min,40个循环,以β-actin作为内参照同时设置空白对照。以PCR反应前3-15个循环的荧光信号作为荧光本底信号,调节基线至适宜处,各荧光曲线与基线交叉点的循环数即为Ct值。以ΔΔCt表示目的基因mRNA相对表达量,ΔΔCt=2-(Ct目的基因-Ctβ-actin),每组重复3次取平均值。
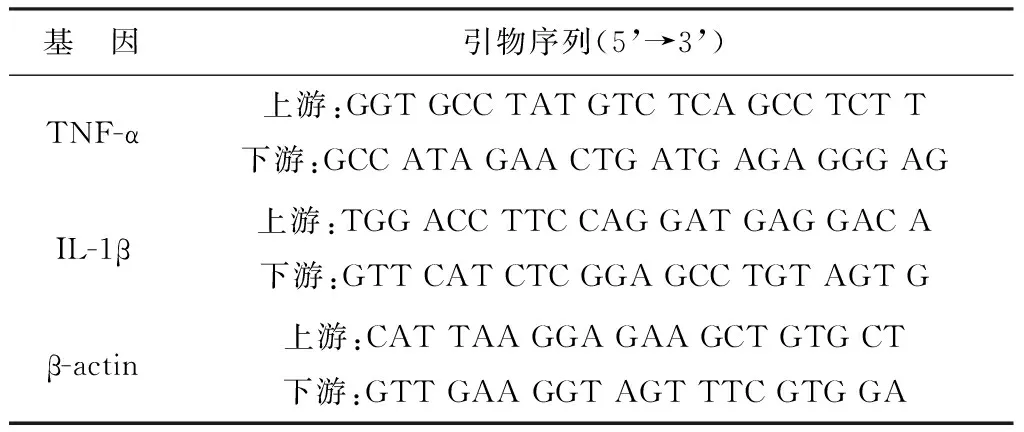
表1 各基因引物序列
1.3 统计学处理

2 结 果
2.1 各组巨噬细胞泡沫化程度
图2显示空白对照组红染巨噬细胞(即泡沫化巨噬细胞)较少,随着ox-LDL浓度增加,红染巨噬细胞增多,25μg/ml组明显多于10μg/ml组。定量分析表明三组间红染细胞百分率差异有统计学意义(F=1190,P<0.01)。与空白对照组(2.04%±0.17%)相比,10μg/ml组(13.34%±0.48%)和25μg/ml组(31.62%±0.55%)巨噬细胞泡沫化程度均显著增加(t=22.03和t=51.65,P均<0.01),且25μg/ml组巨噬细胞泡沫化程度又明显高于10μg/ml组(t=25.06,P<0.01)。
2.2 各组促炎因子水平
各组IL-1β和TNF-α的mRNA表达水平差异有统计学意义(P<0.05或P<0.01)。IL-1β mRNA水平,10μg/ml组与空白对照组差异无统计学意义(P>0.05);25μg/ml组较空白对照组和10μg/ml组显著降低(t值分别为3.58和3.60,均P<0.05)。TNF-α mRNA水平,与空白对照组比较,10μg/ml组显著下降(t=5.27,P<0.01);25μg/ml组TNF-α mRNA表达水平虽较10μg/ml组有所升高,但仍低于空白对照组(t=3.67,P<0.05)。见表2。
[本文图2见插1反面]
3 讨 论
泡沫细胞是AS斑块内出现的特征性病理细胞,可视为AS形成的标志。脂质斑块内,由于分泌Th2细胞因子的免疫细胞相对较少,AS的炎症反应是以Th1驱动为主的促炎反应[8]。在AS血管内膜,随着LDL的聚集,一些先天性和后天性免疫细胞渗透到血管内膜下,分泌一些细胞因子如IFN-γ、TGF-α,加速泡沫细胞的形成[9]。有研究[10,11]显示,巨噬细胞低效清除ox-LDL能促进自身和其它免疫细胞分泌促炎因子和化学因子,使更多免疫细胞被招募到内膜,加速炎症反应进程。但也有研究[12]显示,体内巨噬细胞源性泡沫细胞中促炎因子水平下调。Spann等[13]曾报道,巨噬细胞源性泡沫细胞可通过上调肝X受体(LXR)激活抗炎反应。

表2 各组细胞IL-1β和TNF-α mRNA水平比较均=3)
注:与空白对照组比较,1)P<0.05,2)P<0.01;与10μg/ml组比较,3)P<0.05
本文通过体外实验检测分析了ox-LDL对巨噬细胞泡沫化的影响。结果表明,10μg/ml和25μg/ml ox-LDL均能使巨噬细胞泡沫化,油红染色结果显示巨噬细胞内有大量的脂滴聚集。且以25μg/ml组泡沫化程度更高,提示较高水平ox-LDL更利于巨噬细胞泡沫化。另外,本文进一步检测了巨噬细胞源性泡沫细胞中促炎因子IL-1β和TNF-α mRNA表达水平。结果显示,与空白对照组比较,IL-1β mRNA的表达水平仅在25μg/ml组显著降低,TNF-α在10μg/ml组和25μg/ml组的表达水平均显著下降,表明泡沫细胞在10μg/ml ox-LDL处理时主要通过下调TNF-α来调节炎症反应进程,在25μg/ml ox-LDL处理时可同时通过下调IL-1β和TNF-α来影响炎症反应的进程。其具体机制有待继续深入研究。
综上所述,巨噬细胞源性泡沫细胞能显著降低促炎因子分泌,继而影响AS进程,为AS的治疗提供了依据。
◀
本文第一作者简介:
宋 辉(1987-),女,汉族,硕士研究生,研究方向为心血管疾病发生机制参考文献
1 McLaren JE, Michael DR, Ashlin TG, et al. Cytokines, macrophage lipid metabolism and foam cells: implications for cardiovascular disease therapy[J]. Prog Lipid Res, 2011, 50(4): 331-347.
2 Lusis AJ. Atherosclerosis[J]. Nature, 2000, 407(3): 233-241.
3 Zhang PY, Xu X, Li XC. Cardiovascular diseases: oxidative damage and antioxidant protection[J]. Eur Rev Med Pharmacol Sci, 2014, 18(20): 3 091-3 096.
4 Singh NN, Ramji DP. The role of transforming growth factor-beta in atherosclerosis[J]. Cytokine Growth Factor Rev, 2006 17(6): 487-499.
5 Paoli FD, Staels B, Chinetti-Gbaguidi G. Macrophage phenotypes and their modulation in atherosclerosis[J]. Circ J, 2014, 78(1): 1 775-1 781.
6 Moore KJ, Tabas I. Macrophages in the pathogenesis of atherosclerosis[J]. Cell, 2011, 145(3): 341-355.
7 Charo IF, Taubman MB. Chemokines in the pathogenesis of vascular disease[J]. Circ Res, 2004, 95(9): 858-866.
8 Hansson GK, Libby P. The immune response in atherosclerosis: a double-edged sword[J]. Nat Rev Immunol, 2006, 6(7): 508-519.
9 McLaren JE, Ramji DP. Interferon gamma: a master regulator of atherosclerosis[J]. Cytokine Growth Factor Rev, 2009, 20(2): 125-135.
10 Babaev VR, Chew JD, Ding L, et al. Macrophage EP4 deficiency increases apoptosis and suppresses early atherosclerosis[J]. Cell Metab, 2008, 8(6): 492-501.
11 Hamada M, Nakamura M, Tran MT, et al. MafB promotes atherosclerosis by inhibiting foam-cell apoptosis[J]. Nat Commun, 2014, 5(3): 3 147.
12 Lee WR, Kim KH. Regulation of an inflammatory disease: Kr ppel-like factors and atherosclerosis[J]. Basic Clin Phamacol Toxicol, 2013, 112(4): 236-243.
13 Spann NJ, Garmire LX, McDonald JG, et al. Regulated accumulation of desmosterol integrates macrophage lipid metabolism and inflammatory responses[J]. Cell, 2012, 151(1): 138-152.
Effect of Macrophage Derived Foam Cell on Inflammatory Responses
SONG Hui, YANG Fang#
Department of Physiology, Basic Medical School, Wuhan University, Wuhan 430079, China;#
Objective: To investigate the effect of macrophage derived foam cell on inflammatory responses.Method: Bone marrow cells from 6-8 weeks’ male C57BL/6J mice were treated with L929 for macrophage differentiation for 6 days. Then macrophage was treated with different concentration of oxidized low-density lipoprotein (ox-LDL),divided into 3 groups: control group(0μg/ml),10μg/ml group and 25μg/ml group. The macrophage derived foam cells were stained by oil red O and the mRNA expression of pro-inflammatory cytokines IL-1β and TNF-α were measured by Real-time PCR.Results: The monocytes of bone marrow cells differentiated to macrophages successfully. Different concentration of oxLDL induced the foam cell formation and the effect of 25μg/ml group was greater than 10μg/ml group (P<0.01). Comparing to the control group, the mRNA expression of pro-inflammatory cytokines IL-1β and TNF-α was significantly decreased in 25μg/ml group (P<0.05).Conclusion: Macrophage derived foam cells have inhibitional effect on inflammatory responses.
Macrophage; Foam cell; Pro-inflammatory cytokines; Mice
国家自然科学基金(31170328, 30900122)
武汉大学基础医学院生理学系,武汉 430079;#
,E-mail:fang-yang@whu.edu.cn
本文2014-12-08收到,2015-01-13修回
R543.1
A
1005-1740(2015)02-0019-04

