调节性B细胞在癌症中的研究进展
张 天(综述),孙素红(审校)
(1.遵义医学院附属医院甲乳外科,贵州 遵义 563000; 2.贵州省免疫学研究生教育创新基地,贵州 遵义 563000)
调节性B细胞在癌症中的研究进展
张天1,2△(综述),孙素红1※(审校)
(1.遵义医学院附属医院甲乳外科,贵州 遵义 563000; 2.贵州省免疫学研究生教育创新基地,贵州 遵义 563000)
摘要:B淋巴细胞是人体特异性免疫的重要组成部分,其主要功能是抗原呈递以及分泌抗体。新近研究发现,调节性B细胞(Bregs)通过分泌白细胞介素10和转化生长因子β1等细胞因子作用于免疫系统,在炎症、自身免疫性疾病以及癌症进展、转归和预后中发挥作用。了解Bregs在癌症中的作用机制对临床治疗癌症具有重要意义。该文就Bregs与癌症的关系及其研究进展予以综述。
关键词:癌症;调节性B细胞;肿瘤免疫
癌症是当前严重影响人类健康、威胁人类生命的主要疾病之一。与调节性T细胞(regulatory T cells,Tregs)相似,人体中也存在着调节性B细胞(regulatory B cells,Bregs),通过分泌多种细胞因子,如白细胞介素10(interleukin 10,IL-10)和转化生长因子β1(transforming growth factor β1,TGF-β1)等对免疫系统产生影响,在炎症、自身免疫性疾病以及癌症中发挥作用。目前国内外对癌症中Bregs的作用机制研究取得较大进展,引入以Bregs为靶点的治疗联合化疗或激素疗法可能为癌症的治疗提供新的线索和方法。现就Bregs在癌症中的研究进展予以综述。
1Bregs简述
正常机体免疫系统受到多种因子的调控作用,以防止免疫耐受或应答过强从而对机体造成损伤。B淋巴细胞因能够识别抗原并产生相应的抗体,在机体免疫调节中发挥重要作用。已有研究证实人体中存在Tregs,如 CD4+CD25+Tregs、Tr1细胞、Th3细胞,通过产生IL-10、TGF-β1等参与机体免疫应答调节机制。同时人们猜测机体也可能存在类似于Tregs的B细胞,Bregs因此而受到研究者们的广泛关注。
1996年,Wolf等[1]在研究诱导实验性自身免疫性脑脊髓炎小鼠模型时发现,与具有自愈倾向的野生型(WT)实验性自身免疫性脑脊髓炎小鼠相比,在B细胞缺陷小鼠(μMT)体内诱导实验性自身免疫性脑脊髓炎可使疾病恶化,研究结果表明小鼠体内可能存在对炎症具有调节性作用的B细胞亚群。紧接着,Mizoguchi等[2]在结肠炎小鼠模型实验中首次证明Bregs的存在。近年来,越来越多的研究发现并证实B细胞存在具有调节功能的亚群,这部分B细胞被命名为Bregs,主要功能是产生IL-10或TGF-β1等细胞因子,分别称为产IL-10的Br1细胞或 TGF-β1的Br3细胞[3-5],与免疫细胞相互作用,可抑制炎性反应、参与自身免疫性疾病以及在癌症进展、转归、预后中发挥重要调控作用[6-7]。目前,Bregs的来源仍未阐明,在癌症中的免疫调节作用机制十分复杂且研究结果尚不充分,因此了解Bregs在癌症中的作用机制对临床治疗癌症以及预后评估具有重要意义,值得深入研究。
2Bregs与癌症
2.1Bregs在癌症中的表达情况及影响新近研究证实Bregs具有负性免疫调节作用,其中能够产生抗炎细胞因子IL-10的Bregs为Br1,Br1可与体内T细胞相互作用调节免疫反应,参与过敏和自身免疫性疾病、癌症、感染和移植排斥反应。重要的是,Br1细胞在抗肿瘤免疫反应中起关键调节作用,并且能够对单克隆抗体的治疗效果产生影响[8]。有学者对宫颈癌患者Br1的数量及血浆IL-10的关系进行研究发现,Br1和IL-10明显升高,提示 Br1细胞与宫颈癌的发生、发展可能存在着一定的关系,结果表明宫颈癌患者外周血中Br1亚群所占比例增多,且与癌症分化程度呈反比,Br1数量并随癌细胞浸润程度的增强而增加[9]。随后研究发现在食管癌中也存在相同的情况,结果显示食管癌临床分期越晚,其免疫功能越低,Br1表达量增加就越多[10]。
同时,Inoue等[11]发现在小鼠体内去除B细胞后,小鼠抗肿瘤免疫反应有所增强,猜测与B细胞分泌的IL-10大量减少有关。并且在诱导肿瘤的小鼠模型中,消除Bregs可同样增强抗肿瘤免疫反应能力,研究结果证实消除B细胞不但能增加抗肿瘤免疫,而且Br1细胞产生的IL-10在肿瘤发生、发展中发挥重要作用[12]。以上实验结果为深入了解Br1细胞参与肿瘤的异常免疫反应和相应疾病的治疗提供了一定的理论研究基础。
2.2Bregs在癌症中可能的作用机制目前已知癌症中Tregs数量增加以及向癌区募集可促进癌细胞的免疫逃逸效应,上调Tregs的相关因素十分复杂且尚未被阐明。Olkhanud等[13]通过对乳腺癌4T1小鼠模型研究发现除肿瘤细胞本身可诱导Tregs外,还可诱导肿瘤相关Bregs(tBreg),即B2细胞(CD19+CD25highCD69high),具有信号转导与转录激活因子(Stat3)持续活性以及B7-H1highCD81highCD86highCD62lowIgM(Int)特征,还可通过TGF-β诱导FoxP3+Treg活化进而加速癌细胞肺转移,表明Bregs是参与癌细胞转移的关键因素之一。
Bregs产生IL-10虽然能对自身免疫性疾病起到抑制作用,但Breg上调通过IL-10/IL-10受体以及程序性凋亡因子等途径会降低机体抗感染能力、加速疾病进展以及抑制CD4+T细胞功能,促进静息T细胞向Treg转化。相关研究表明[14],IL-35可诱导Bregs并向产生IL-35和IL-10的亚群转化,重组IL-35诱导Breg过继入IL-35缺陷葡萄膜炎小鼠模型后,Th17和Th1受到抑制,但是Treg数量则有所扩增。研究发现,IL-35可与B细胞表面由IL-12Rβ2和IL-27Rα构成的IL-35受体相互作用,激活STAT1、STAT3,从而促使B细胞向Bregs发生转化[15]。Sattler 等[16]则发现,IL-33同样具有促进Breg、抑制细胞免疫功能和增殖的作用,提示IL-10、IL-33、IL-35等在癌症中同样具有促进Breg的作用,进而加速疾病进展。Schioppa 等[17]发现,Breg通过旁路途经形成肿瘤坏死因子α,调控7,12-二甲苯 [α]蒽/对苯二酸-诱导鳞状上皮癌,抑制抗肿瘤免疫活动。癌症中,B细胞产生肿瘤特异性抗体减弱了肿瘤免疫防御能力;另一方面B细胞在一定程度上对肿瘤起到促进作用,如CD1dhighCD5+B细胞、B1b(CD5-CD1dhighB220lowCD11b+IgM+)、CD19+CD24highCD38highB细胞[18-20],这些Bregs通过释放淋巴毒素等细胞因子、调控激素活性和信号转导通路STAT3等,干扰机体肿瘤抗原呈递细胞和T/B细胞的相互作用(图1)[21]。
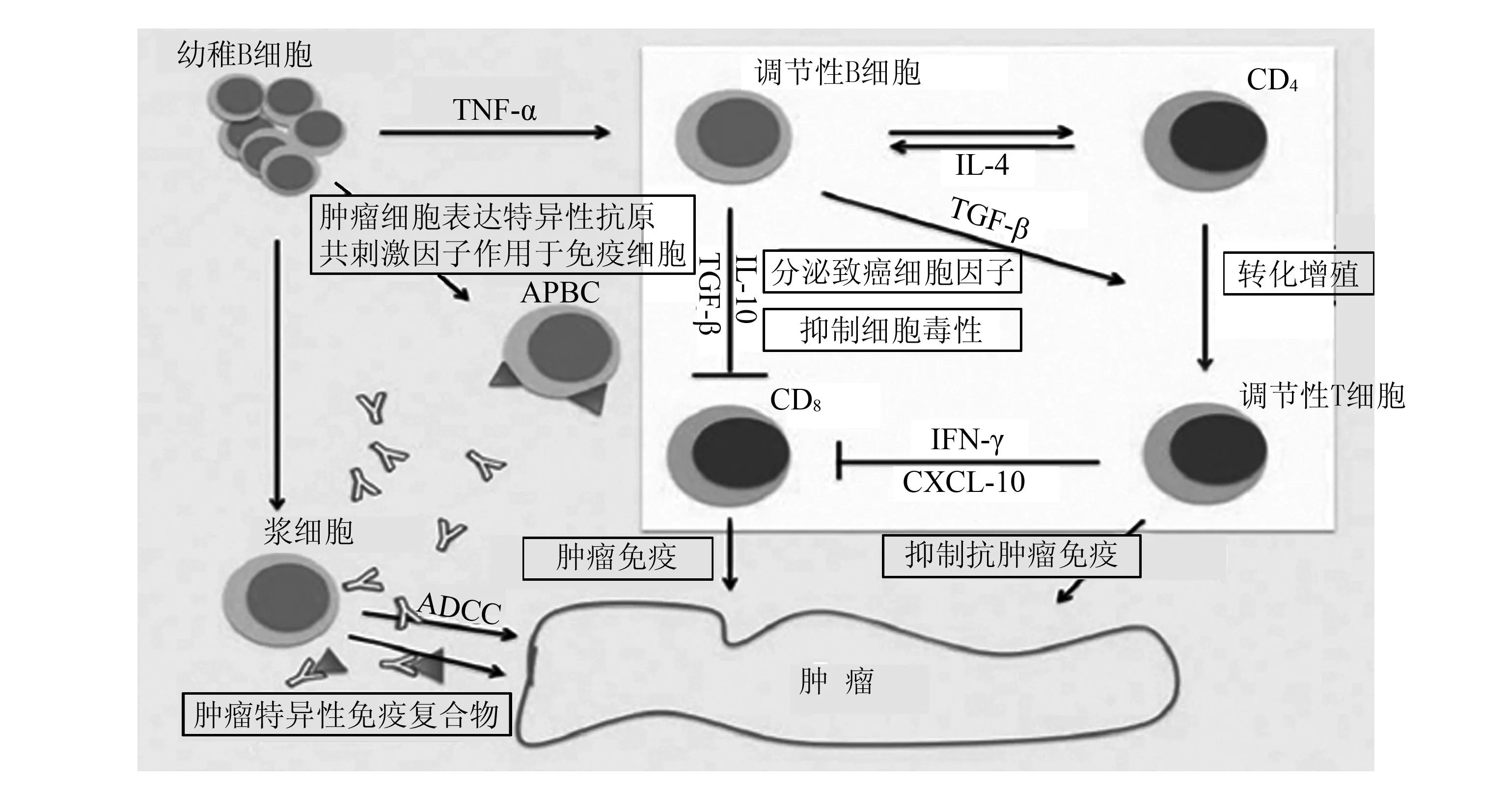
TNF-α:肿瘤坏死因子α;ADCC:抗体依赖细胞介导的细胞毒作用;IL-10:白细胞介素10;IL-4:白细胞介素4;TGF-β:转化生长因子β;IFN-γ:干扰素γ;CXCL-10:干扰素伽玛诱导的10×103蛋白;APBC: B抗原呈递细胞图1 B细胞在致癌作用和肿瘤进展中的影响
2.3以Bregs为靶点的癌症治疗方法既然Bregs是肿瘤免疫过程中重要的参与者,并且具有抑制机体抗肿瘤免疫的功能,那么是否能通过抑制Bregs来治疗癌症也引起了研究者的注意,Wejksza等[22]研究发现5-脂肪氧合酶途径,如白三烯B4可刺激活化B细胞过氧化物酶体增殖物激活受体α,引起脂肪酸氧化,抑制tBreg,减轻乳腺癌模型小鼠肺转移情况,推测应用过氧化物酶体增殖物激活受体α靶向药物可控制tBreg引起的癌细胞逃逸。有资料显示,表达Bregs的乳腺癌4T1小鼠产生CD20抗体可进一步消耗B细胞,体内应用CXCL13-coupled CpG寡核苷酸上调tBreg低表达的4-1BBL增强B细胞与CD8+T细胞相互作用,增强细胞免疫应答,抑制CD20lowtBreg增殖,从而阻止肿瘤转移,实验结果提示诱导tBreg失活可提高癌症治疗效果以及刺激机体免疫系统[23]。随后的研究发现,低剂量植物多酚白藜芦醇可作用于免疫细胞,具有灭活STAT3、下调TGF-β表达水平、抑制tBreg等功能,从而防治肿瘤细胞逃逸[24]。
3展望
目前相关研究显示,Bregs在自身免疫性疾病、感染性疾病和癌症等中均发挥作用,尤其在癌症的发生、发展中具有调控免疫系统、加速肿瘤转移的作用受到越来越多研究者们的关注。深入了解Bregs的来源及可能的作用机制可为癌症的治疗提供新参考、新思路。然而,促进Bregs成熟分化过程的相关因素有哪些?Bregs是否存在更多亚群和功能作用?是否能够在常规手术、放/化疗、激素治疗肿瘤的同时,通过药物靶向抑制肿瘤中促进Bregs的细胞因子或信号转导途径,有选择性地抑制Bregs功能,进而降低癌细胞转移概率以使患者获得更好的治疗效果?这些都值得研究,相信通过对 Breg 作用机制的不断深入了解,能够为临床治疗 Breg相关疾病提供更好的理论数据参考。
参考文献
[1]Wolf SD,Dittel BN,Hardardottir F,etal.Experimental autoimmune encephalomyelitis induction in genetically B cell-deficient mice[J].J Exp Med,1996,184(6):2271-2278.
[2]Mizoguchi A,Mizoguchi E,Smith RN,etal.Suppressive role of B cells in chronic colitis of T cell receptor α mutant mice[J].J Exp Med,1997,186(10):1749-1756.
[3]Yanaba K,Bouaziz JD,Matsushita T,etal.The development and function of regulatory B cells expressing IL-10 (B10 cells)requires antigen receptor diversity and TLR signals[J].J Immunol,2009,182(12):7459-7472.
[4]Parekh VV,Prasad DV R,Banerjee PP,etal.B cells activated by lipopolysaccharide, but not by anti-Ig and anti-CD40antibody,induce anergy in CD8+T cells:role of TGF-β1[J].J Immunol,2003, 170(12):5897-5911.
[5]Lee JH,Noh J,Noh G,etal.Allergen-specific transforming growth factor-β-producing CD19+CD5+regulatory B-cell (Br3) responses in human late eczematous allergic reactions to cow′s milk[J].J Interferon Cytokine Res,2011,31(5):441-449.
[6]Rosser EC,Blair PA,Mauri C.Cellular targets of regulatory B cell-mediated suppression[J].Mol Immunol,2014,62(2):296-304.
[7]Shi L,Bi M,Yang R,etal.Defective expression of regulatory B cells in iodine-induced autoimmune thyroiditis in non-obese diabetic H-2h4 mice[J].J Endocrinol Invest,2014,37(1):43-50.
[8]Candando KM,Lykken JM,Tedder TF.B10 cell regulation of health and disease[J].Immunol Rev,2014,259(1):259-272.
[9]高峻.宫颈癌患者外周血调节性B细胞亚群的检测及临床意义[J].中国社区医师:医学专业,2011,13(16):227-228.
[10]石家振,李世宝,周彦.食管癌患者外周血中调节性B细胞检测的临床意义[J].南京医科大学学报:自然科学版,2013,33(2):1042-1044.
[11]Inoue S,Leitner WW,Golding B,etal.Inhibitory effects of B cells on antitumor immunity[J].Cancer Res,2006,66(15): 7741-7747.
[12]Duan B,Morel L.Role of B-1a cells in autoimmunity[J].Autoimmun Rev,2006,5(6):403-408.
[13]Olkhanud PB,Damdinsuren B,Bodogai M,etal.Tumor-evoked regulatory B cells promote breast cancer metastasis by converting resting CD4+T cells to T-regulatory cells[J].Cancer Res,2011,71(10):3505-3515.
[14]Siewe B,Wallace J,Rygielski S,etal.Regulatory B cells inhibit cytotoxic T lymphocyte (CTL) activity and elimination of infected CD4T cells after in vitro reactivation of HIV latent reservoirs[J].PLoS One,2014,9(4):e92934.
[15]Wang RX,Yu CR,Dambuza IM,etal.Interleukin-35 induces regulatory B cells that suppress autoimmune disease[J].Nat Med, 2014,20(6):633-641.
[16]Sattler S,Ling GS,Xu D,etal.IL-10-producing regulatory B cells induced by IL-33 (Breg(IL-33)) effectively attenuate mucosal inflammatory responses in the gut[J].J Autoimmun,2014,50:107-122.
[17]Schioppa T,Moore R,Thompson RG,etal.B regulatory cells and the tumor-promoting actions of TNF-α during squamous carcinogenesis[J].Proc Natl Acad Sci U S A,2011,108(26):10662-10667.
[18]Yanaba K,Bouaziz JD,Haas KM,etal.A regulatory B cell subset with a unique CD1dhighCD5+phenotype controls T cell-dependent inflammatory responses[J].Immunity, 2008,28(5):639-650.
[19]Shimomura Y,Mizoguchi E,Sugimoto K,etal.Regulatory role of B-1 B cells in chronic colitis[J].Int Immunol,2008,20(6): 729-737.
[20]Mizoguchi A,Mizoguchi E,Takedatsu H,etal.Chronic intestinal inflammatory condition generates IL-10-producing regulatory B cell subset characterized by CD1dupregulation[J].Immunity,2002,16(2):219-230.
[21]Fremd C,Schuetz F,Sohn C,etal.B cell-regulated immune responses in tumor models and cancer patients[J].Oncoimmunology,2013,2(7):e25443.
[22]Wejksza K,Lee-Chang C,Bodogai M,etal.Cancer-produced metabolites of 5-lipoxygenase induce tumor-evoked regulatory B cells via peroxisome proliferator-activated receptor α[J].J Immunol,2013,190(6):2575-2584.
[23]Bodogai M,Chang CL,Wejksza K,etal.Anti-CD20antibody promotes cancer escape via enrichment of tumor-evoked regulatory B cells expressing low levels of CD20and CD137L[J].Cancer Res,2013,73(7):2127-2138.
[24]Lee-Chang C,Bodogai M,Martin-Montalvo A,etal.Inhibition of breast cancer metastasis by resveratrol-mediated inactivation of tumor-evoked regulatory B cells[J].J Immunol, 2013,191(8):4141-4151.
《医学综述》杂志在《中国科技期刊引证报告》核心版与扩刊版(同类期刊)中的指标排名
《医学综述》杂志在《中国科技期刊引证报告》核心版所有学科中的指标排名
临床医学
Research Progress of Regulatory B Cells in CancerZHANGTian1,2,SUNSu-hong1.(1.DepartmentofBreastSurgery,ZunyiMedicalCollegeAffiliatedHospital,Zunyi563000,China; 2.GuizhouProvincialImmunologyInnovationBaseofPostgraduateEducation,Zunyi563000,China)
Abstract:B lymphocytes are an important part of the specific immune in the body,and its main function is to present antigen and secrete antibody.Recent studies have found that,Bregs act on the the immune system through the secretion of IL-10 and TGF-β1cytokines, and play a role in inflammation,autoimmune disease,and cancer progression,outcome and prognosis. Understanding the role of Bregs in cancer mechanism is of great significance to the clinical treatment.Here is to make a review of the research progress in the relationship between the Bregs and cancer.
Key words:Cancer; Regulatory B cells; Tumor immunity
收稿日期:2014-06-06修回日期:2014-09-23编辑:伊姗
基金项目:贵州省遵义市政红花岗区2010科学技术项目和教育部新世纪人才项目(NCET-10-0095)
doi:10.3969/j.issn.1006-2084.2015.02.016
中图分类号:R392
文献标识码:A
文章编号:1006-2084(2015)02-0236-03

