罗格列酮逆转丝裂霉素对人胃癌SGC7901/VCR祼鼠移植瘤耐药作用的研究
廖文秋 张 琍 李国庆 刘小叶
罗格列酮逆转丝裂霉素对人胃癌SGC7901/VCR祼鼠移植瘤耐药作用的研究
廖文秋张琍李国庆刘小叶
【摘要】目的探讨PPARγ激动剂罗格列酮(ROS)逆转人胃癌SGC7901/VCR细胞裸鼠移植瘤对丝裂霉素(MMC)的耐药作用及其可能机制。方法建立人胃癌SGC7901/VCR细胞裸鼠移植瘤模型,将48只裸鼠随机分为6组:空白对照组(生理盐水0.2 ml)、MMC组(MMC 2.5 mg/kg)、ROS组(ROS 100 mg/kg)、MMC+ROS中剂量组(MMC 2.5 mg/kg+ROS 50 mg/kg)、MMC+ROS高剂量组(MMC 2.5 mg/kg+ROS 100 mg/kg)、MMC+CSA组(MMC 2.5 mg/ kg+CSA 50 mg/kg)。每组8只裸鼠;用药40天后,观察各组裸鼠体重和移植瘤体积变化,计算抑瘤率,绘制移植瘤的生长曲线;Western-blot法检测P-gp和MGr1-Ag蛋白的表达。结果空白对照组、MMC组移植瘤瘤体积和抑瘤率差异无显著性,ROS组、MMC+ROS中剂量组、MMC+ROS高剂量组组、MMC+CSA组与空白对照组、MMC组比较,移植瘤瘤体积和抑瘤率差异有显著性。空白对照组、MMC组中P-gp、MGr1-Ag蛋白表达最强,ROS组、MMC+ROS中剂量组、MMC+ROS大剂量组、MMC+CSA组与空白对照组和MMC组P-gp、MGr1-Ag蛋白表达比较有统计学意义(P<0.05),MMC+ROS大剂量组、MMC+CSA组中其表达最弱,组间差异无统计学意义(P>0.05)。结论罗格列酮可抑制人胃癌SGC7901/VCR细胞祼鼠移植瘤瘤体生长,罗格列酮可下调人胃癌SGC7901/VCR细胞裸鼠移植瘤组织中P-gp和MGr1-Ag蛋白的表达。罗格列酮可部分逆转人胃癌SGC7901/VCR细胞祼鼠移植瘤对丝裂霉素的耐药性。
【关键词】罗格列酮;多药耐药;移植瘤;P-gp蛋白;MGr1-Ag蛋白
(ThePracticalJournalofCancer,2015,30:0006~0009)
肿瘤的多药耐药性(multidrugresistance,MDR)是肿瘤化疗失败的重要原因。P糖蛋白(P-glycolprotein,P-gp)的过度表达是MDR产生的主要原因[1],MGr1-Ag是近发现一个新的耐药相关分子[2]。寻找能有效逆转MDR的逆转剂是当前肿瘤化疗亟待解决的难题。罗格列酮是过氧化物酶体增殖因子活化受体(peroxisome proliferateration-activated receptor gamma,PPARγ)激动剂,调控细胞周期、抑制炎症反应、诱导肿瘤细胞分化和凋亡等作用[3]。近年来发现罗格列酮还能逆转肿瘤多药耐药[4-5]。目前这些研究大部分在体外。本研究旨在模拟人体内肿瘤生长环境,探讨罗格列酮逆转肿瘤多药耐药的作用及其机制,为临床罗格列酮治疗多药耐药肿瘤患者提供一定的理论依据。
1材料与方法
1.1材料
1.1.1细胞株和动物人胃癌多药耐药细胞株SGC7901/VCR购自中南大学肿瘤研究所;6~8周龄雄性BABL/c小鼠,48只、A级,许可证号:SCXK(沪)2012-0005(上海斯莱克实验动物有限责任公司)。
1.1.2主要试剂RPMI-1640培养基购于Gibco BRL公司;长春新碱为深圳万乐有限公司生产;罗格列酮购于武汉远城科技发展有限公司;丝裂霉素购于浙江海正药业股份有限公司。P-gp抗体购于美国Santa Cruz公司;Anti—MGr1-Ag/37LRP购于北京博奥森生物技术有限公司。
1.2实验方法
1.2.1细胞培养SGC7901/VCR细胞置于含1 mg/L长春新碱(VCR)的10%小牛血清RPMI-1640培养基中培养维持耐药,置于37℃、95%饱和湿度、含5%CO2孵箱中培养,每1~2天换一次液,于细胞80%汇合时,用0.25%的胰酶细胞消化液消化,1∶2或1∶3传代一次。实验前2周撤除VCR。
1.2.2动物实验将人胃癌SGC7901/VCR细胞收集后接种于裸鼠背部皮下,观察移植后裸鼠的成瘤情况,术后两周将48只成瘤裸鼠随机分为6组:空白对照组(生理盐水0.2 ml灌胃)、MMC组(MMC 2.5 mg/ kg腹腔注射)、ROS组(ROS 100 mg/ kg灌胃)、MMC+ROS中剂量组(MMC 2.5 mg/ kg腹腔注射+ROS 50 mg/ kg灌胃)、MMC+ROS高剂量组(MMC 2.5 mg/ kg腹腔注射+ROS 100 mg/ kg灌胃)、MMC+CSA组(MMC 2.5 mg/ kg腹腔注射+CSA 50 mg/ kg灌胃)。每组8只裸鼠;待移植瘤体积长至约100 mm3时开始分别给每组裸鼠灌胃给药(均为1次/2天),每5天分别测量每只裸鼠移植瘤的体积,40天后处死动物,计算抑瘤率,并据此绘制移植瘤的生长曲线。肿瘤体积=(长径×短径2)/2;抑瘤率=(对照组肿瘤体积-实验组肿瘤体积)/对照组肿瘤体积×100%。
1.2.3Western蛋白印迹检测裸鼠移植瘤中P-gp和MGr1-Ag蛋白表达取80 mg移植瘤组织,加入1 ml Trizol和0.5 μl PMSF,用研磨器反复研磨,离心后上清液即用于测定总蛋白,BCA法测定蛋白质的浓度,微量加样器吸取煮好的蛋白(25 μl)上样,SDS-PAGE电泳,转膜,5%脱脂奶粉室温封闭1 h后,TBST洗膜,每次15 min,共3次,加入一抗工作液 (兔抗人P-gp1∶400、兔抗人Anti--MGr1-Ag/37 LRP 1∶400),4℃孵育过夜。次日TBST洗膜,每次15 min,共3次,加二抗HRP标记IgG(山羊抗兔1∶6 000);室温孵育60 min,用TBST洗膜,每次15 min,共3次。然后加入化学发光剂,再放入暗盒并压片,显影、定影。将胶片进行扫描或拍照,用凝胶图像处理系统分析目标带的分子量和净光密度值,以目的条带与内参照条带比值代表蛋白表达水平。
1.3统计学分析

2结果
2.1各组裸鼠移植瘤体积变化(表1)
与空白对照组比较,MMC组移植瘤体积差异无显著性(P>0.05)。ROS组、MMC+ROS中剂量组、MMC+ROS高剂量组及MMC+CSA组与空白对照组和MMC组比较,移植瘤体积均明显缩小(P均<0.05),其中以MMC+ROS高剂量组、MMC+CSA组的体积缩小最明显。由表1及图1可看出,丝裂霉素对移植瘤生长无明显抑制作用(P>0.05),罗格列酮或丝裂霉素联合罗格列酮或环孢霉素A对移植瘤生长有抑制作用(P<0.05),MMC+ROS高剂量组和MMC+CSA组的抑制作用最强,罗格列酮抑制移植瘤的作用呈剂量依赖关系。
2.2Western蛋白印迹检测裸鼠移植瘤中P-gp和MGr1-Ag蛋白表达
各组裸鼠移植瘤P-gp/β-actin值分别为(0.83±0.02)、(0.82±0.02)、(0.78±0.03)、(0.69±0.03)、(0.63±0.05)、(0.60±0.03)。各组裸鼠移植瘤MGr1-Ag/β-actin值分别为(1.04±0.04)、(1.02±0.04)、(0.97±0.04)、(0.92±0.03)、(0.86±0.03)、(0.83±0.03)。P-gp和MGr1-Ag蛋白表达以空白对照组最高,MMC组与空白对照组比较差异无统计学意义(P>0.05),ROS组、MMC+ROS中剂量组、MMC+ROS高剂量组、MMC+CSA组与空白对照组和MMC组比较差异有统计学意义(P<0.05);MMC+ROS高剂量组、MMC+CSA组P-gp和MGr1-Ag蛋白表达最低,组间差异无统计学意义(P>0.05),见图2。

表1 各组移植瘤体积及抑瘤率情况±s)
注:a为P>0.05,与空白对照组比较;b为P<0.05,与空白对照组、MMC组比较;c为P<0.05,与ROS组比较;d为P<0.05,与MMC+ROS中剂量组比较;e为P>0.05,与MMC+ROS高剂量组比较。
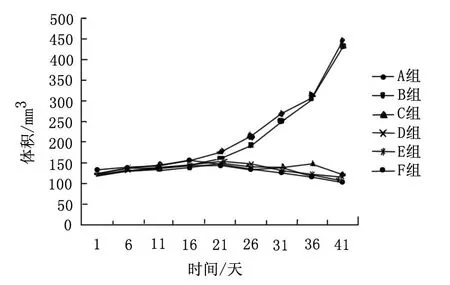
A组为空白对照组;B组为MMC组;C组为ROS组;D组为MMC+ROS中剂量组;E组为MMC+ROS高剂量组;F组为 MMC+CSA组。
图1各组移植瘤生长曲线图
3讨论
肿瘤多药耐药的机制是多因素、多途径综合作用的结果,MDR 形成的机制异常复杂,研究表明由MDR1编码的P-gp的过度表达所介导的耐药是经典的耐药途径[4]。近年研究[6]表明,MDR1/P-gp 高表达和凋亡抑制是化疗药物诱发肿瘤细胞MDR的主要机制。P-gp是1种跨膜糖蛋白,由1 280个氨基酸残基组成,分子量为170 kD,是一个能量依赖性的药物排出泵,通过ATP水解供能,逆浓度梯度将药物泵出细胞外,导致细胞内药物浓度降低而产生耐药。樊代明等[2,7]在胃癌细胞多药耐药性研究中,发现一个新的耐药相关分子MGr1-Ag。MGr1-Ag是1种表观分子量约为42 kD,等电点约为4.8,抗原表位由氨基酸构成的蛋白质,单克隆抗体MGr1-Ag能部分逆转SGC7910/VCR细胞对ADM、VCR、5-Fu的耐药性,明显增加SGC7901/VCR细胞对ADM的蓄积和潴留。Sun等[8]发现MGr1-Ag可通过上调MRP,下调凋亡相关基因bcl、bax的表达,从而减少胞内药物蓄积,抑制药物诱导的凋亡作用。Liu 等[9]发现MGr1-Ag 基因所编码的氨基酸序列与人37 kD 层粘连蛋白受体前体蛋白(37LRP)的氨基酸序列完全相同。缺氧诱导的胃癌耐药与上调MGr1-Ag的表达有关,抑制HIF-1的表达能够明显抑制缺氧诱导的MGr1-Ag的mRNA和蛋白水平。

1为空白对照组;2为MMC组;3为ROS组;4为MMC+ROS中剂量组;5为MMC+ROS高剂量组;6为MMC+CSA组。
图2Western blot检测结果
已有研究证实环孢霉素及其衍生物在体内体外能逆转MDR作用[10]。目前多药耐药的逆转剂多存在体内活性小,毒副作用大的缺点,理想的MDR 逆转剂应具有毒副作用低而本身有抗癌活性特点。罗格列酮是过氧化物酶体增殖因子活化受体(peroxisome proliferateration-activated receptor gamma,PPARγ)激动剂,有文献[11]报道罗格列酮能抑制癌细胞增殖及促进其凋亡的作用。文澜等[12]研究说明罗格列酮能抑制肿瘤的生长转移和血管发生,此外,罗格列酮可以通过下调某些肿瘤细胞P-gP蛋白的表达,从而逆转由MDR1所介导的肿瘤多药耐药[5]。这些研究提示罗格列酮有可能作为某些化疗药物的增敏剂而逆转肿瘤的多药耐药。本实验应用罗格列酮联合MMC对人胃癌SGC7901/VCR裸鼠移植瘤模型进行干预处理:发现空白对照组、MMC组肿瘤体积增长明显,ROS组、ROS联合MMC组及CSA联合MMC组瘤体增长相对缓慢,差异有统计学意义(P<0.05)。通过Western blot检测P-gp和MGr1-Ag蛋白的表达,发现ROS联合MMC组和CSA联合MMC组P-gp 和MGr1-Ag蛋白的表达明显降低,与空白对照组、MMC组比较差异有统计学意义(P<0.05)。推测ROS可能通过下调P-gp和MGr1-Ag蛋白的表达,减少了细胞膜上P-gp的数量,影响了其功能,阻止了药物的外排,从而使细胞内药物浓度得以提高,达到杀灭肿瘤细胞的药物浓度,逆转了肿瘤耐药。
本组研究提示人胃癌SGC7901/VCR裸鼠移植瘤对MMC耐药,ROS和CSA能逆转人胃癌SGC7901/VCR裸鼠移植瘤对MMC耐药性,可能为临床逆转胃癌化疗耐药提供新的途径,我们认为不良反应较少的ROS对于逆转胃癌多药耐药性具有重要意义,但ROS逆转MDR调控机制有待进一步探讨。
参考文献
[1]Yin Y,Li W,Deng M,et al.Extracellular high mobility group box chromosomal protein 1 promotes drug resistance by increasing the expression of P-glycoprotein expression in gastric adenocarcinoma cells〔J〕.Mol Med Rep,9(4):1439-1443.
[2] Shi Y,Han Y,Wang X,et al.MGr1-Ag is associated with multidrug-resistant phenotype of gastric cancer cells〔J〕.Gastric Cancer,2002,5(3):154-159.
[3]Ramachandran L,Manu KA,Shanmugam MK,et al.Isorhamnetin inhibits proliferation and invasion and induces apoptosis through the modulation of peroxisome proliferator-activated receptor γ activation pathway in gastric cancer〔J〕.J Biol Chem,2012,287(45):38028-38040.
[4]胡剑峰,张琍.罗格列酮逆转丝裂霉素对人胃癌SGC7901 /VCR细胞株耐药的作用的影响〔J〕.实用癌症杂志,2013,28(1):1-4.
[5]Zhang L,Hu JF,Li GQ,et al.Rosiglitazone reverses mitomycin C resistance in human gastric cancer cells〔J〕.2012,343(5):382-387.
[6]Kovalev AA,Tsvetaeva DA,Grudinskaja TV.Role of ABC-cassette transporters (MDR1,MRP1,BCRP) in the development of primary and acquired multiple drug resistance in patients with early and metastatic breast cancer 〔J〕.Exp Oncol,2013,35(4):287-290.
[7]Liu L,Zhang H,Sun L,et al.ERK/MAPK activation involves hypoxia-induced MGr1-Ag/37LRP expression and contributes to apoptosis resistance in gastric cancer〔J〕.Int J Cancer,2010,127(4):820-829.
[8]Sun L,Shi Y,Guo C,et al.Regulation of multidrug resistance by mGr1-antigen in gastric cancer cells〔J〕.Tumor Biol,2006,27(1):27-35.
[9]Liu L,Sun L,Zhang H,et al.Hypoxia-mediated up-regulation of MGr1-Ag/37LRP in gastric cancers occurs via hypoxia-inducible-factor 1-dependent mechanism and contributes to drug resistance 〔J〕.Int J Cancer,2009,124(7):1707-1715.
[10]Qadir M,O'Loughlin KL,Fricke SM,et al.Cyclosporin a is a broad-spectrum multidrug resistance modulator〔J〕.Clin Cancer Res,2005,11(6):2320-2326.
[11]Cerquetti L,Sampaoli C,Amendola D,et al.Rosiglitazone induces autophagy in H295R and cell cycle deregulation in SW13 adrenocortical cancer cells〔J〕.Exp Cell Res,2011,317(10):1397-1410.
[12]文澜,张琍,李国庆,等.罗格列酮联用维甲酸抗胃癌裸鼠移植瘤血管生成的研究〔J〕.中华消化杂志,2006,26(10):670-674.
(编辑:吴小红)
Research on Rosiglitazone Reversal Mitomycin C on Drug Resistance of Nude Mice
Xenografts of Human Gastric Cancer SGC7901/VCR Cells
LIAOWenqiu,ZHANGLi,LIGuoqing,etal.TheSecondAffiliatedHospitalofUniversityofSouthChina,Hengyang,421001
【Abstract】ObjectiveTo explore the effect of rosiglitazone(ROS),a selective peroxisome proliferator-activated receptor gamma (PPARγ) ligand,reverses Mitomycin C resistance on nude mice xenografts of human gastric cancer SGC7901/VCR cells and its possible mechanism.MethodsThe model of xenografts tumor in nude mice were established by inoculating human gastric cancer SGC7901/VCR cells into the back of nude mice subcutaneously.48 male nude mice were divided into 6 groups:Control group,MMC group,ROS group,MMC combined moderate dose ROS group,MMC combined high dose ROS group,MMC combined cyclosporineA(CSA) group.There were 8 mice in each group.After treated for 40 days,the volumes changes of tumor and tumor inhibition rates were observed,draw the growth curve of xenograft tumor.The expression of P-glycolprotein(P-gp) and MGr1-Ag were observed with Western-blot assay respectively.ResultsAfter medication the effect on the volume of tumor and tumor inhibition rates:there was no significant difference between the control group and MMC group(P>0.05),the difference of tumors volume and tumor inhibition rates were significant between other groups and the control group and MMC group (P<0.05).The expression of P-gp and MGr1-Ag was highest in the control group and MMC group,the difference of expression of P-gp and MGr1-Ag were significance between other groups and control group and MMC group (P<0.05).MMC combined high dose ROS group and MMC combined cyclosporineA(CSA) group were least,there was no significant difference between them(P>0.05).ConclusionRosiglitazone inhibits the growth of SGC7901/VCR cell and decreases the expression of P-gp and MGr1-Ag,Rosiglitazone reverses drug resistance of nude mice xenografts of human gastric cancer SGC7901/VCR cells partly on MMC.
【Key words】Rosiglitazone;Multidrug resistance;Xenograft;P-gp protein;MGr1-Ag protein
(收稿日期2014-03-25修回日期 2014-04-18)
中图分类号:R735.7
文献标识码:A
文章编号:1001-5930(2015)01-0006-04
DOI:10.3969/j.issn.1001-5930.2015.01.002
通讯作者:张琍
基金项目:湖南省科技厅资金资助项目(编号:2009SK3138);湖南省自然科学基金资助项目(编号:08JJ5002);湖南省卫生厅资助项目(编号:2007110)
作者单位:421001 南华大学附属第二医院

