利用实时荧光定量PCR检测外源基因拷贝数体系的建立
李 斌奥斯曼张冬杰巴桑珠扎赵 丽刘 娣*
(1.西藏自治区农牧科学院畜牧兽医研究所,西藏拉萨 850000;2.黑龙江省农业科学院畜牧研究所,黑龙江哈尔滨 150086)
利用实时荧光定量PCR检测外源基因拷贝数体系的建立
李 斌1,2奥斯曼1张冬杰2巴桑珠扎1赵 丽1刘 娣2*
(1.西藏自治区农牧科学院畜牧兽医研究所,西藏拉萨 850000;2.黑龙江省农业科学院畜牧研究所,黑龙江哈尔滨 150086)
黑素皮质素受体4(Melanocortin receptor 4,MC4R)基因是影响猪生长肥育性能的主效基因之一,是参与调控体重、采食和能量平衡的关键信号物质。动物转基因技术目前主要应用于生产珍贵蛋白、基因治疗、器官移植、动物品种改良和建立疾病模型等方面。目前人们已经获得了如羊、牛、小鼠、猪等多种转基因克隆动物。确定外源基因的拷贝数和整合位点是对后续外源基因功能探讨和表型研究的前提条件。本研究将MC4R基因转入猪PK15细胞中,挑单克隆,通过3对特异性引物对转染细胞做PCR扩增检测出阳性细胞,实时荧光定量PCR检测外源基因拷贝数,初步建立了检测外源基因拷贝数的实验体系。
MC4R基因 PK15细胞 阳性细胞 实时荧光定量PCR 外源基因拷贝数
黑素皮质素受体4基因(Melanocortin receptor 4,MC4R)是一个单拷贝基因,主要功能是减少体脂,降低体重。仅含有一个外显子,其编码序列长度为996bp,编码332个氨基酸,具有中枢性黑素皮质激素的退热效应,在动物的体重、能量稳态和采食量的调控中具有重要作用。
外源基因拷贝数一般指外源基因DNA首尾相连的整合到某一生物基因组DNA中的个数。检测外源基因的拷贝数,确定转基因动物的基因型,是成功建立转基因动物模型的基础,更是后续基因功能探讨和表型研究的前提条件,为动物转基因技术应用于生产珍贵蛋白,基因治疗,器官移植,动物品种改良和建立疾病模型等方面提供技术支持。目前检测外源基因拷贝数的方法主要是Southern Blot法和实时荧光定量PCR(Real-time PCR)。有研究表明,Southern Blot法与实时荧光定量PCR对转基因拷贝数检测的结果很接近,只有小部分结果不一致,主要体现在实时荧光定量PCR的检测结果要略高于Southern Blot法,理论上讲,实时荧光定量PCR检测出的拷贝数可能更接近实际数值。
目前,猪上外源基因拷贝数的实验体系尚不完善,实验方法复杂且实验可靠性不高,本实验利用转猪MC4R基因的PK15细胞系为实验材料,建立了一套完整的外源基因拷贝数检测体系。
1 材料与方法
1.1 实验材料
本实验所用的pMD18-T载体购自大连宝生物公司,真核表达载体pcDNA3.1(+)由黑龙江省农业科学院的畜牧研究所分子实验室保存。PK-15细胞系购自北京构思特生物公司,大肠杆菌(Escherichia coli)DH5α购自原平皓生物。
1.2 实验方法
1.2.1 转猪MC4R基因细胞系的建立
根据GenBank上发表的猪MC4R基因序列(GenBank登录号:NM214173.1)设计上下游引物,以猪基因组为模板进行PCR扩增,获得MC4R基因编码区序列。将获得的MC4R基因序列连入pcDNA3.1(+)载体上。将重组质粒(pcDNA3.1(+)-MC4R)瞬时转入猪PK15细胞中。做初步药物筛选并培养单克隆细胞,提取总基因组,利用3对特异性引物Y1、Y2和Y3(引物序列见表1)对细胞基因组DNA做PCR扩增,进行测序比对,筛选出测序结果一致的阳性转染细胞。
1.2.2 Real-time PCR方法对外源基因拷贝数的检测
设计引物Real6 扩增pcDNA3.1(+)-MC4R基因片段,Et-p扩增管家基因转铁蛋白受体(TERC)并作为内参标准化基因组DNA(引物序列见表1)。采用20 μL 的PCR反应体系(SYBR Premix Ex TaqTM,TaKaRa),反应液在MicroAmpTMOptical 96-Well Reaction Plate中混匀并用MicroAmpTMOptical Adhesive Film封口。按照仪器ABI7500使用说明书设置反应条件发,所有的样品都在同一个96孔板做三次重复,反应结果通过Sequence Detection System software软件收集并分析。取平均C(t),数值用mean±sd表示。
1.3 标准曲线的建立
将含有外源基因的质粒pcDNA3.1(+)-MC4R与猪PK-15细胞DNA混合,设置含有1个,2个,4个,8个及16个外源基因拷贝数的标准品对照,方法如下:
①假设猪PK-15细胞基因组DNA用量为a ng。②含有外源基因的质粒的大小为b bp。
③猪PK-15细胞基因组DNA大小为3×109bp。
④外源基因片段完全随机的头尾相连的插入在一条染色体上,则a ng 的转染细胞基因组DNA中含有一个外源基因拷贝数的质量为:a×b×0.5/3×109ng。
设计引物Real6扩增pcDNA3.1(+)-MC4R基因片段,Et-p扩增管家基因转铁蛋白受体(TERC)并作为内参标准化基因组DNA(引物序列见表1)。将检测外源基因片段引物扩增C(t)pcDNA3.1(+)-MC4R减去相应的内参(TERC)基因的扩增C(t)TERC得到△C(t),再对样品拷贝数的对数值(以2为底)作图得到绝对定量标准曲线。

表1 pcDNA3.1(+)-MC4R、TERC基因ReaI-time PCR扩增引物序列
2 结果与分析
2.1 绝对定量标准曲线
为了确定real-time PCR扩增中C(t)值与拷贝数的关系,将pcDNA3.1(+)-MC4R与猪PK15细胞基因组DNA混合,分别设置了含有1,2,4,8,16个拷贝数的标准品对照,用real6扩增外源基因(88bp),用Et-p扩增管家基因TFRC作为内参(81bp),每个反应做三次重复(扩增曲线为图1)。取平均C(t)值,用引物real6扩增C(t)pcDNA3.1(+)-MC4R值减去相应的Et-p扩增C(t)TERC值得到△C(t)。将样品的拷贝数的对数(log2N)对△C(t)作图得到绝对定量标准曲线(图2)。本实验的分析精确度高,重复性也很好,同一个标准品的三次重复C(t)值变化很小。将样品的拷贝数的对数(log2N)对△C(t)做标准曲线,决定系数较高(R2= 0.9963)。计算公式为:△Ct = 1.0032× log2N(拷贝数)+4.5613(R2= 0.9963,p < 0.001)。对两个引物扩增产物溶解曲线分析(图3),结果表明两个溶解曲线分别在77℃和80℃附近有且只有一个单峰,并且两个引物的阴性对照和空白对照都没有出现扩增峰,说明两个引物的特异性较好。
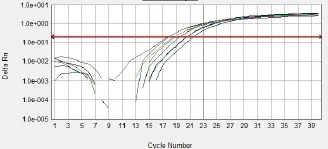
图1 标准品pcDNA3.1(+)—MC4R 基因的扩增曲线
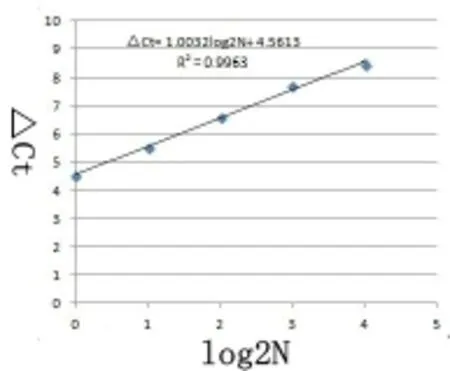
图 绝对定量标准曲线
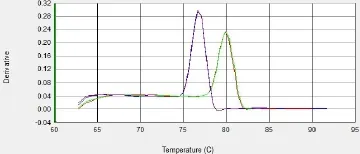
图3 pcDNA3.1(+)—MC4R 基因和 TFRC 基因的溶解曲线
2.2 外源基因拷贝数的检测
Real-time PCR对阳性转染细胞拷贝数的检测结果如表2所示,标准差在1.7563到0.5721之间,结果准确可信。
3 讨论
3.1 阳性转染细胞的鉴定
转基因动物的研究还处于发展阶段,获得转基因动物的难度较大,即使外源基因整合到宿主基因组中,检测也比较困难。目前鉴定阳性个体的方法主要有PCR法和Southern Blot法两种。Southern Blot虽然灵敏准确,但是操作很烦琐,而且费用比较高。PCR法则简单方便,而且灵敏度高,但是很容易出现成假阳性。所以,在本实验选择了PCR法的同时为了避免假阳性的出现,设计了3对特异性引物,对外源基因的启动区,编码区和终止区均做扩增反应。将得到的3组PCR扩增结果选择交集,这样既避免了假阳性的出现,同时又确保了转入的外源基因能够完整表达,为今后的同类研究提供了可靠的方法。
3.2 外源基因拷贝数的检测
在转基因动物中,对外源基因拷贝数的检测一直是一个难题。检测外源基因的拷贝数,确定转基因动物的基因型,是成功建立转基因动物模型的基础,更是后续基因功能探讨和表型研究的前提条件。因此,本实验建立了利用Real-time PCR检测外源基因拷贝数的方法,并对14个阳性转染细胞做出检测。我们采用Sybr Green为荧光染料,它能够与双链DNA特异性结合,使双链DNA发出强烈的荧光,灵敏度极高,很适合检测PCR扩增产物,ROX荧光染料能很好地屏蔽基底的荧光强度,提供一个稳定的检测基线,进一步保证了结果的准确性。由于SYBR Green能够与所有DNA双链相结合,不能特异的检测某一特定模板,所以,提高引物的特异性是实验成功的决定因素。另外绝对定量PCR方法,内参的选择很关键,本实验选取TERC作为内参,对基因组浓度进行标化。外源基因片段检测引物和内参检测引物的扩增片段大小相近(分别是81bp和86bp),Tm值也基本相等,扩增效率基本一致,很好地起到了内参作用。本实验将转猪MC4R基因转入猪PK15细胞中,培养挑单克隆,通过3对特异性引物对转染细胞做PCR扩增检测出阳性细胞,实时荧光定量PCR检测出外源基因拷贝数,建立了对外源基因拷贝数,整合位点检测的实验体系,与其他同类研究有明显的优越性。
本实验研究的、方法也有一定不足,如果将内参引物和检测引物用不同的荧光基团标记,或采用带有不同荧光基团的 Taqman探针标记内参基因和外源基因的扩增片断,在同一个 反应体系中扩增,那么定量的结果更为准确。总之,本实验应用绝对定量PCR法准确高效的检测了外源基因拷贝数,成功建立了绝对定量PCR法检测外源基因拷贝数的实验体系。
4 结论

表2 阳性转染细胞拷贝数检测结果
(1)成功构建了猪的pcDNA3.1(+)-MC4R表达质粒,并转入猪PK15细胞中,获得单克隆细胞34个。经PCR鉴定,16个为阳性细胞,阳性率为47%。
(2)通过实时荧光定量PCR检测出16个阳性细胞中MC4R基因的平均拷贝数为1.42,构建了利用实时荧光定量PCR检测外源基因拷贝数的实验体系。
[1] 王春玲,曹少先,朱冬冬.6个绵羊群体MC4R基因CRS-PCR多态性及其与湖羊、东湖杂交羊生长性状的关联分析[J].南京农业大学学报,2014,(1):121-126.
[2] 孔令富,吴志蕾.MC4R基因、MyoG基因、IGF-I基因与家禽生长性状关系的研究进展[J].上海畜牧兽医通讯,2011,(4):25-27.
[3] Sinba P S,Schioth H B,Tatro J B,et al.Activation of central melanocortin-4 receptor suppresses lipopolysaccharide-induced fever in rats[J].Am J Physiol Regul Integr Comp Physiol,2003,284(6):6031-6595.
[4] 左北瑶,钱宏光.MC4R基因研究进展[J].中国草食动物,2011,(31):45-49.
[5] 王怀禹.黑素皮质素受体4(MC4R)基因多态性与动物生长性能的相关性研究[J].养殖与饲料,2015,(5):1-4.
[6] Sinba P S,Schioth H B,Tatro J B,et al.Activation of central melanocortin-4 receptor suppresses lipopolysaccharide-induced fever in rats[J].Am J Physiol Regul Integr Comp Physiol,2003,284(6):6031-6595.
[7] 王晓建,杨旭,宋晓东.实时荧光定量PCR法检测转基因小鼠拷贝数[J].中国实验动物学报,2007,15(3):170-174.
[8] 彭剑丽.一次性计血量产妇纸在产科中的应用[J].川北医学院学报,2007,22(1):33-34.

