ERCC1基因检测指导晚期食管癌个体化治疗的临床研究
姚艺玮,何义富,季楚舒,韩兴华,胡 冰
ERCC1基因检测指导晚期食管癌个体化治疗的临床研究
姚艺玮,何义富,季楚舒,韩兴华,胡冰
摘要目的 探讨检测ERCC1 C8092A在指导晚期食管癌患者个体化治疗中的作用及其意义。方法 选取114例晚期食管癌患者入组,分为个体化治疗组(n=76)和标准治疗组(n=38)。标准治疗组采用顺铂联合紫杉醇化疗。采集随机入组到个体化治疗组患者外周血标本,均进行ERCC1 C8092A基因型的检测;如果基因型为非C/C型,采用顺铂联合紫杉醇化疗(同标准治疗组),如果基因型为C/C型,采用氟尿嘧啶联合紫杉醇化疗。主要观察指标包括缓解率,次要指标包括化疗毒副反应、无进展时间及总生存时间。两组间比较采用χ2检验。采用Kaplan Meier模型进行生存分析,生存率的比较采用Log Rank检验。结果 个体化治疗组的缓解率为53.9%,标准治疗组缓解率为31.6%,两组差异有统计学意义(P<0.05)。个体化治疗组在化疗毒副反应中恶心呕吐(32.9%),血红蛋白减少(11.8%),Ⅲ~Ⅳ级发生率较标准治疗组(68.4%,28.9%)下降,两组差异有统计学意义(P<0.001,P=0.001)。个体化治疗组中位无疾病进展时间、总生存时间均优于标准治疗组,两组差异有统计学意义(P=0.004,P=0.007)。结论 个体化治疗组的缓解率、化疗毒副反应、中位无进展时间及生存时间均优于标准治疗组,提示ERCC1基因检测指导晚期食管癌个体化治疗可能具有一定临床价值。
关键词食管癌;个体化治疗;核苷酸切除修复交叉互补组;顺铂
2015-02-02接收
作者单位:安徽医科大学附属省立医院肿瘤化疗科,合肥 230001
食管癌是我国最为高发的恶性肿瘤之一,安徽省更是我国六大食管癌高发区之一[1]。食管癌早期症状不典型,临床就诊时大多处于中晚期,大部分患者无法手术切除,需要进行放疗、化疗等综合治疗。顺铂单药有效率为20%左右,含顺铂的联合化疗有效率则达到50%,顺铂已成为晚期食管癌的主要治疗药物。
人们认识到基因多态性可能造成不同个体对同一种药物出现不同反应。文献[2-5]报道在鼻咽癌肺癌胸膜间皮瘤和乳腺癌的研究中,切除修复交叉互补基因1(excision repair cross-complementation group 1,ERCC1)C8092A基因多态性与铂类药物的疗效相关。研究[6]显示食管癌患者ERCC1 C8092A基因型为非C/C型,对铂类更敏感,无进展生存时间和总生存时间均优于C/C型(P=0.03和P=0.04)。那么晚期食管癌患者根据ERCC1 C8092A表型选择化疗方案,能否提高化疗疗效,目前国内尚未有研究。该研究即通过检测晚期食管癌患者ERCC1 C8092A表型,以此指导进行个体化化疗,分析标准治疗组与个体化治疗组的近期缓解率(response rate,RR)、化疗毒副反应、无进展生存(progression free survival,PFS)期、总生存时间(overall survival,OS)的差异,以验证假说,为晚期食管癌个体化治疗提供一定的试验依据。
1 材料与方法
1.1 病例资料 选取2011年1月~2013年1月在安徽医科大学附属省立医院肿瘤科安徽省肿瘤医院肿瘤内科经病理确诊,且具有可评估病灶的晚期食管癌患者,按照2∶1随机进入个体化治疗组或标准治疗组。收集可以入组患者,要求符合如下入选标准:①经病理证实的不能手术或术后复发的晚期食管癌;②体力评价采用美国东部协作肿瘤组(Eastern Cooperative Oncology Group,ECOG)评分≤2分,预计生存期≥3个月;③有临床上的可测量病灶;④辅助化疗停止≥6个月或既往未进行过化疗;⑤肝肾功能血常规均达到化疗标准。排除标准:①精神疾病;②严重心肺肝肾疾病;③有溃疡性结肠炎的患者;④孕妇。共125例晚期食管癌患者入组,至2014年7月1日随访终止,随访方式为门诊随访、电话随访、E-mail随访,以门诊随访为主要方式。随访内容主要包括可评价病灶肿瘤标志物患者ECOG评分。其中3例基因型不能成功获得,2例由于化疗毒副反应等原因不能按研究规定完成化疗,2例不能按研究规定评估疗效,4例失访。最终114例患者进行统计学分析。114例患者中,女43例(37.7%),男71例(62.3%);年龄52岁~74岁,中位年龄为62岁;ECOG评分为:0分
12例(10.6%),1分71例(62.3%),2分31例(27.1%);所有患者的病理类型均为鳞癌,低分化的68例(59.6%),中高分化的46例(40.4%)。
1.2 治疗方法 标准治疗组患者采用顺铂(25 mg/m2)第1天~第3天联合紫杉醇(150 mg/m2)第1天化疗;每21 d为1个周期。采集随机入组到个体化治疗组患者外周血标本,均进行ERCC1 C8092A基因型检测;依据基因型的结果:如果基因型为非C/C型,采用顺铂联合紫杉醇方案化疗(同标准治疗组),如果基因型为C/C型,采用5-氟尿嘧啶(750 mg/m2)第1天~第5天联合紫杉醇(150 mg/m2)第1天化疗。
1.3 疗效评价 疗效评价按照实体瘤的疗效评价标准1.0版。完全缓解(complete response,CR):肿瘤病灶全部消失并且维持4周以上;部分缓解(partial response,PR):肿瘤最长径之和缩小≥30%;进展(progression disease,PD):肿瘤最长径之和增加≥20%或出现新发病灶;稳定(stable disease,SD):非PR/PD;RR=(CR+PR)/(CR+PR+SD+PD)。PFS定义为由随机开始至第一次发生疾病进展或任何原因导致死亡的时间,以任何一种情况先出现为准。OS为从随机开始至死亡。每2个周期评价疗效一次,若出现可能为疾病进展的临床表现可提前评价疗效。PD后患者终止实验,更换其他治疗方案或最佳支持治疗。CR、PR、SD患者继续应用该方案化疗至PD,最多应用6周期,所有未继续化疗患者每月需复查CT评估病灶一次。
1.4 化疗毒副反应及处理 对于患者化疗过程中出现的毒副反应按照NCI-CTCAE 3.0制定的分度标准进行评价,患者出现Ⅰ~Ⅱ度毒性反应时,予以对症治疗恢复后继续原方案原剂量化疗,患者出现Ⅲ~Ⅳ度毒性反应时,予以对症治疗恢复后原方案但药物下调原剂量25%化疗,若再次出现Ⅲ~Ⅳ度毒性反应则退出实验。为提高患者的化疗耐受性,化疗前中后加强其止吐、水化和利尿等辅助治疗。对于曾出现化疗后Ⅲ~Ⅳ级骨髓抑制的患者,在化疗结束24 h后予以粒细胞集落刺激因子预防性治疗。
1.5 ERCC1 C8092A基因型测定 个体化治疗组所有患者首次化疗前采集外周静脉血2 ml,酚/氯仿抽提真核细胞基因组DNA,行PCR扩增。PCR引物由上海生工生物工程技术服务有限公司合成。上游引物:5’-ACAGTGCCCCAAGAGGAGAT-3’,下游引物:5’-AGTCTCTGGGGAGGGATTCT-3’。反应体系包括:10×Buffer(15 mmol/L Mg2+)2.5 μl,dNTPs (2.5 mmol/L)2 μl,上下游引物(均10 mmol/L)各0.5 μl,Taq酶(5 μ/μl)0.2 μl,检测样本(基因组DNA)50 ng,最后灭菌蒸馏水加至混合体系总量达50 μl。反应条件为:首先,95℃5 min;然后,94℃15 s,60℃25 s,72℃30 s,40个循环;最后,72℃延伸10 min并4℃保温。
1.6 统计学处理 采用SPSS 17.0软件进行分析。定性资料组间比较采用χ2检验,等级资料组间比较采用非参数检验。生存分析采用Kaplan Meier模型,生存率的比较采用Log Rank检验。
2 结果
2.1 ERCC1 C8092A基因序列检测和基因遗传平衡性检验 对76例个体化治疗组患者进行ERCC1 C8092A基因序列检测,结果见图1。应用Hardy-Weinberg定律对所检测到的ERCC1 C8092A基因型分布情况进行遗传平衡检验(P=0.999),提示该样本来自于同一孟德尔群体,达到遗传平衡。
2.2 各治疗组临床特征 个体化治疗组及标准治疗组患者的性别、中位年龄、ECOG评分、TNM分期、病理学分化程度等详细临床特征见表2,各组临床特征经χ2/Z检验比较,差异无统计学意义(P>0.05)。
2.3 各治疗组缓解率比较 个体化治疗组与标准治疗组RR比较,差异有统计学意义(P=0.024)。其中个体化治疗组中非CC型亚组缓解率为56.1%,CC型亚组缓解率为51.4%,但两组差异无统计学意义(P=0.684)。见表3。
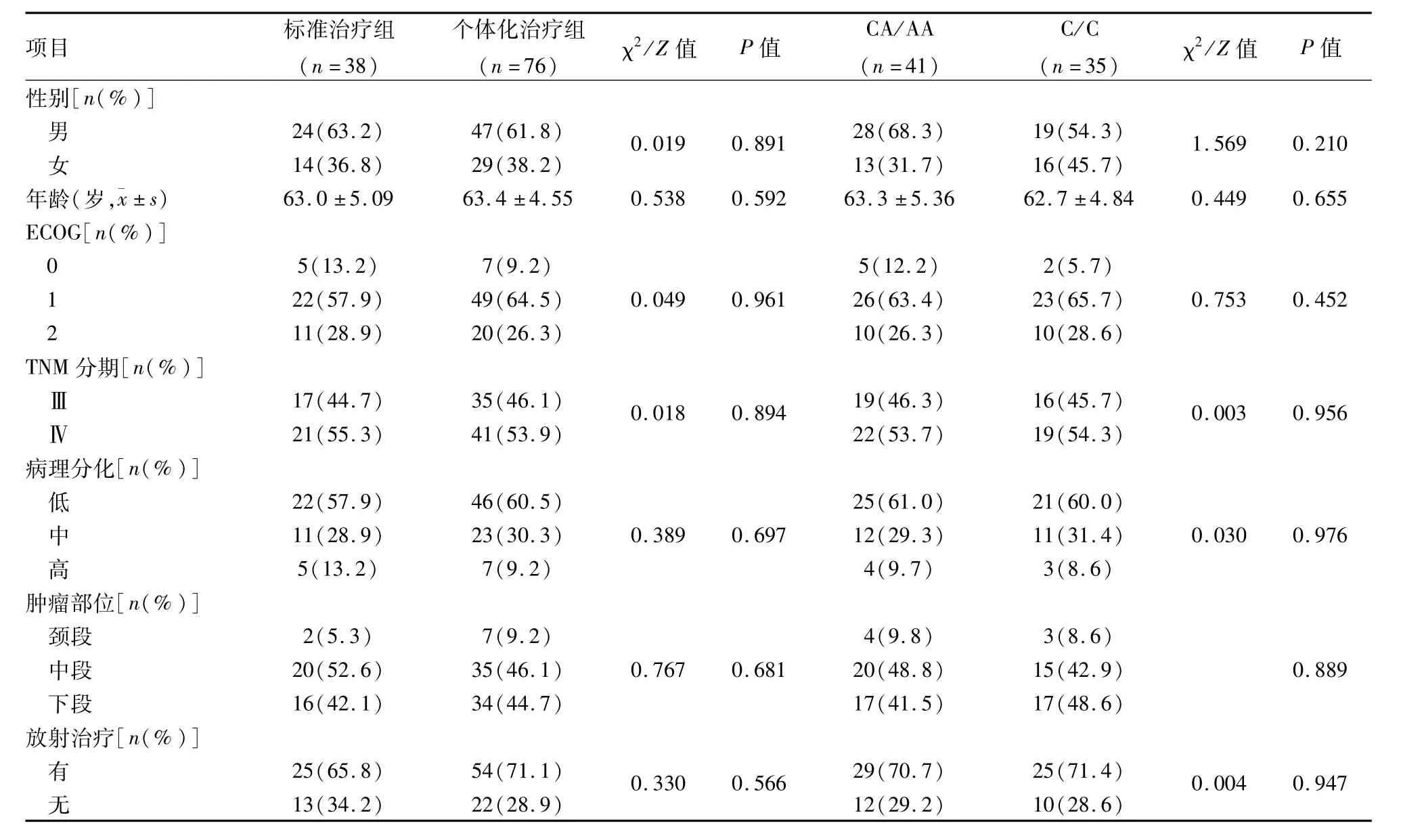
表2 各治疗组患者基线特征比较(n=114)

表3 两组缓解率比较
2.4 各治疗组化疗毒副反应比较 两治疗组化疗毒副反应主要集中在恶心呕吐脱发骨髓毒性神经毒性。个体化治疗组恶心呕吐发生率为89.5%(68/76),其中Ⅲ~Ⅳ级发生率为32.9% (25/76)。标准治疗组恶心呕吐发生率为100% (38/38),其中Ⅲ~Ⅳ级发生率为68.4%(26/38),两组差异有统计学意义(P<0.001)。贫血在个体化治疗组的发生率为90.8%(69/76),Ⅲ~Ⅳ级为11.8%(9/76)。在标准治疗组中发生率为94.7% (36/38),Ⅲ~Ⅳ级发生率为28.9%(11/38),两组差异有统计学意义(P=0.001)。个体化治疗组脱发发生率为100%(76/76),白细胞减少94.7% (72/76),神经毒性86.8%(66/76),标准治疗组依次分别为100%(38/38)、92.1%(35/38)、86.8% (33/38),两组差异无统计学意义(P>0.05)。其他毒副反应如腹泻、血小板减少、肝肾功能损害等发生率较低,两组差异无统计学意义。见表4。

表4 各治疗组化疗毒副反应比较(n)
2.5 各治疗组PFS和OS比较 标准治疗组中位无进展时间为4个月(95%CI=2.935~5.065),个体化治疗组中位无疾病进展时间为6个月(95%CI =5.176~6.824),两组差异有统计学意义(χ2=8.121,P=0.004)。标准治疗组总生存时间为11个月(95%CI=10.167~11.833),个体化治疗组总生存时间为13个月(95%CI=12.067~13.933),两组差异有统计学意义(χ2=7.329,P=0.007)。见图2。
3 讨论
在食管癌治疗中,顺铂由于疗效确切,价格低廉成为食管癌化疗的基石。顺铂通过与细胞内DNA形成铂-DNA加合物,进而形成链内或链间交联,阻止DNA的复制和转录,使增殖迅速的细胞停滞在G2/M期,从而启动细胞程序性凋亡过程。然而人体存在DNA修复系统,当化疗药物损伤肿瘤细胞的DNA后,肿瘤细胞可以通过DNA修复方式将损伤修复,使肿瘤细胞保存下来。核苷酸切除修复(NER)通过切除那些由多环芳烃、紫外线、外源性化学物等诱导形成的DNA加合物,并以互补链为模板复制修复损伤DNA[7]。ERCC1在NER中起到限速或调节的重要作用,ERCC1过表达可使顺铂诱导的铂-DNA加合物的清除增加,导致个体对顺铂耐药。研究[4,8]表明ERCC1 C8092A基因多态性和铂类药物的疗效具有相关性,基因型为A/C或A/A型的患者可能对铂类更敏感。
目前ERCC1的研究大多采用免疫组织化学的方法进行检测,但是该方法本身存在一定的不足。首先活检的肿瘤组织较小,可能由于免疫组化染色后切片内肿瘤细胞数量太少而影响结果判定。其次免疫组化的结果观察属于一种半定量的方法,容易受病理科医师主观因素的影响。而本研究从DNA水平检测ERCC1表达,结果相对准确可靠。另外从组织样本中获得ERCC1过程复杂不易开展。研究[9-10]显示ERCC1在外周血和肿瘤组织中表达具有相关性,可以从外周血中提取ERCC1。
临床研究[11-12]显示晚期食管癌紫杉醇单药有效率为32%,紫杉醇联合顺铂的反应率可达48.6%。临床研究[13-14]显示紫杉醇联合氟尿嘧啶类药物也具有较高客观反应率。所以该研究对于顺铂不敏感的C/C型患者予以紫杉醇联合氟尿嘧啶治疗。结果显示,个体化治疗组的缓解率优于标准治疗组,提示根据ERCC1基因检测结果进行个体化化疗可以进一步提高缓解率。个体化治疗组在化疗毒副反应中恶心呕吐、血红蛋白减少Ⅲ~Ⅳ级发生率较标准治疗组下降,提示可能通过基因检测选择化疗药物避免对顺铂不敏感的患者使用顺铂而带来毒副反应。个体化治疗组中位PFS优于标准治疗组,提示通过基因检测指导化疗,使C/C型患者也能从化疗中获益,进而使个体化治疗组中总体PFS延长。个体化治疗组OS优于标准治疗组,两组差异有统计学意义。分析其原因可能是个体化治疗组患者PFS、病情进展后一般状况、化疗的耐受力均优于标准治疗组,进展后的二线治疗未控制以及后续支持治疗的差异也会对患者的生存期有较大影响。
该研究仅探讨了ERCC1 C8092A指导晚期食管癌的个体化治疗意义,样本量偏少,需要进一步扩大样本量及减少进展后的二线治疗对其影响,进一步验证基因检测在食管癌个体化治疗的价值。同时多基因联合检测指导个体化治疗值得进一步研究。
参考文献
[1] 陈 健,何义富,胡 冰,等.ERCC1和TS基因多态性在预测顺铂联合5-氟尿嘧啶治疗晚期食管癌疗效中的意义[J].肿瘤,2010,4(30):314-21.
[2] Palomba G,Atzori F,Budroni M,et al.ERCC1 polymorphisms as prognostic markers in T4 breast cancer patients treated with platinum-based chemotherapy[J].J Transl Med,2014,12(1):272.
[3] Ting S,Mairinger FD,Hager T,et al.ERCC1,MLH1,MSH2,MSH6,and βⅢ-tubulin:resistance proteins associated with response and outcome to platinum-based chemotherapy in malignant pleural mesothelioma[J].Clin Lung Cancer,2013,14(5):558-67.
[4] Chen C,Wang F,Wang Z,et al.Polymorphisms in ERCC1 C8092A predict progression-free survival in metastatic/recurrent nasopharyngeal carcinoma treated with cisplatin-based chemotherapy[J].Cancer Chemother Pharmacol,2013,72(2):315-22.
[5] Kalikaki A,Kanaki M,Vassalou H,et al.DNA repair gene polymorphisms predict favorable clinical outcome in advanced nonsmall-cell lung cancer[J].Clin Lung Cancer,2009,10(2):118-23.
[6] Bradbury P A,Marshall A L,Kulke A H,et al.Prognostic significance of nuclear excision(NER)and base excision(BER)DNA repair gene polymorphisms in esophageal cancer[J].J Clin Oncol,2007,25(18S):2511.
[7] Gregg S Q,Robinson A R,Niedernhofer L J.Physiological consequences of defects in ERCC1-XPF DNA repair endonuclease[J].DNA Repair(Amst),2011,10(7):781-91.
[8] Wang Y,Chen J,Li X,et al.Genetic polymorphisms of ERCC1 and their effects on the efficacy of cisplatin-based chemotherapy in advanced esophageal carcinoma[J].Oncol Rep,2011,25(4):1047 -52.
[9] Schena M,Guarrera S,Buffoni L,et al.DNA repair gene expression level in peripheral blood and tumour tissue from non-small cell lung cancer and head andneck squamous cell cancer patients[J].DNA Repair(Amst),2012,11(4):374-80.
[10]张 慧,范志松,刘 巍,等.食管鳞状细胞癌患者外周血和肿瘤组织中ERCC1及ERCC2表达的相关性研究[J].肿瘤,2010,30(1):68-72.
[11]Chao Y K,Wu Y C,Liu Y H,et al.Distant nodal metastases from intrathoracic esophageal squamous cell carcinoma characteristics of long-term survivors after chemoradiotherapy[J].J Surg Oncol,2010,102(2):158-62.
[12]Zhang X,Shen L,Li J,et al.A phase II trial of paclitaxel and cisplatin in patients with advanced squamous-cell carcinoma of the esophagus[J].Am J Clin Oncol,2008,31(1):29-33.
[13]Matsumoto H,Kubota H,Higashida M,et al.Docetaxel/TS-1 with radiation for unresectable squamous cell carcinoma of the esophagus-a phase II trial[J].Anticancer Res,2014,34(7):3759-63.
[14]Schnirer I I,Komaki R,Yao J C,et al.Pilot study of concurrent 5-fluorouracil/paclitaxel plus radiotherapy in patients with carcinoma of the esophagus and gastroesophageal junction[J].Am J Clin Oncol,2001,24(1):91-5.
Clinical research of individualized therapy in advanced esophageal cancer guiding by detection of ERCC1 C8092A
Yao Yiwei,He Yifu,Ji Chushu,et al
(Dept of medical Oncology,Anhui Provincial Hospital Affiliated to Anhui Medical University,Hefei 230001)
AbstractObjective To explore the role and clinical values of detection of excision repair cross-complementing 1 (ERCC1)C8092A polymorphisms in individualized therapy of advanced esophageal cancer patients.Methods 114 advanced esophageal cancer patients were enrolled.Patients were randomly assigned to either the standard treatment group or the individualized treatment group.Patients in the standard treatment group received Paclitaxel plus cisplatin.In the individualized treatment group,the ERCC1 C8092A polymorphisms were detected after DNA PCR amplifications,which extracted from peripheral blood karyocytes before the chemotherapies used.Patients with the AA or AC genotype of ERCC1 C8092A received Paclitaxel plus cisplatin,and those with CC genotype received Paclitaxel plus fluorouracil.The primary endpoints were response rate.The sencondary endpoints were toxicity of chemotherapy,progression freesurvival and overall survival.Differences between the groups were statistically analyzed by chi square test.Survival Differences were analyzed by Kaplan Meiersurvival curves.The survival rate was analyzed by Log Rank test.Results Response rate in the standard treatment group was 31.6%.In the individualized treatment group was 53.9%.There was statistically significant difference between two groups(P<0.05).The rates of gradeⅢ~Ⅳnausea and vomitting(32.9%),anemia(11.8%)were significantly lower in individualized treatment group than in standard treatment group(68.4%,28.9%).There was statistically significant difference between the two groups(P<0.001,P=0.001).The media progression free survival time and overall survival time were significantly better in individualized treatment group than in standard treatment group(P=0.004,P=0.007).Conclusion The RR,toxicity of chemotherapy,PFS and OS are significantly better in individualized treatment group than in standard treatment group.Detection of ERCC1 gene polymorphism might be performed for advanced esophageal cancer patients to be better individualized,which is worthy of further study.
Key wordsesophageal cancer;individualized therapy;excision repair cross-complementing;cisplatin
作者简介:姚艺玮,女,主治医师,硕士研究生;胡 冰,女,教授,硕士生导师,责任作者,E-mail:hubing3756@sina.com
基金项目:安徽省卫生厅医学科研课题(编号:2010B001)
文献标志码A
文章编号1000-1492(2015)05-0640-05
中图分类号R 735.1

