辣根过氧化物酶标记JWA抗体及其在免疫检测反应中的应用*
李爱萍,朱丽雯,张 娟,周建伟**
1南京医科大学公共卫生学院,南京 211166;2南京博天科智生物技术有限公司,南京 211100
辣根过氧化物酶标记JWA抗体及其在免疫检测反应中的应用*
李爱萍1,朱丽雯1,张 娟2,周建伟1**
1南京医科大学公共卫生学院,南京 211166;2南京博天科智生物技术有限公司,南京 211100
目的:运用辣根过氧化物酶标记JWA单克隆抗体,并且将标记的抗体应用于ELISA法和Western blot等免疫检测反应中。方法:运用高碘酸盐-四氢硼化钠氧化还原体系活化辣根过氧化物酶,活化的辣根过氧化物酶按1∶1标记JWA单克隆抗体;将HRP标记的抗体分别运用直接和双夹心ELISA测试;同时将标记单克隆抗体运用于Western blot检测。结果:辣根过氧化物酶成功标记JWA单克隆抗体。其中HRP-JWA(4C9)抗体在直接法ELISA试验中和多肽的结合能力高于HRP-JWA(7C3);其在450 nm处的最大吸光度值为0.96。双夹心ELISA实验中,预先包被JWA(4C9)单抗,检测抗体使用HRP-JWA(7C3)可以得到较好的实验结果,在450 nm处的最大吸光度值为1.30。在Western blot实验HRP-JWA抗体浓度1.0 μg·mL-1可以检测出SGC7901细胞中目的蛋白。结论:运用氧化还原方法成功标记JWA单克隆抗体,并可以初步应用于免疫反应的检测。
JWA抗体;辣根过氧化物酶;ELISA;免疫印迹
JWA是一种新的微管结合蛋白,不仅参与全反式维甲酸(ATRA)诱导的细胞分化调节,而且与多种细胞分化、凋亡诱导剂如佛波酯(TPA)、N-(4羟基苯基)维生素甲酰胺(4HPR)和As2O3等的生物学作用有关,涉及相应的信号通路。JWA可以调节白血病细胞的分化[1-2],还可以通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路调节肿瘤(如宫颈癌、乳腺癌、肝癌等)细胞的迁移[3]。JWA还活跃地参与细胞对应激刺激(如冷应激、热应激和化学物诱导的氧化应激等)的应答[4-5]。氧化应激激活核因子 (nuclear factor 1,NF1)和JWA近端启动子结合,从而调节JWA的转录水平。JWA可以调节碱基切除修复通路中很多蛋白,如正调控 X射线损伤修复交叉互补基因1(X-ray Re-pair Cross Complementing 1,XRCC1)和负调控多聚ADP核糖聚合酶-1[Poly(ADP-ribose)polymerase-1,PARP-1]的表达,从而保护氧化应激诱导的DNA单链损伤[6]。对1800例胃癌组织芯片免疫组织化学染色发现,JWA和XRCC1蛋白表达水平与患者生存、预后有很好的相关性[7-8]。由于免疫组织化学染色难以准确定量,而酶联免疫吸附试验(ELISA)可以对血液、组织样本进行高通量快速定量分析。为建立快速检测组织中JWA表达水平的ELISA方法,本研究基于实验室已经成功筛选和纯化出两株JWA单克隆抗体[11],运用经典的高碘酸标记抗体技术[12]获得可以用于ELISA检测的HRP标记的JWA抗体。初步完成运用标记JWA单抗进行直接和双夹心ELISA试验的方法。
1 材料和方法
1.1 实验材料
用前期筛选建立的、能分泌JWA特异性单克隆抗体的两种杂交瘤细胞株,分别经小鼠腹腔注射,产生腹水后将收集的腹水经亲和层析法分离纯化,获得JWA单抗:JWA(4C9)和JWA(7C3)。
SGC7901细胞株购自中科院上海细胞库;辣根过氧化物酶 (HRP,Sigma公司);JWA多肽(DR-FARPDFRDISK)委托吉尔生化(上海)有限公司合成;透析袋直径37 mm(Spectrum Lab公司);96孔高吸附酶标板 (Corning公司);紫外-荧光酶标仪(TECAN公司)。其他化学试剂均为国产分析纯。
1.2 实验方法
1.2.1 辣根过氧化物酶标记JWA单克隆抗体
1.2.1.1 JWA抗体透析脱盐:将透析袋用双蒸水或0.05 mol·L-1碳酸盐(pH 7.3)透析液煮沸10 min。蒸馏水冲洗后,双蒸水洗净。取1 mg抗体溶于1 mL的PBS缓冲液,加入透析袋中,两端扎紧,透析袋放入0.05 mol·L-1碳酸盐(pH 7.3)透析液中,4℃,透析过夜,中途换液3次,以充分确保抗体中盐脱去。1.2.1.2 辣根过氧化物酶的活化:称取5 mg辣根过氧化物酶溶于1 mL双蒸水中,溶液呈浅棕黄色。在上述溶液中加入1 mL新鲜配制的13 mg·mL-1的高碘酸溶液,4℃,避光混合30 min,活化的HRP溶液呈现浅绿色。取9 μL的乙二醇加入1 mL双蒸水中混匀。在活化的HRP溶液中加入0.5 mL乙二醇混匀,室温避光放置30 min,此时溶液呈现棕色。
1.2.1.3 标记JWA单克隆抗体:按照酶∶抗体(1∶1)在1 mL抗体中加入等体积1 mg·mL-1辣根过氧化物酶,将此混合物加入透析袋中,在0.05 mol·L-1的碳酸盐透析液中,4℃透析过夜,中途换液3次。次日,加入0.1 mL新鲜配制的4 mg·mL-1NaBH4。室温,静置4 h。
1.2.1.4 标记后的抗体脱盐:将上述液体装入透析液袋中,4℃透析过夜。在透析好的抗体溶液中逐滴滴加等体积的饱和硫酸铵,4℃,静置1 h,4℃,5000 r· min-1离心30 min。弃上清液,沉淀溶于1 mL的PBS缓冲液中,将上述溶液装入透析袋中透析过夜。即得到标记好的JWA单克隆抗体。
1.2.2 直接ELISA法检测HRP标记的JWA抗体和抗原的结合能力 用PBS将JWA多肽稀释成1 μg·mL-1,按照每孔加入100 μL至96孔酶标板中。37℃孵育2 h。甩去孔内液体,用PBS洗3次,250 μL/孔,拍干。分别将HRP标记JWA单克隆抗体HRP-JWA(4C9)和HRP-JWA(7C3)用0.5%BSA的PBS稀释成0、0.2、0.4、0.8、1.6、3.2 μg·mL-1,每孔加入100 μL,每个浓度3平行,37℃孵育1 h。甩去孔内液体,用PBS洗3次,拍干。预热TMB底物于室温,同时开启酶标仪预热。每孔加入四甲基联苯胺(TMB)底物A(将TMB粉溶于DMSO中,使终浓度为11 mg·mL-1,再加入1/10体积的甘油)、B液(pH 5.5,0.2 mol·L-1磷酸氢二钠与0.1 mol·L-1柠檬酸缓冲液配制过氧化脲素浓度为0.74 mg·mL-1)各加50 μL,37℃显色20 min,发现孔变成蓝色后加入终止液(1 mol·L-1硫酸)50 μL,此时蓝色变为浅黄色。运用酶标仪在450 nm处读取吸光度值。
1.2.3 双夹心法检测单克隆抗体的结合能力 分别按 0、0.125、0.25、0.5、1.0、2.0 μg·mL-1运用 PBS稀释单克隆抗体JWA-4C9和JWA-7C3,在96孔酶标板中每孔分别包被100 μL上述抗体,每个浓度3平行。4℃过夜。次日,甩去孔内液体,用PBS洗3次,拍干。每孔包被1 μg·mL-1JWA多肽100 μL,37℃、孵育2 h。甩去孔内液体,用PBS洗3次,每次5 min,拍干。运用HRP标记的1 μg·mL-1JWA抗体37℃孵育1 h(包被JWA-4C9抗体的酶标板,应用HRP-JWA7C3孵育检测;包被JWA-7C3抗体,应用HRP-JWA4C9孵育检测)。甩去孔内液体,用PBS洗3次,每次5 min,拍干。预热TMB底物至室温,同时开启酶标仪预热。每孔加入TMB底物A、B各加50 μL。37℃,显色20 min,发现变成蓝色后加入终止液50 μL/孔,运用用酶标仪在450 nm处读取吸光度值。
1.2.4 HRP标记的JWA抗体在Western blot技术中直接检测JWA蛋白在胃癌细胞SGC7901中表达
制备12.5%的SDS-PAGE分离胶。裂解、离心后收取SGC7901全蛋白。分别按照50 μg/孔的上样量上样。90 V稳压电泳后,运用200 mA恒流半干式电转移1 h。封闭液于室温封闭1 h,PBST(0.5%tween PBS)洗涤5次,每次5 min。加入1∶1000稀释的HRP-JWA抗体,4℃孵育过夜。PBST洗涤5次。增强型化学发光法(ECL)检测目的条带。
2 结 果
2.1 辣根过氧化物酶标记JWA单克隆抗体
辣根过氧化物酶经过高碘酸活化、乙二醇还原反应后,可以观察到辣根过氧化物酶水溶液的颜色由原来的棕黄色变成浅绿色,再变为棕黄色。见图1。这个颜色的明显变化过程说明酶活化是成功的。在JWA单克隆抗体分别和活化的辣根过氧化物酶等比例结合,并经过NaBH4还原反应后,原来的浅绿色溶液又变成棕黄色。再经过饱和硫酸铵沉淀、离心,获得棕色沉淀,初步得到了HRP标记的JWA抗体沉淀,该沉淀经过PBS缓冲液溶解、透析、脱盐。最终得到HRP标记的JWA单克隆抗体。分装后-20℃保存备用。
2.2 直接ELISA法检测HRP标记的JWA抗体和抗原的结合能力
在酶标板中包被1 μg·mL-1JWA多肽100 μL,运用HRP-标记的JWA单抗结合、洗脱,经过TMB染色和终止液终止显色后,在酶标仪450 nm吸光度值显示。两种标记的抗体均可以和JWA多肽反应。但是,HRP-JWA(4C9)吸光度值的变化趋势比HRP-JWA(7C3)更明显,在0.4~1.6 μg·mL-1浓度范围变化最明显。在3.2 μg·mL-1浓度时吸光度为0.96。HRP-JWA(7C3)在吸光度在其浓度范围0~0.8 μg·mL-1变化最明显。在浓度大于0.8 μg·mL-1,吸光度为0.40后出现平台,不再随着标记抗体浓度的增加而升高。因此,结果显示HRP-JWA(4C9)和JWA多肽的结合能力更强。也显示JWA多肽与两种JWA单抗的结合力有差异。见图2。

图1 辣根过氧化物酶的氧化还原活化过程
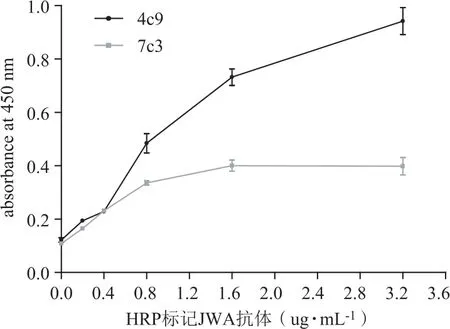
图2 直接法检测单克隆抗体和抗原的结合能力
2.3 双夹心法检测单克隆抗体的结合能力
在96孔酶标板中预先包被不同浓度两种JWA单抗后,结合JWA多肽。再分别运用HRP标记的JWA抗体检测。图3结果显示,预先使用JWA(4C9)单克隆抗体包被,后用HRP-JWA(7C3)检测有较好的反应曲线(见图3中黑色曲线)。其中当包被的浓度为0.25~0.5 μg·mL-1范围有最明显的变化趋势,在包被浓度大于1.0 μg·mL-1以后,吸光度值趋于平稳,不再随着包被浓度的升高而增加。预先包被JWA(4C9)单克隆抗体,吸光度没有随着包被浓度的升高而增加(见图3灰色曲线)。结果提示,可以预先使用JWA(4C9)包被,运用HRP-JWA(7C3)检测的双夹心法进行以后的实验探索。
2.4 HRP标记JWA抗体直接检测JWA蛋白在胃癌细胞SGC7901中表达
运用Western blot实验技术对胃癌细胞进行电泳、电转移后,直接用HRP标记的JWA抗体按1∶1000稀释后,检测发现在23 kD位置有一条明显条带(见图4),这和JWA的分子量一致;在更小的约15 kD位置上也有一条条带,这可能是JWA有相似片段的一个杂蛋白,目前未知。这些结果进一步验证了用辣根过氧化物酶酶标记的JWA单克隆抗体的检测效能。
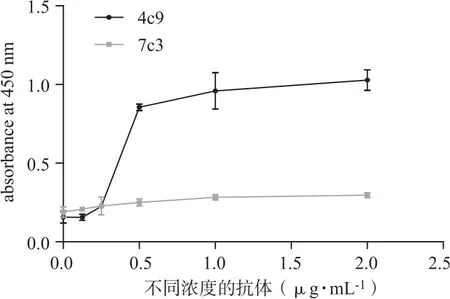
图3 双夹心法检测标记抗体的结合能力
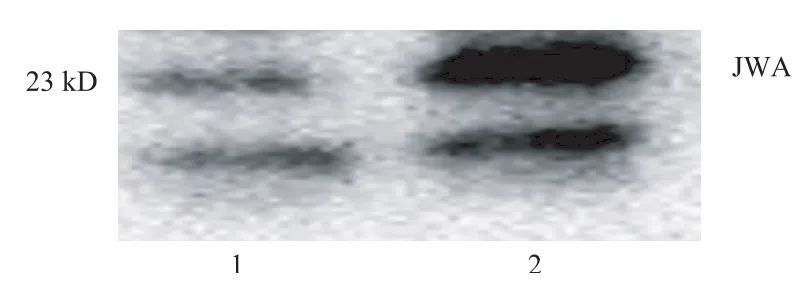
图4 免疫印迹检测SGC7901细胞中JWA蛋白表达上样量:(1)20 μg;(2)50 μg
3 讨 论
JWA也称ADP-核糖基化相关因子6连接蛋白5(ARL6ip5,GenBank:AF070523,1998),是一种新的微管相关蛋白及环境应答蛋白。前期的研究结果发现,JWA-76G/C基因多态性阻碍了其环境应答作用,增大了中国人群患胃癌的风险[13]。回顾性胃癌队列研究结果也显示,相对于对应的正常组织,癌中JWA表达明显降低;癌组织中JWA表达与淋巴结转移、远处转移及TNM分期显著负相关;癌中JWA低表达预示患者不良的预后,而且是预测胃癌患者预后的独立危险因素[8]。对于组织样本中该蛋白的检测仍然是Western blot和免疫组织化学实验方法。前两者实验技术工作量大,同时受实验条件限制,每次检测的样本有限,难以在临床研究中得到应用。本实验首次建立辣根过氧化物酶标记的JWA抗体,并首次建立其直接和双夹心ELISA实验方法,为临床检测该蛋白进行了有益的探索。
本研究抗体的标记选用过碘酸钠法,通常标记抗体和HRP的比例为1∶2,但实际操作中很难完全避免HRP的过度交联,因此本研究中选择抗体和HRP的比例在1∶1。同时需要注意的是,制备HRP酶标抗体的关键在于防止酶的过度醛化而影响其活性及酶的自身交联,从而导致过度标记[12,14]。由于HRP酶分子中含有铁叶琳,在酶溶液中加入过碘酸钠,立即出现灰绿色,加入乙二醇后绿色变成橙黄色,过碘酸氧化乙二醇极为迅速,这样终止了过碘酸对酶的继续氧化[14]。
本研究初步完成HRP标记JWA抗体并将它应用于ELISA检测,还须要进一步完善方法的稳定性和提高其灵敏度。
[1] Huang S,Shen Q,Mao WG,et al.JWA,a novel sig-naling molecule,involved in the induction of differenti-ation of human myeloid leukemia cells[J].Biochem Biophys Res Commun,2006,341(2):440-50.
[2] Huang S,Shen Q,Mao WG,et al.JWA,a novel sig-naling molecule,involved in all-trans retinoic acid in-duced differentiation of HL-60 cells[J].J Biomed Sci, 2006,13(3):357-71.
[3] Chen H,Bai J,Ye J,et al.JWA as a functional molecule to regulate cancer cells migration via MAPK cascades and F-actin cytoskeleton[J].Cell Signal,2007, 19(6):1315-27.
[4] Zhu T,Chen R,Li A,et al.JWA as a novel molecule involved in oxidative stress-associated signal pathway in myelogenous leukemia cells[J].J Toxicol Environ Health A,2006,69(15):1399-411.
[5] Zhu T,Chen R,Li AP,et al.Regulation of a novel cell differentiation-associated gene,JWA during oxida-tive damage in K562 and MCF-7 cells[J].J Biomed Sci,2005,12(1):219-27.
[6] Chen R,Qiu W,Liu Z,et al.Identification of JWA as a novel functional gene responsive to environmental ox-idative stress induced by benzo[a]pyrene and hydrogen peroxide[J].Free Radic Biol Med,2007,42(11):1704-14.
[7] Wang S,Gong Z,Chen R,et al.JWA regulates XR-CC1 and functionsasa novelbase excision repair protein in oxidative-stress-induced DNA single-strand breaks[J].Nucleic Acids Res,2009,37(6):1936-50.
[8] Wang S,Wu X,Chen Y,et al.Prognostic and predic-tive role of JWA and XRCC1 expressions in gastric cancer[J].Clin Cancer Res,2012,18(10):2987-96.
[9] 李红梅,陈 佳,徐 斐,等.ELISA测定中TMB显色体系的优化及其稳定性研究[J].生物技术通报,2010,(2):126-30.
[10] 李 萍,马亚茹,陆 俭,等.Pfs25蛋白单克隆抗体的制备及双抗体夹心ELISA的建立[J].细胞与分子免疫学杂志,2011,27(12):1330-5.
[11] 李爱萍,陈敏娟,王稀琛,等.小鼠腹水JWA单克隆抗体的制备鉴定[J].药物生物技术,2014,21(2):111-4.
[12] 徐晶晶,李 迪,曹永生,等.辣根过氧化物酶标记兔抗丝状噬菌体衣壳蛋白抗体的制备与初步应用 [J].动物保健品,2013,(3):114-6.
[13] Li CP,Zhu YJ,Chen R,et al.Functional polymor-phisms of JWA gene are associated with risk of blad-der cancer[J].J Toxicol Environ Health A,2007,70 (11):876-84.
[14] 骆加里,宋光承,陈彩云,等.过碘酸钠氧化辣根过氧化物酶 (HRP)中的若干问题及高效果的标记方法[J].
生物化学与生物物理学报,1984,16(6):650-6.
Preparation and Immuno Application of the Monoclonal Antibody of JWA Labeled with Horseradish Peroxidase*
LI Ai-ping1,ZHU Li-wen1,ZHANG Juan2,ZHOU Jian-wei1**
1School of Public Health,Nanjing Medical University,Nanjing 211166;2Nanjing Botianzhike Biotechnical Company,Nanjing 211100
Objective:To label JWA monoclonal antibody with horseradish peroxidase (HRP)and apply it in ELISA and Western blot immune detection.Methods:Using sodium periodate and sodium borohydride redox reaction,HRP was activated;The activated HRP was used to mark JWA monoclonal antibody in tubes;The HRP labeled antibody was respectively applied in direct,sandwich ELISA and Western blot de-tection.Results:HRP was successfully labeled on JWA monoclonal antibodies.In the direct method of ELISA test,HRP-JWA (4c9)antibodies combined polypeptide better than the combination of HRP-JWA (7c3);Its max OD450was 0.96.While in double sandwich ELISA experiment,pre-coated by JWA(4c9)an-tibody,using the HRP-JWA(7c3)antibody as detected antibody could get good results,the max OD450was 1.30. HRP-JWA could also identify the target protein in SGC7901 cells in Western blot experiments. Conclusion:JWA antibody has been successfully marked with HRP,which could be used preliminarily in ELISA and Western blot.
JWA antibody;Horseradish peroxidase;ELISA;Western blot
Q81;R967
A
1673-7806(2015)02-137-04
国家自然科学基金重点项目(30930080);江苏省优势学科建设工程资助项目(环境卫生与预防医学)
李爱萍,女,实验师 E-mail:aplinj@126.com
* *通讯作者周建伟,男,教授 E-mail:drjwzhou@126.com
2015-01-06
2015-02-05

