大黄5种蒽醌类成分在大鼠肝微粒体中的代谢及酶促反应动力学
冯素香, 王蒙蒙, 吴兆宇, 李 先, 郝 蕊, 徐艳华
(1.河南中医学院,河南郑州450046;2.呼吸疾病诊疗与新药研发河南省协同创新中心,河南郑州450046)
大黄5种蒽醌类成分在大鼠肝微粒体中的代谢及酶促反应动力学
冯素香1,2, 王蒙蒙1, 吴兆宇1, 李 先1, 郝 蕊1, 徐艳华1
(1.河南中医学院,河南郑州450046;2.呼吸疾病诊疗与新药研发河南省协同创新中心,河南郑州450046)
研究大黄5种蒽醌类成分在大鼠肝微粒体中的代谢特征和参与代谢的细胞色素P450亚型.超速离心法制备大鼠肝微粒体,采用反相高效液相色谱(RP-HPLC)测定孵育液中大黄5种蒽醌类成分的质量浓度,研究大黄蒽醌类成分的酶促动力学,推导药物米氏常数(K m)和最大反应速度(V max),并计算体外酶对药物的清除率(Clint);用苯巴比妥钠(PB)、地塞米松(DEX)、β-奈黄酮(β-NF)诱导大鼠肝微粒体,观察大黄5种蒽醌类成分在各温孵体系中的代谢,同时观察不同质量浓度和不同种类的CYP酶特异性抑制剂对大黄蒽醌类成分代谢的影响.结果表明大黄芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚在肝微粒体中的Km、Vmax、Clint分别为(18.97±1.89)、(2.50±0.11)、(15.68±1.09)、(183.41±1.90)、(1.37±0.14)mg·L-1;(0.52±0.015)、(0.066±0.003)、(0.41± 0.009)、(5.22±0.09)、(0.036±0.0034)mg·L-1·min-1;(2.69±0.12)、(2.56±0.16)、(2.61±0.20)、(2.81± 0.10)、(2.63±0.18)min-1·10-2;经DEX、PB、β-NF诱导后,PB组、DEX组大黄蒽醌类成分代谢率高于CMC-Na组,具有显著性差异(P<0.05),β-NF组大黄蒽醌类成分代谢率低于CMC-Na组,无显著性差异(P>0.05);非那西汀、氟康唑、酮康唑的Dixon图均为一组相交于第二象限的直线.通过研究得知大黄5种蒽醌类成分在PB、DEX诱导的肝微粒体中代谢较快,CYP3A4、CYP2A6为介导大黄蒽醌类成分代谢的主要代谢酶;非那西汀、氟康唑、酮康唑均为为大黄蒽醌类成分的竞争性抑制剂.
大黄蒽醌类成分; 大鼠肝微粒体; CYP450; 酶促动力学
大黄为历代医家本草和历版《中国药典》收载的常用泻下类中药,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄之功效[1].大黄具多类药效活性成分,其中主要活性成分为蒽醌类,包括大黄素、大黄酸、大黄酚、大黄素甲醚、芦荟大黄素等[2],其结构式如图1所示.体外代谢研究是新药研究中广泛使用的代谢研究方法,它能够直观地确定药物代谢途径及相关酶系,并且研究药物代谢相互作用,指导体内研究和用药安全[3].本试验通过肝微粒体体外代谢研究法来研究中药大黄有效单体蒽醌类成分在体外的代谢情况,同时探明大黄蒽醌类成分在大鼠肝微粒体中的酶促动力学特征,以及CYP450酶抑制剂对其代谢的影响,明确参与大黄蒽醌在大鼠肝微粒体中代谢的相关CYP450酶.预期通过本研究,阐明参与药物代谢的酶,评价药物与代谢酶间的相互作用,为理解药物代谢的机制、预测药物相互作用和药物代谢多态性以及指导临床合理用药提供理论依据.
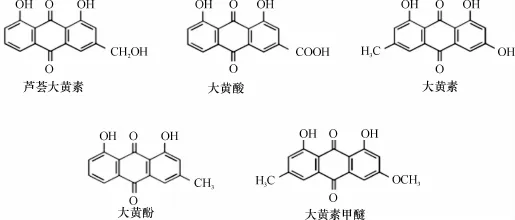
图1 大黄蒽醌类成分结构图Fig.1 The structure diagram of five Anthraquinones in Rhubarb
1 材料
1.1 仪器
Dionex-P680高效液相色谱仪;BY89-1型电动玻璃匀浆机(宁波新芝生物科技股份有限公司);SIGMA3-18K高速离心机配12154-H转子(sigma公司);HIMA CP80MX超高速离心机配P65ST转子(日本Hitachi公司);UV-2450双波长紫外一可见分光光度计(日本Shimadzu公司);UV-2000分光光度计(上海尤尼柯仪器有限公司);pHS-3C型精密酸度计(上海雷磁仪器厂).
1.2 试药
芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、1,8-二羟基蒽醌(编号分别为:110795-200605、0757-200206、110756-200110、110796-200716、110758-200610、0829-9702,均购于中国食品药品检定研究院);大黄蒽醌类成分由河南中医学院药学院药物分析学科提供,含量大于80%;还原型烟酰胺腺嘌呤二核苷磷酸(Roche公司);匀浆缓冲液(0.05 mol/mLTris、1.15%KCL);0.25 mol/mL蔗糖溶液;牛血清白蛋白(Roche公司);连二亚硫酸钠(天津市福晨化学试剂厂);甲醇为色谱-质谱醇(美国Tedia公司);其余试剂均为分析纯,水为超纯水.
1.3 动物
健康雄性SD大鼠(购于河北省实验动物中心,许可证号:1006120),体质量(250±25)g.饲养于河南中医学院动物实验中心(许可证号:SYXK(豫).2010-0001).
2 方法
2.1 溶液配制
(1)对照品溶液配制 分别精密称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、1,8-二羟基蒽醌对照品适量于10 mL容量瓶中,用甲醇溶解并稀释至刻度,制成质量浓度分别为89.6、84.8、78.0、90.4、58.4μg/mL的储备液,使用时分别将上述储备液各取2 mL混合.
(2)NADPH再生系统孵化液及孵化启动剂的配制 精密称取MgCl2、KCl、NADPH适量于10mL容量瓶中,用浓度为0.1 mol/mL Tris-HCI缓冲液溶解并定容,得NADPH再生孵化液(pH7.40).精密称取NADPH 1 mg于1 mL容量瓶,用1%NaHCO3定容,得孵化启动剂.
2.2 分组及给药
将20只大鼠随机分成4组,分别为:空白对照组:0.5%CMC-Na,10μg/kg,i.g;PB组:75 mg/kg,i.p;DEX组:80 mg/kg,i.g;β-NF组:75 mg/kg,i.g.各组均在末次给药12 h后禁食不禁水,24 h后取肝制备微粒体.
2.3 肝微粒体的制备及CYP450酶活性测定
采用超速离心法[4]制备肝微粒体.大鼠禁食12 h后断头处死,放出血液,迅速剖开腹腔,用预冷生理盐水灌流,取出肝脏,将新鲜肝脏放入冰冷的生理盐水中反复冲洗,洗至溶液呈淡黄色后,用滤纸擦干并称重,用于计算肝脏指数.按1∶4加入匀浆缓冲液,快速剪碎肝脏,用电动玻璃匀浆机匀浆,制成肝匀浆.将匀浆后的肝脏转移至离心管,在4℃下10 000×g离心20 min.取上清液在4℃下105 000 ×g离心60 min.红色沉淀即为肝微粒体,将肝微粒体沉淀重悬于浓度为0.25 mol/mL蔗糖溶液,可新鲜使用或存放于-80℃备用.依据Omura和Sato法[5]测定各组肝微粒体CYP450酶活性.
2.4 温孵条件
精密量取750μL孵化液、150μL CMC-Na肝微粒体、50μL大黄蒽醌类成分CMC-Na,涡旋混合0.5 min,于37℃恒温箱中预热5 min,加入50μL启动剂,涡旋混合1 min,于37℃恒温箱中孵化30 min,置于-30℃低温冰箱终止反应.
2.5 样品处理
取终止反应后的样品,解冻,涡旋混合1 min,加入固相萃取柱,加入淋洗液(5%甲醇水)1 mL,弃去淋洗液,先后用甲醇、乙腈各1mL冲洗固相萃取柱,收集洗脱液,于空气流下吹干,100μL甲醇定容.
2.6 大黄5种蒽醌类成分在大鼠肝微粒体中酶促反应动力学
影响酶活性的因素主要有温孵时间、蛋白质量浓度、底物浓度[6],实验分别对每个因素进行优化.在蛋白质量浓度分别为0.25、0.5、1.0、2.0 mg/mL的孵化体系中分别加入质量浓度为0.875、1.75、3.5、7.0、14μg/mL的大黄5种蒽醌类成分,在前述温孵条件下孵育0、10、20、30、40 min,确立最佳孵育条件.
2.7 大黄5种蒽醌类成分在各诱导剂组大鼠肝微粒体温孵液中代谢影响的比较
将各诱导组肝微粒体组分悬浮液适量分别与大黄5种蒽醌类成分质量浓度为高、中、低(14、7、3.5 μg/mL)在NADPH再生温孵体系中共同温孵,观察大黄5种蒽醌类成分在各温孵体系中的代谢.
2.8 代谢抑制实验
为进一步研究选择性的CYP酶抑制剂对大黄蒽醌类成分代谢的影响,进行大黄蒽醌的代谢抑制实验.孵育条件同前,孵育体系中大黄蒽醌质量浓度为7μg/mL,微粒体蛋白质量浓度为1 mg/mL,实验中所用的选择性抑制剂为非那西汀(0、0.105、0.21、0.42 mg/mL)、氟康唑(0、0.2、0.4、0.8 mg/mL)、酮康唑(0、0.031、0.062、0.124 mg/mL).
2.9 代谢物检测色谱条件
色谱柱:Venusil XBPC18(L),4.6 mm×250 mm,5μm(博纳艾杰尔科技有限公司);流动相:甲醇-0.1%磷酸水(75∶25,v/v);柱温:25℃;检测波长:254 nm;流速:1.0 mL/min;进样量:20μL;内标:1,8-二羟基蒽醌.
2.10 统计学处理
3 实验结果
3.1 方法专属性
实验分为无肝微粒体空白对照组、无大黄蒽醌类成分组及样品组.按2.4项下进行温孵反应,按2.6项下色谱条件进行测定,结果如图2:
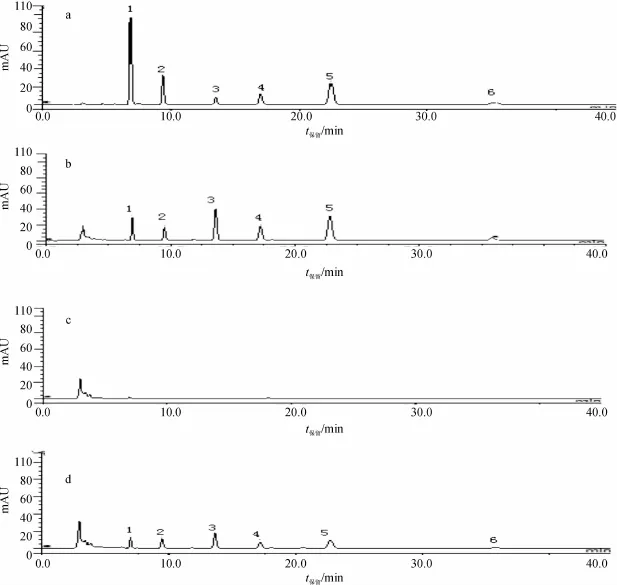
图2 方法专属性色谱图Fig.2 Chromatogram of the specific method
由图可知,所建方法能有效分离样品中各成分,排除杂质干扰,专属性良好.
3.2 线性范围和检测限
在经灭活的大鼠肝微粒体孵育体系中,分别加入适量各系列质量浓度的大黄5种蒽醌混合对照品,照2.4项下条件进行孵化和样品处理,记录色谱图,以质量浓度为横坐标,相应的峰面积为纵坐标,建立工作曲线.芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的线性方程分别为:Y=1.763 3X+0.621 8(R=0.999 6,n=7);Y=0.613 7X+0.035 4(R=0.999 5,n=7);Y=0.576 9X+0.128 1(R=0.999 4,n=7);Y=1.399 4X-0.175(R=0.999 7,n=7);Y=0.241 2X-0.001 9(R=0.999 4,n=7).采用逐步稀释法得芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的检测限质量浓度分别为0.01、 0.02、0.02、0.03、0.03μg/mL(S/N≧3).
结果表明:芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚分别在0.15~18.7、0.18~23.1、0.13~16.9、0.26~16.6、0.18~11.6μg/mL范围内呈良好的线性关系.
3.3 方法回收率
在灭活的大鼠肝微粒体孵育体系中,分别加入低、中、高(8.96、17.92、35.84μg/mL)3个质量浓度的芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚混合对照品溶液,照2.4项样品处理方法进行处理后采用高效液相色谱法测定.结果表明低、中、高质量浓度的芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的回收率分别为106.8%、98.67%、88.98%;98.04%、95.02%、87.25%;105.95%、102.20%、92.3%;105.15%、98.50%、90.09%;99.89%、99.80%、89.11%.
3.4 精密度试验
选择低、中、高3种质量浓度,以空白大鼠肝微粒体配制质量控制(QC)样品,每个质量浓度点5份样品,连续测定5 d,以随行标准曲线计算QC样品中各成分的实测质量浓度,根据QC样品的各成分实测质量浓度计算本法的日内和日间精密度.结果表明:芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚低、中、高3种质量浓度的日内精密度RSD分别为6.9%、2.6%、4.8%;3.4%、3.2%、7.0%;6.5%、3.8%、3.2%;4.6%、2.3%、1.4%;6.9%、4.3%、2.7%.日间精密度RSD分别为5.7%、2.6%、3.9%;4.3%、3.6%、4.6%;7.6%、5.8%、3.2%;6.2%、2.7%、2.7%;5.7%、6.2%、2.6%.5种大黄蒽醌类成分的日内和日间精密度的RSD%均<10%,符合生物样品测定要求.
3.5 大黄5种蒽醌类成分在大鼠肝微粒体中酶促反应动力学
(1)反应时间优化 在蛋白质量浓度为1.0 mg/mL的大鼠肝微粒体酶中加入大黄5种蒽醌类成分,于37℃恒温箱中孵育0、10、20、30、40 min.以时间为横坐标,大黄蒽醌类成分代谢消失率(w%)为纵坐标作图,结果显示,大黄5种蒽醌类成分在0~10 min内呈线性消除的趋势明显,孵化30 min后大黄5种蒽醌类成分剩余百分数不高于40%,确定最佳孵化时间为30 min.孵育时间-代谢消失率的关系如图3:
(2)肝微粒体蛋白质量浓度优化 在蛋白质量浓度为0.25、0.5、1.0、2.0 mg/mL的大鼠肝微粒体酶中加入大黄5种蒽醌类成分,于37℃恒温箱中孵育30 min.以蛋白质量浓度为横坐标,大黄5种蒽醌类成分代谢消失率(w%)为纵坐标作图,结果显示,随着肝微粒体蛋白质量浓度的增加,大黄5种蒽醌类成分消失率有增加的趋势,但当蛋白质量浓度为1.0 mg/mL时,由于蛋白质量浓度太大,出现固相萃取柱堵塞的现象,故选择1.0 mg/mL为肝微粒体孵化实验的最佳蛋白质量浓度,蛋白质量浓度-代谢消失率的关系如图4:
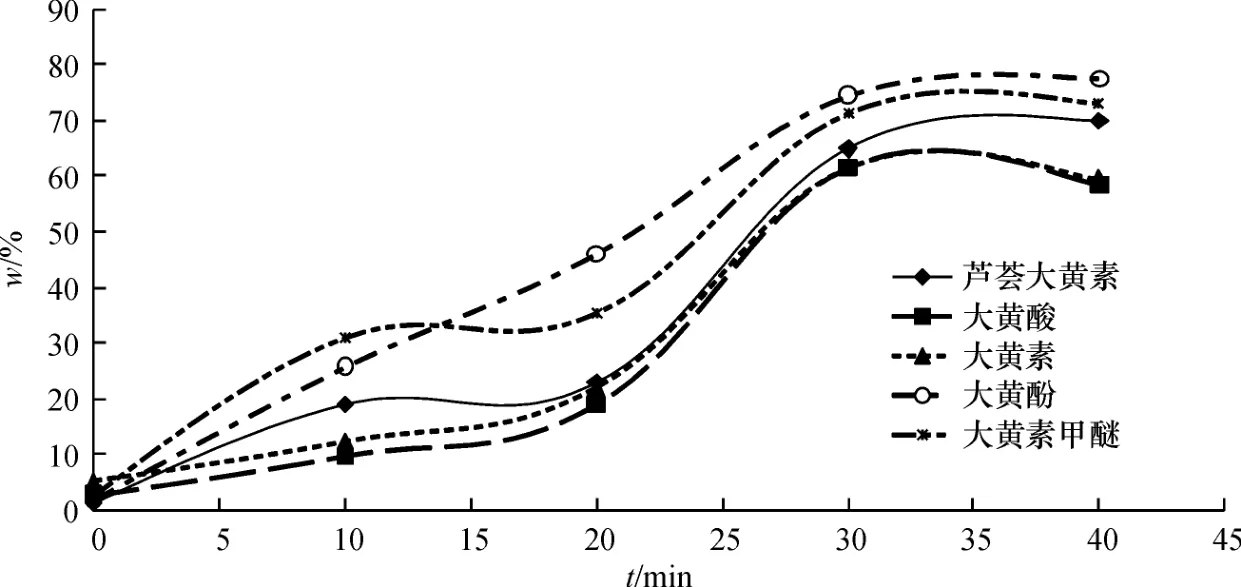
图3 温孵时间对大黄5种蒽醌类成分代谢的影响Fig.3 Effect of incubation time on five Anthraquinones in Rhubarb
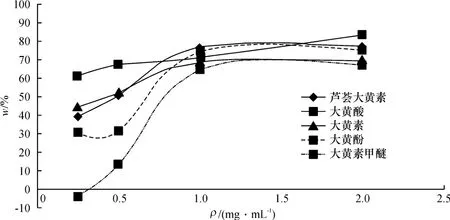
图4 肝微粒体蛋白浓度对大黄蒽醌类成分代谢的影响Fig.4 Effect of livermicrosomal protein concentration on five Anthraquinones in Rhubarb
(3)底物质量浓度优化 质量浓度分别为1.75、3.5、7.0、14.0μg/mL大黄5种蒽醌类成分在NADPH再生反应系统中,37℃恒温箱中孵化30 min,以底物质量浓度为横坐标,大黄5种蒽醌类成分代谢消失率(w%)为纵坐标作图,结果显示,当大黄5种蒽醌类成分质量浓度大于7μg/mL时,其代谢速率并未随大黄5种蒽醌类成分质量浓度的增加而呈线性增加,表现出明显的代谢饱和特性,确定最佳底物质量浓度为7μg/mL.底物质量浓度与代谢消失率的关系如图5:
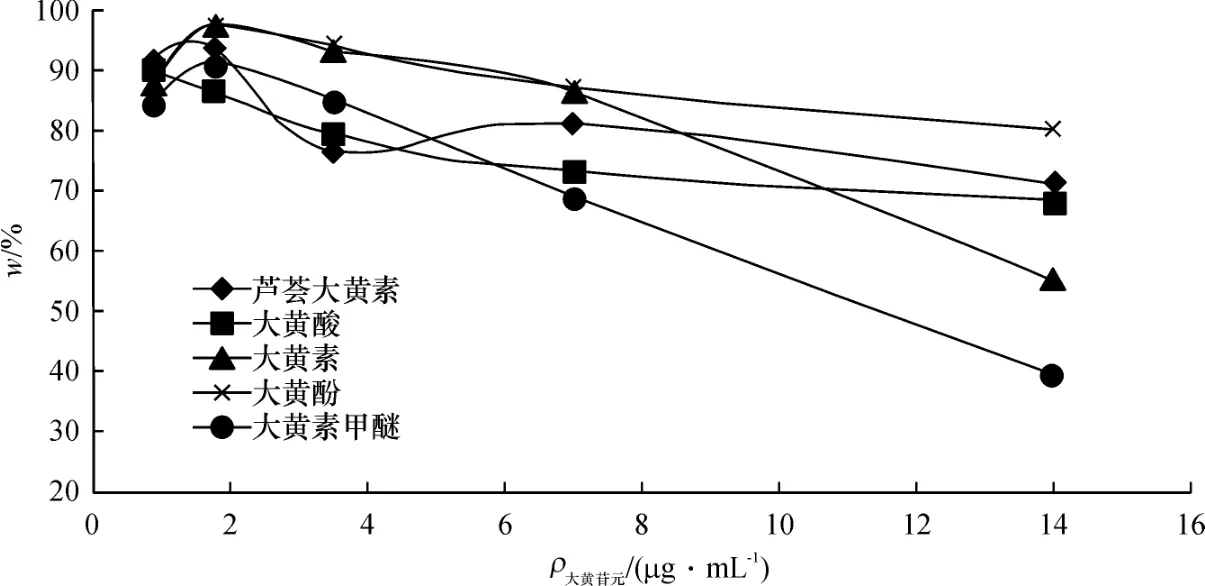
图5 底物浓度对大黄蒽醌类成分代谢的影响Fig.5 EffectofsubstrateconcentrationonfiveAnthraquinonesinRhubarb
3.6 大黄5种蒽醌类成分在大鼠肝微粒体中的酶动力学参数测定
在蛋白质量浓度为1.0mg/mL的孵化体系中分别加入质量浓度为0.875、1.75、3.5、7.0、14μg/mL的大黄5种蒽醌类成分,按2.4项下进行孵化反应,按2.5项下处理样品,测定剩余底物质量浓度.根据Lineweave—Burk(双倒数作图法)方程[7],求得大黄5种蒽醌类成分在肝微粒体中的Km、Vmax、Clint,结果见表1:
表1 大黄蒽醌类成分在肝微粒体中的酶动力学参数(± s,n=5)Table1 ThekineticparametersofAnthraquinonesin Rhubarbinlivermicrosomes(±s,n=5)

表1 大黄蒽醌类成分在肝微粒体中的酶动力学参数(± s,n=5)Table1 ThekineticparametersofAnthraquinonesin Rhubarbinlivermicrosomes(±s,n=5)
名称 Km/(mg·L-1)Vmax/(mg·L-1·min-1)Clint/(min-1·10-2芦荟大黄素)18.97±1.89 0.520±0.015 2.69±0.12大黄酸 2.50±0.11 0.066±0.003 2.56±0.16大黄素 15.68±1.09 0.410±0.009 2.61±0.20大黄酚 183.41±1.90 5.220±0.09 2.81±0.10大黄素甲醚1.37±0.14 0.036±0.0034 2.63±0.18
Km代表了酶对底物的亲合能力,Km值越大,则酶对底物的亲合能力越小;Clint值代表了酶对底物的清除能力,Clint值越大,则酶对底物的清除能力越大[8].结果表明,大鼠肝微粒体的酶系对大黄蒽醌类成分亲和力由大到小的顺序为:大黄素甲醚>大黄酸>大黄素>芦荟大黄素>大黄酚;大鼠肝微粒体的酶系对大黄蒽醌类成分的清除能力由大到小的顺序为:大黄酚>芦荟大黄素>大黄素甲醚>大黄素>大黄酸.
3.7 大黄5种蒽醌类成分在4种不同诱导组大鼠肝微粒体中的代谢研究
经DEX、PB、β-NF诱导后,大黄5种蒽醌类成分在大鼠肝微粒体中的代谢明显提高,高、中、低质量浓度大黄5种蒽醌类成分均为PB组、DEX组与CMC-Na组比较P<0.05,有显著差异,β-NF组与CMC-Na组比较P>0.05,无显著差异.结果见表2:
由此得.结论:大黄蒽醌类成分在PB、DEX诱导的肝微粒体中代谢较快,参考文献PB主要诱导CYP3A4,DEX主要诱导CYP2A、2B、2C[9],这说明CYP3A4、CYP2A6可能为介导大黄蒽醌类成分代谢的主要代谢酶.
3.8 抑制实验
(1)非那西丁对大黄蒽醌类成分代谢的抑制实验 在空白肝微粒体中加入质量浓度为0、0.105、0.21、0.42mg/mL的非那西丁各50μL,再加入再生系统至1mL,预孵育5min,加入NADPH的l% NaHCO3溶液,共孵育30min,测定剩余底物质量浓度,计算代谢速率v,以1/[s]对1/[v]作图,两直线交点的横坐标即为抑制常数Ki,其Dixon图为一组相交于第二象限的直线.
(2)氟康唑对大黄蒽醌类成分代谢的抑制实验
在空白肝微粒体中加入质量浓度为0、0.2、0.4、0.8mg/mL的氟康唑各25μL,照前述方法处理做Dixon图.
(3)酮康唑对大黄蒽醌类成分代谢的抑制实验
在空白肝微粒体中加入质量浓度为0、0.031、0.062、0.124mg/mL的酮康唑各25μL,照前述方法处理做Dixon图.
结果显示,3组抑制试验的Dixon图均为相交于第二象限的直线,结果如图6~8所示,3种抑制剂对大黄蒽醌类成分的抑制常数如表3所示:
表2 不同质量浓度大黄蒽醌类成分在4种肝微粒体中代谢(±s,n=5)Table 2 Different concentrations of anthraquinones in Rhubarb in four kinds ofmetabolism in liver m icrosomes(±s,n=5)
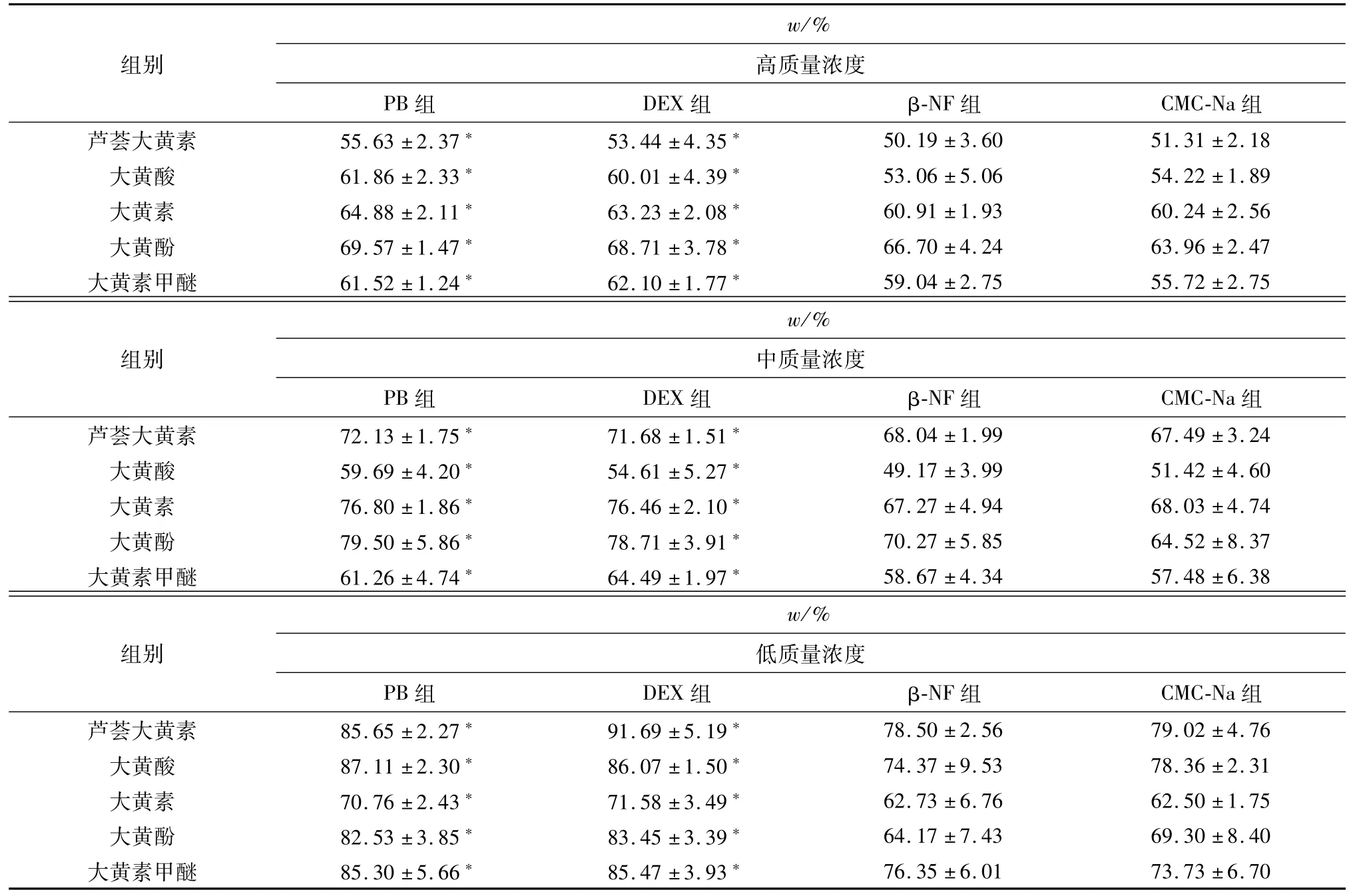
表2 不同质量浓度大黄蒽醌类成分在4种肝微粒体中代谢(±s,n=5)Table 2 Different concentrations of anthraquinones in Rhubarb in four kinds ofmetabolism in liver m icrosomes(±s,n=5)
注:与CMC-Na组相比:*P<0.05
w/%组别 高质量浓度PB组 DEX组 β-NF组 CMC-Na组芦荟大黄素 55.63±2.37* 53.44±4.35*50.19±3.60 51.31±2.18大黄酸 61.86±2.33* 60.01±4.39* 53.06±5.06 54.22±1.89大黄素 64.88±2.11* 63.23±2.08* 60.91±1.93 60.24±2.56大黄酚 69.57±1.47* 68.71±3.78* 66.70±4.24 63.96±2.47大黄素甲醚 61.52±1.24* 62.10±1.77* 59.04±2.75 55.72±2.75w/%组别 中质量浓度PB组 DEX组 β-NF组 CMC-Na组芦荟大黄素 72.13±1.75* 71.68±1.51*68.04±1.99 67.49±3.24大黄酸 59.69±4.20* 54.61±5.27* 49.17±3.99 51.42±4.60大黄素 76.80±1.86* 76.46±2.10* 67.27±4.94 68.03±4.74大黄酚 79.50±5.86* 78.71±3.91* 70.27±5.85 64.52±8.37大黄素甲醚 61.26±4.74* 64.49±1.97* 58.67±4.34 57.48±6.38w/%组别 低质量浓度PB组 DEX组 β-NF组 CMC-Na组芦荟大黄素 85.65±2.27* 91.69±5.19*76.35±6.01 73.73±6.70 78.50±2.56 79.02±4.76大黄酸 87.11±2.30* 86.07±1.50* 74.37±9.53 78.36±2.31大黄素 70.76±2.43* 71.58±3.49* 62.73±6.76 62.50±1.75大黄酚 82.53±3.85* 83.45±3.39* 64.17±7.43 69.30±8.40大黄素甲醚 85.30±5.66* 85.47±3.93*
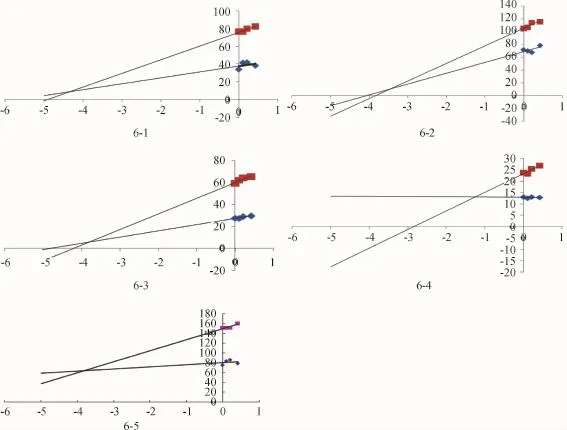
图6 非那西丁对大黄蒽醌类成分代谢的抑制实验Fig.6 Inhibition ofmetabolism to anthraquinones in Rhubarb by Phenacetin
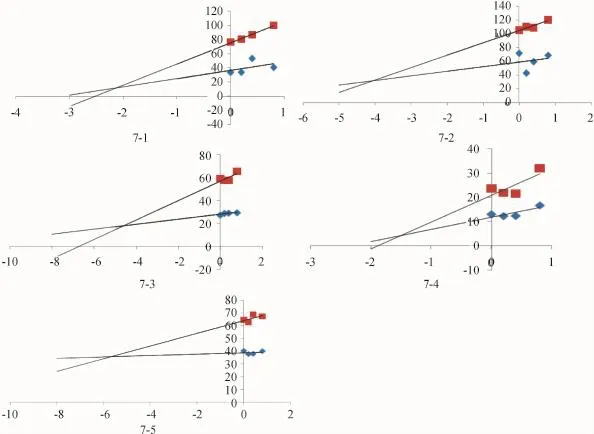
图7 氟康唑对大黄蒽醌类成分代谢的抑制实验Fig.7 Inhibition ofmetabolism to anthraquinones in Rhubarb by Fluconazole
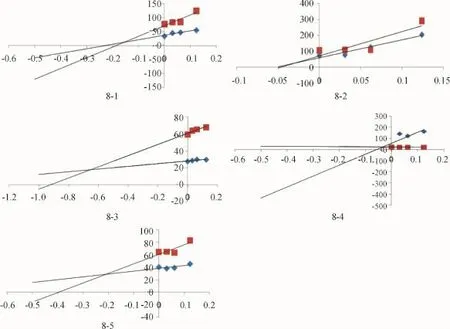
图8 酮康唑对大黄蒽醌类成分代谢的抑制实验Fig.8 Inhibition ofmetabolism to anthraquinones in Rhubarb by ketoconazole
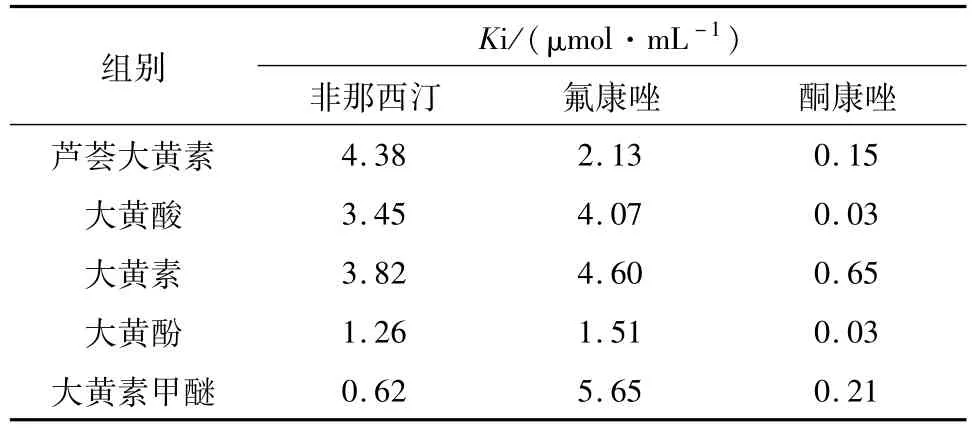
表3 不同类型抑制剂对大黄蒽醌类成分抑制常数Table 3 The inhibition constants for different types of inhibitors of anthraquinones in Rhubarb
结论:非那西汀、氟康唑、酮康唑对大黄蒽醌类成分的Dixon图直线均交于第二象限,说明3者均为为大黄蒽醌类成分的竞争性抑制剂.
4 讨论
本实验建立了测定肝微粒体酶中大黄5种蒽醌的高效液相色谱方法,经回收率、精密度及线性关系等方法学验证项目考察,表明此分析方法具有灵敏、准确、快速的特点,能成功应用于大黄5种蒽醌类成分在大鼠肝微粒体酶中的代谢研究.
研究不同酶抑制剂对药物代谢的影响,可以了解药物的代谢规律以及可能产生的药物相互作用[10].苯巴比妥钠、地塞米松分别为CYP3A4、CYP2A6的特异性抑制剂,在本实验中可以显著影响大黄5种蒽醌类成分的代谢,说明CYP3A4、CYP2A6主要参与了大黄5种蒽醌类成分的代谢,是大黄5种蒽醌类成分的代谢的一个关键步骤.
酮康唑、氟康唑、非那西汀对大黄5种蒽醌类成分的Dixon图均相交于第二象限,说明3者均为大黄5种蒽醌类成分的竞争性抑制剂,提示临床用药时可适当增加大黄蒽醌类成分的给药量.其机理可能是3者与大黄5种蒽醌类成分均具有苯环结构,同时竞争酶上某一位点.3者的结构式如图所示:

在新药研发的早期阶段,了解何种肝药酶参与药物代谢及其本身对肝药酶的影响,对于那些常与其他药物合用的药物尤为重要[11].本研究对大黄5种蒽醌类成分的体外代谢做了初步的探讨,为进一步研究药物相互作用和进开发利用提供理论依据.
[1]中华人民共和国卫生部药典委员会.中华人民共和国药典2010版[S].一部.北京:中国医药科技出版社,2010:22-23.
[2]傅兴圣,陈 菲,刘训红.大黄化学成分与药理作用研究新进展[J].中国新药杂志,2011,20(16):1534-1538.
[3]李 晶.没食子酸冰片醋在肝微粒体中的代谢研究[D].陕西:西北大学,2011.
[4]冯素香,常伟强,周悌强,等.大鼠肝微粒体CYP450酶对芦荟大黄素体外代谢的影响[J].中药药理与临床:2014,30(1):48-51.
[5]李丽波,孙 超,王玉春.蹄叶橐吾乙醇提取物对肝细胞色素P450的影响[J].时珍国医国药,2010,21(5):1262-1264.
[6]任秀华,斯陆勤,曹 磊,等,以咪哒唑仑为探针药测定大鼠肠CYP3A活性及其孵育条件优化[J].中国药学杂志,2010,45(9):654-658.
[7]杨 阳,鲁 军,孙冰洁,等.白藜芦醇对酪氨酸酶体外抑制活性的动力学研究[J].食品与生物技术学报,2011,30(4):632-635.
[8]朱根华,梁新丽,廖正根,等.延胡索乙素及延胡索提取物在大鼠肝微粒体内代谢动力学研究[J].中药药理与临床,2009,25(6):30-33.
[9]任 平,王文斌.白藜芦醇在大鼠肝微粒体中的代谢动力学研究[J].湖北科技学院学报:医学版,2013,27(1):5-8.
[10]毕惠嫦,何 凡,温莹莹,等.丹参酮ⅡA在大鼠肝微粒体酶中的代谢动力学[J].中草药,2007,38(6):882-886.
[11]姚金成,饶 健,曾令贵,等.雷公藤甲素在大鼠肝微粒体中代谢及酶促反应动力学研究[J].中国药房,2010,21(7):577-580.
[责任编辑:刘蔚绥]
M etabolism and enzyme kinetics of five anthraquinones in rhubarb in rat liver m icrosomes
FENG Suxiang, WANG Mengmeng, WU Zhaoyu, LIXian, HAO Rui, XU Yanhua
(1.Henan University of Traditional Chinese Medicine,Zhengzhou 450046,China;2.Collaborative Innovation Center for Respiratory Disease Diagnosis and Treatment&Chinese Medicine Development of Henan Province,Zhengzhou 450046,China)
To study themetabolic kinetics of anthraquinones in rhubarb and participate in themetabolism of cytochrome P450 isoforms in rat livermicrosomal enzyme.Rat livermicrosomeswere prepared by using ultra-centrifugation method.anthraquinones in rat concentration in the incubation pool was determined by RP-HPLCmethod.The Michaelis-Menten parameters Kmand Vmaxin rat livermicrosomeswere initially estimated by analyzing Lineweave-Brurk plot.The clearance(Clint)was calculated for in vitro enzyme to anthraquinones in rhubarb.Various selective CYP inhibitors were used to investigate their inhibitory effects on themetabolism of anthraquinones in rhubarb and the principal CYP isoforms involved in anthraquinones in rhubarb metabolic ring.The K m,V max,and CLintof aloe emodin,rhein,emodin,chrysophanol,and physcion were(18.97±1.89),(2.50±0.11),(15.68±1.09),(183.41±1.90),(1.37±0.14)mg·L-1;(0.52±0.015),(0.066±0.003),(0.41±0.009),(5.22±0.09),(0.036 ±0.0034)mg·L-1·min-1;(2.69±0.12),(2.56±0.16),(2.61±0.20),(2.81±0.10),(2.63 ±0.18)min-1·10-2.After the induction of DEX,PB,β-NF,the anthraquinones in rhubarb metabolic rate of PB group and DEX group were higher than that of CMC-Na group,with a significant difference(P<0.05);the anthraquinones in rhubarb metabolic rate ofβ-NF group was lower than CMC-Na group(P>0.05),both acetophenetidine,fonazole and ketoconazole's Dixon diagram were linears intersects the second quadrant.After induced by PB,DEX,the metabolism of anthraquinones in rhubarb were increase in rat livermicrosomes.Itwas shown that CYP3A4 and CYP2A6 are involved in themetabolism of anthraquinones in rhubarb,Both Acetophenetidine,Fluconazole and Ketoconazole were competitive inhibitors of anthraquinones in rhubarb.
anthraquinones in rhubarb; rat livermicrosomes; CYP450; enzymatic kinetics
R285.8
A
1000-9965(2015)05-0383-09
10.11778/j.jdxb.2015.05.005
2015-06-01
国家自然科学基金资助项目(81274179)
冯素香(1971-),女,教授,博士研究生,研究方向:中药质量分析与新药研究.E-mail:fengsx221@163.com

