胃癌术后3D-CRT合并同时化疗的疗效研究
熊戴群 罗辉
胃癌术后3D-CRT合并同时化疗的疗效研究
熊戴群 罗辉
目的比较胃癌术后单纯化疗与胃癌术后同步放化疗的疗效及不良反应。方法将57例胃癌术后患者随机分为单纯化疗组与同步放化疗组,单纯化疗组采用6个周期XP方案(希罗达2 000 mg/m2d1~14+顺铂60 mg/m2d1 q3w)。同步放化疗组(第一阶段:2个周期XP方案化疗、第二阶段:放疗+希罗达1 650 mg/m25w、第三阶段:2个周期XP方案化疗)。结果同步放化疗组28例患者术后1、2、3、5年生存率为75.0%、64.3%、57.1%、46.4%;单纯化疗组29例患者术后1、2、3、5年生存率为65.5%、51.7%、32.1%、21.4%,两组不良反应主要包括白细胞减少、血小板减少、贫血恶心、呕吐、腹泻、外周神经毒性及手足综合征,且以1、2度为主,同步放化疗组白细胞减少、恶心呕吐、手足综合征发生率高于单纯化疗组,但可耐受。结论胃癌术后同步放化疗组1、2、3、5年生存率高于单纯化疗,且3、5年生存率有统计学意义,不良反应可耐受。
胃癌;希罗达;顺铂;放疗;化疗;放化疗
(The Practical Journal of Cancer,2015,30:1215~1217)
目前胃癌发病率排在肿瘤发病率第四位,死亡率排在第二位,全球每年新增胃癌患者近百万例,死亡患者约80万例,其中我国占35%[1]。且有研究表明我国胃癌患者在诊断时绝大多数为进展期胃癌[2],手术是目前胃癌根治的主要方式,但仅有约30%~50%的患者可获得根治性切除,且长期预后并不满意[3],单纯外科手术无法达到生物学意义上的根治,即便是扩大切除和淋巴结清扫的范围,其中局部复发和远处转移是胃癌根治术后失败的主要原因[4];因此,术后的辅助治疗显得尤为重要。本研究通过比较T3、T4或者N1、N2胃癌术后同期放化疗及化疗的疗效,探讨T3、T4或者N1、N2胃癌的更有效治疗方法。
1 资料与方法
1.1 临床资料
选择2005年6月-2008年6月就诊于江西省肿瘤医院放疗科胃癌术后患者57例纳入标准:①年龄
<60岁;②术后病理检查证实为胃癌(T3、T4或者N1、N2);③ECOG)评分<2分或Karnofsky功能评分(KPS)>70分;④心、肺、肝、肾功能正常;⑤患者签署知情同意书,排除并发有周围神经疾病者。57例患者中男性30例,女性27例,年龄45~60岁,平均51岁,将患者随机分为单纯化疗组29例及同步放化疗组28例,两组患者年龄、性别等一般资料比较差异无统计学意义(P<0.05),具有可比性。
1.2 方法
单纯化疗组采用6个周期XP方案[(希罗达2 000 mg/m2d1~14+顺铂60 mg/m2d1 q3w),卡培他滨(希罗达)属于上海罗氏公司生产]。且希罗达治疗期间同时口服维生素B6片20 mg Tid,皮肤反应严重时可适当加量。
同步放化疗组(第一阶段:2个周期XP方案化疗、第二阶段:放疗+希罗达1 650 mg/m25w、第三阶段:2个周期XP方案化疗),其中XP方案中化疗药物剂量同单纯化疗组。
在实施放化疗期间,每周对患者进行评估,严格根据体重的变化来补充患者的营养,及预防溃疡等对症处理。
放疗采用三维适形放疗3D-CRT。采用模拟机下定位,取仰卧位,采取体模固定体位,根据术前CT或术中肿瘤情况确定术后肿瘤瘤床大致中心,在患者体表及体模上标记出激光及肿瘤中心位置,然后进行螺旋增强CT模拟扫描,层厚5 mm,病变区域上下各扫15层,通过局域网将CT扫描图像导入三维TPS计划系统。勾画CTV、PTV及周围正常组织,肿瘤靶区根据ICRU50勾画临床靶区CTV考虑原发灶周围的亚临床病灶及可能侵犯和转移的范围;计划靶区PTV为CTV外扩0.5~1.0 cm。同时勾画重要器官:脊髓、双肾、肝脏、肠,避免过量照射。具体照射范围为:①上1/3胃癌或胃食管结合部癌区域淋巴结照射范围,包括胃周、腹腔、主动脉旁、脾、肝、十二指肠、肝门淋巴结。②中1/3胃癌或多部位原发灶的胃癌区域淋巴结照射范围包括胃周、腹腔、主动脉旁、脾、肝、十二指肠、肝门淋巴结和胰十二指肠淋巴结。③下1/3胃癌或胃窦癌区域淋巴结照射范围,包括胃周、腹腔、主动脉旁、肝、十二指肠、肝门淋巴结和胰十二指肠淋巴结。
1.3 计划设计
应用三维TPS计划系统,利用计算机控制MLC,尽量使照射野与肿瘤形状适形,尽量避开正常组织,通过剂量-体积直方图DVH等指标选择最佳治疗方案,经复位验证后实施治疗。限制条件为PTV接受40~45 Gy。脊髓最大剂量<45 Gy,接受30 Cy的正常肝V30<30%,接受20 cy的双肾剂量V20分别<30%,小肠最大剂量<45 Gy。
1.4 观察指标
采用门诊、电话咨询等方式随访,单纯化疗组随访率为93.1%,同步放化疗组随访率为96.4%。记录患者术后1、2、3、5年生存率。按CTC3.0急性及亚急性毒性反应评价标准进行安全性评估,分为0~Ⅳ度。
1.5 统计学方法
应用SPSS 17.0统计软件包处理数据,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 术后生存率
同步放化疗组术后1、2年生存率与单纯化疗组比较无显著性差异(P>0.05),而3、5年生存率显著高于单纯化疗组,差异均有统计学意义(P<0.05),见表1。
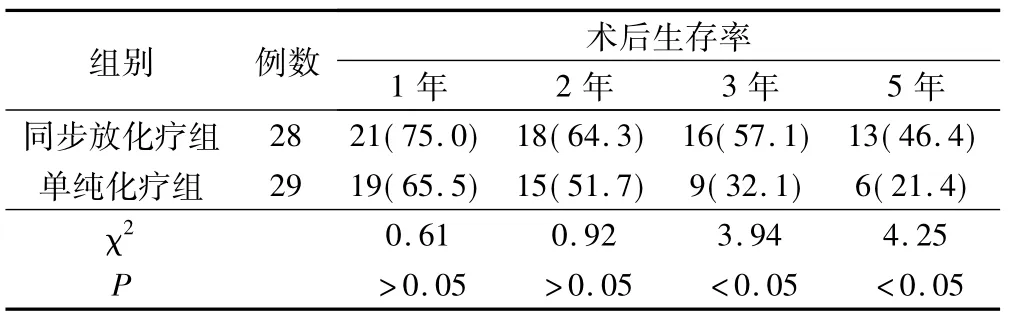
表1 两组患者术后生存率情况(例,%)
2.2 不良反应
两组不良反应主要包括白细胞减少、血小板减少、贫血恶心、呕吐、腹泻、外周神经毒性及手足综合征,且以Ⅰ、Ⅱ度为主,同步放化疗组白细胞减少、恶心呕吐、手足综合征发生率高于单纯化疗组,但可耐受。
3 讨论
胃癌是我国最常见的恶性肿瘤之一,其致死率较高,与胃癌的局部病灶复发和远处转移有着重大的关系[5]。这使得胃癌术后辅助治疗尤为重要,以前大多数临床医生认为胃癌大多数为腺癌,病理类型相对放疗不敏感,加上腹部活动范围大,摆位误差大,易造成剂量分布不均匀,损伤周围正常组织。然而,随着医学技术的突飞猛进,使胃癌的放疗成为可能也取得了一定的疗效[6]。三维适形放疗定位准确,真空体膜制作
体位的重复性较好,减少了摆位误差,可以提高肿瘤的局部控制率。此外,据国外研究发现,放疗可以上调胸苷磷酸化酶的作用,与希罗达同时作用具有增效的作用[7]。放化疗结合可增加放疗敏感性,使周围重要器官处于耐受剂量范围内提高放疗的生物效应,不至于发生较严重的反应及并发症,在胃癌治疗过程中发挥多学科协同作用。本文研究结果表明胃癌术后同步放化疗组1、2、3、5年生存率均高于单纯化疗,且3、5年生存率有统计学意义,出现的不良反应主要为恶心呕吐、白细胞减少等不良反应,大多数Ⅰ、Ⅱ,通过积极的对症治疗,均可耐受。既往研究也表明胃癌术后放化疗的重要意义,Leong等[8]回顾性研究一组大多接受D2淋巴结切除和辅助放化疗临床结果,70例病理分期T3、T4或淋巴结阳性的患者按照INT-0116要求入组为研究对象,67例患者(96%)接受了D2淋巴结清除,65例患者(93%)进行了R0切除,5例(7%)显微镜下边界为R1切除,中位随访时间是27个月(范围为10.1~60.3)。为期3年的总生存率、无病生存期,和局部控制率分别为60.6%,54.1%和84.3%,严重的3或4级胃肠道、血液毒性率分别为15.7%和4.3%。由此得出结论,大于D2淋巴结切除的患者中,肿瘤有良好的控制率,联合放化疗也是耐受的。Solomon等[9]也得出相同的结果,术后放化疗是使患者显著受益。化疗联合术后放化疗将会完善胃癌患者围手术期的治疗,将在可切除胃癌患者中日益重要。总之,胃癌术后辅助放化疗对肿瘤有良好的控制率,能提高远期生存率,且不良反应可耐受,值得临床推广。
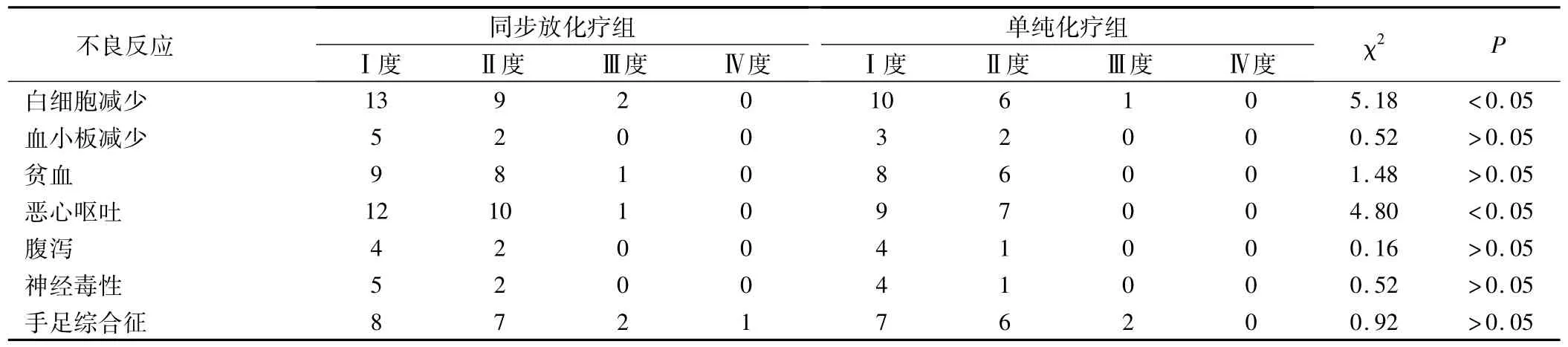
表2 两组不良反应情况/例
[1]季加孚,季鑫.援胃癌治疗的新进展〔J〕.循证医学,2011,11(2):82-86.
[2]詹友庆,李威,孙晓卫,等.胃癌外科治疗的远期疗效研究〔J〕.中华外科杂志,2005,43(17):1109-1113.
[3]Smalley SR,Gunderson L,Tepper J,et al.Gastric surgicaladjuvant radiotherapy consensus report rationale and treatmentimplementation〔J〕.Int J Radiat Oncol Biol Phys,2002,52 (2):283-293.
[4]Parkin DM,Pisani P,Ferlay J.Global cancer statistics〔J〕.CA Cancer J Clin,2005,55(2):74-108.
[5]詹庆友,李威,孙晓卫,等.胃癌外科治疗的远期疗效研究〔J〕.中国医学创新,2009,6(17):1109-1113.
[6]陈杰波,徐焕龙,胡挺.三维适形放疗同步卡培他滨化疗并序贯化疗治疗晚期胃癌疗效观察〔J〕.浙江中西医结合杂志,2012,22(6):6444-6445.
[7]Das P,Wolff RA,Abbruzzese JL,et al.Concurrent capecitabine and upper abdominal radiation therapy is well tolerated〔J〕.Radiat Oncol,2006,12(1):41-49.
[8]Leong CN,Chung HT,Lee KM,et al.Outcomes of adjuvant chemoradiotherapy after aradical gastrectomy and a D2 node dissection for gastric adenocarcinoma〔J〕.Cancer J,2008,14 (4):269-275.
[9]Solomon NL,Cheung MC,Byrne MM,et al.Does chemoradiotherapy improve outcomes for surgically resected adenocarcinoma of the stomach or esophagus〔J〕.Ann Surg Oncol,2010,17(1):98-108.
Effect of 3D-CRT Plus Chemotherapy for Postoperative Gastric Cancer
XIONG Daiqun,LUO Hui.The Third Hospital of Nanchang,Nanchang,330003
ObjectiveTo compare the effects and adverse reactions of chemotherapy and three dimensional conformal radiotherapy(3D-CRT)plus chemotherapy for postoperative patients on gastric cancer.Methods57 patients with gastric cancer after surgery were randomly divided into chemotherapy group and 3D-CRT plus chemotherapy group.29 cases of chemotherapy group received 6 cycles of XP(capecitabine 2 000 mg/m2per day on days 1 to 14 and cisplatin 60 mg/m2on day 1,repeated every 3 weeks)chemotherapy.28 cases of 3D-CRT plus chemotherapy group received 2 cycles of XP followed by 45-Gy XRT (capecitabine 1 650 mg/m2per day for 5 weeks)and 2 cycles of XP.Results1-,2-,3-and 5-year survival rates of radiochemotherapy group was 75.0%、64.3%、57.1%、46.4%.The chemotherapy group was 65.5%、51.7%、32.1%、21.4%.Adverse reactions included decreased white cells,decreased platelet,anemia,nausea,vomiting,diarrhea,peripheral nerve toxicity and handfoot syndrome,and mainly were at grades 1、2.Decreased white cells,nausea,vomiting and hand-foot syndrome in radiochemotherapy group were significantly higher than those of the chemotherapy group,Those adverse reactions of radiochemotherapy were tolerable.Conclusion1-,2-,3-and 5-year survival rates of radiochemotherapy group are higher than those of the chemotherapy group.The difference of 3 and 5-year survival rates are statistically significant.Adverse reactions of radiochemotherapy were tolerable.
Cancer;Capecitabine;Cisplatin;Radiotherapy;Chemotherapy;Radiochemotherapy
10.3969/j.issn.1001-5930.2015.08.033
R735.2
A
1001-5930(2015)08-1215-03
2014-10-16
2015-01-10)
(编辑:吴小红)
330003南昌市第三医院(熊戴群);330029江西省肿瘤医院(罗辉)
罗辉

