外周血T淋巴细胞亚群与免疫球蛋白检测在胃癌病情监测及预后评价中的价值
宋振宇
外周血T淋巴细胞亚群与免疫球蛋白检测在胃癌病情监测及预后评价中的价值
宋振宇
目的探讨外周血T淋巴细胞亚群与免疫球蛋白(Immunoglobulin,Ig)检测对胃癌病情监测及预后评价的意义。方法将475例胃癌患者按照其2年生存率分为预后良好组(n=266)及预后不良组(n=209),并选取同期200例健康体检者,纳入正常对照组,比较各组受试者外周血T淋巴细胞亚群与Ig水平差异,探讨其临床意义。结果胃癌患者外周血CD3+、CD4+、CD4+/CD8+显著低于正常对照组,CD8+显著高于正常对照组(P<0.05);胃癌患者IgG、IgA、C3、C4均显著低于正常对照组(P<0.05),其IgM水平比较未见明显统计学差异(P>0.05)。预后不良组与预后良好组患者外周血T淋巴细胞亚群及Ig水平比较,差异均有统计学意义(P<0.05)。结论胃癌患者会出现明显的外周血T淋巴细胞亚群失调、Ig降低表现,且改变程度越明显则表明患者预后越差,因此,早期检测患者外周血T淋巴细胞亚群与Ig水平有助于判断其预后、指导治疗对策。
T淋巴细胞亚群;免疫球蛋白;胃癌;病情;预后;评价
(The Practical Journal of Cancer,2015,30:1126~1128)
胃癌是我国发病率最高的消化道恶性肿瘤,其病情的进展与患者免疫功能的变化具有密切关联[1]。随着医疗技术的提高,胃癌患者的近期生存质量得到了有效保证,但其5年生存率仍不足50%,因此,进一步探究免疫功能与患者病情及预后的关系有助于早期预后的判断与治疗策略的制定[2]。为此,我们选取外周血T淋巴细胞亚群及免疫球蛋白(Immunoglobulin, Ig)两项指标进行了临床研究,取得了可靠的结论。
1 材料与方法
1.1 临床资料
自我院2008年9月-2012年9月收治的胃癌患者中进行筛选,选取标准:①接受胃癌根治性手术治疗并经术后病理学检查确诊[3];②首发胃癌患者,且入组前未接受其他相关治疗;排除:①合并机体免疫系统
疾病;②合并心、肝、肾等其他重要脏器官疾病;③随访年限不足2年或随访资料不完整。共选取符合条件的患者475例,按照其2年随访结果进行分组,将复发、转移或死亡患者纳入预后不良组[4],其他患者纳入预后良好组。预后不良组209例,男性127例,女性82例,年龄35~74岁,平均(52.1±7.6)岁,预后良好组266例,男性154例,女性112例,年龄33~70岁,平均(53.8±9.1)岁。并选取同期健康体检者200例,在其签署知情同意书并经我院伦理委员会批准后,将其纳入正常对照组,其中男性120例,女性80例,年龄35~72岁,平均(52.9±6.4)岁。各组患者年龄、性别比例等临床资料比较无统计学差异(P>0.05),具有可比性。
1.2 检测方法
1.2.1 T淋巴细胞亚群取受试者(胃癌患者治疗前)空腹静脉血2 ml,置于EDTA抗凝管中,取全血100 μl,加入CD3+、CD4+、CD8+荧光抗体(美国Beckman-Coulter公司)标记,标记成功后取单抗(法国Immunotech公司)20 μl,避光,28℃下染色20 min;加入1.5 ml红细胞裂解液,混匀,避光,28℃下处理10 min,以完全裂解红细胞;以1 500 r/min离心5 min后,留取沉淀物,加入2 ml 0.1%叠氮钠磷酸缓冲液,混匀,再次以1 500 r/min离心5 min,加入1 ml PBS溶液后,于2 h内进行检测。检测设备为NovoCyte系列流式细胞仪(美国ACEA公司)。
1.2.2 免疫球蛋白取受试者(胃癌患者治疗前)空腹静脉血2 ml,3 000 r/min离心后,取上清液,使用IMMAGE型免疫浊度分析仪(美国Beckman-Coulter公司),使用免疫比浊法直接进行Ig检测,检测试剂购自同公司;检测指标包括IgG、IgA、IgM及补体C3、C4。
1.3 观察指标
比较患者与正常对照组外周血T淋巴细胞亚群、Ig水平差异,并比较预后不良组及预后良好组患者外周血T淋巴细胞亚群、Ig水平差异。
1.4 统计学分析
对本临床研究的所有数据采用SPSS 18.0进行分析,对计数资料采用χ2检验,对计量资料采用t检验,检验水准设定为α=0.05,当P<0.05时,认为其有统计学差异。
2 结果
2.1 T淋巴细胞亚群
胃癌患者外周血CD3+、CD4+、CD4+/CD8+显著低于正常对照组,其CD8+显著高于正常对照组(P<0.05);预后不良组患者外周血CD3+、CD4+、CD4+/ CD8+显著低于预后良好组,其CD8+显著高于预后良好组(P<0.05),见表1。
表1 正常对照组与胃癌组外周血T淋巴细胞亚群水平比较(%,±s)
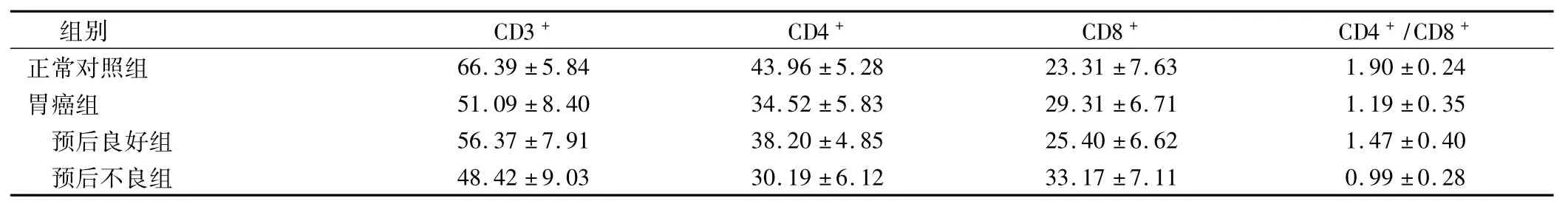
表1 正常对照组与胃癌组外周血T淋巴细胞亚群水平比较(%,±s)
组别CD3+CD4+CD8+CD4+/CD8+66.39±5.8443.96±5.2823.31±7.631.90±0.24胃癌组51.09±8.4034.52±5.8329.31±6.711.19±0.35预后良好组56.37±7.9138.20±4.8525.40±6.621.47±0.40预后不良组正常对照组48.42±9.0330.19±6.1233.17±7.110.99±0.28
2.2 免疫球蛋白
患者组IgG、IgA、C3、C4均显著低于正常对照组(P<0.05),其IgM水平比较未见明显统计学差异(P>0.05);预后不良组组IgG、IgA、C3、C4均显著低于预后良好组组(P<0.05),其IgM水平比较未见明显统计学差异(P>0.05),见表2。
表2 正常对照组与患者组血清免疫球蛋白水平比较(g/L,±s)

表2 正常对照组与患者组血清免疫球蛋白水平比较(g/L,±s)
组别IgGIgAIgMC3C4正常对照组13.95±2.801.99±0.811.07±0.391.19±0.310.35±0.98胃癌组10.36±1.941.35±0.361.06±0.210.62±0.190.18±0.27预后良好组12.07±1.351.90±0.271.05±0.310.84±0.250.26±0.19预后不良组9.33±2.021.16±0.271.07±0.420.53±0.160.14±0.30
3 讨论
肿瘤与机体局部微环境的互相作用主要影响免疫微环境的变化,其对免疫微环境的抑制在促进自身发生、发展甚至转移方面均具有重要作用[5]。机体抗肿瘤机制主要借助于细胞免疫应答的发挥,而细胞免疫
主要依赖T淋巴细胞功能的发挥,T淋巴细胞除能够识别肿瘤细胞,产生抗原刺激外,还能分泌致敏T淋巴细胞用于肿瘤细胞的杀伤,因此,近年来T淋巴细胞在肿瘤进展中的变化受到了广泛关注。同时,有研究发现,在机体抗体产生、炎症反应出现的过程中亦伴随着Ig水平的变化[6],因而对Ig水平的监测亦有望用于胃癌患者病情监测与预后评价。
本研究发现,胃癌患者外周血T淋巴细胞亚群、Ig水平较健康体检者存在较大差异,且预后不良的胃癌患者其差异性更为明显,提示外周血T淋巴细胞亚群、Ig水平的剧烈改变预示着患者病情较重、预后较差,其机制主要包括:①CD3+、CD4+在免疫应答中起到促进、扩大免疫反应的正向作用,而CD8+主要起到抑制细胞免疫进程的负向作用,在健康者机体内,上述3种T淋巴细胞亚群保持着一个较为稳定的动态平衡状态,但随着恶性肿瘤的出现,患者可逐渐发生T淋巴细胞状态异常以及比例失调表现,导致免疫内环境稳定的失常[7];②随着患者免疫内环境稳定被打破,其记忆T细胞的表达逐渐受到抑制,机体对肿瘤细胞的免疫应答作用有所降低,同时,CD3+、CD4+水平的下降以及CD8+水平的上升使得免疫反应受到进一步影响,机体对于肿瘤的清除能力及免疫监视能力均受到抑制,这在一方面也促使肿瘤出现免疫逃逸状态,从而更利于肿瘤细胞的浸润及转移,最终导致患者在术后出现复发、转移甚至死亡等较差的预后[8];③Ig也是机体免疫防御功能的重要组成部分,属于体液免疫范畴,主要作用为抗感染、抗肿瘤及免疫监视。双金权等[9]指出,恶性肿瘤患者在发病早期一般会出现B细胞分化能力增强的体液免疫功能亢进的代偿性表现,但随着患者病程的延长及病情的恶化,其体液免疫功能会迅速下降,导致Ig总体水平的降低,而病情较重、预后较差的患者体液免疫功能下降更为明显;④IgM水平的变化一般见于炎症反应早期,而胃癌患者IgM与正常对照组无明显差异,提示多数患者机体已度过肿瘤细胞产生的早期反应期,此时已出现免疫机能的衰退,进一步印证了上述结论;⑤虽然机体具有较强的生成C3、C4能力,但在肿瘤细胞影响细胞免疫后,补体即被大量消耗,而当机体的补体产生速度无法赶及其消耗速度后,患者肿瘤细胞即会出现猛烈的繁殖态势,引起病情的迅速进展[10],因此,以Ig作为胃癌患者病情监测的指标亦存在一定意义。
综上所述,胃癌患者会出现明显的外周血T淋巴细胞亚群失调、Ig降低表现,这预示着其细胞免疫、体液免疫功能的下降,且上述指标改变程度越明显则表明患者病情越重、预后越差,因此,早期检测患者外周血T淋巴细胞亚群与Ig水平有助于判断其预后、指导治疗对策。
[1]许俊龙,张杰,李玉红,等.D2-40,Paxillin蛋白在早期胃癌中表达的相关性及临床病理学意义〔J〕.实用癌症杂志,2013,28(2):140-143.
[2]Ablimit A,Kühnel H,Strasser A,et al.Abnormal Savda syndrome:Long-term consequences of emotional and physical stress on endocrine and immune activities in an animal model〔J〕.Chin J Integr Med,2013,19(8):603-609.
[3]魏冉,司元全,卞晓琨,等.胃癌患者外周血中单个核细胞及CD3^+CD81^low T细胞中ILT3的表达及意义〔J〕.临床检验杂志,2013,31(9):650-653.
[4]Schmidt K,Zilio S,Schmollinger JC,et al.Differently immunogenic cancers in mice induce immature myeloid cells that suppress CTL in vitro but not in vivo following transfer〔J〕.Blood,2013,121(10):1740-1748.
[5]张晓冬,郭明浩,常占国,等.DC,CIK白体回输对化疗后胃癌患者T淋巴细胞亚群及NK细胞的影响〔J〕.山东医药,2014,54(3):70-72.
[6]Kalathil S,Lugade AA,Miller A,et al.Higher frequencies of GARP+CTLA-4+Foxp3+T regulatory cells and myeloid-derived suppressor cells in hepatocellular carcinoma patients are associated with impaired T-cell functionality〔J〕.Cancer Res,2013,73(8):2435-2444.
[7]叶丽萍,杨海登,沈玲燕.免疫球蛋白样转录子在胃癌患者外周血单个核细胞的表达水平及临床意义〔J〕.中华消化杂志,2014,34(1):50-52.
[8]Carrega P,Bonaccorsi I,Di Carlo E,et al.CD56brightperforinlow noncytotoxic human NK cells are abundant in both healthy and neoplastic solid tissues and recirculate to secondary lymphoid organs via afferent lymph〔J〕.J Immunol,2014,192(8):3805-3815.
[9]双金权,吴婷,庄则豪.NS398对SGC7901胃癌细胞生长及CD44V6,MMP-9基因表达的影响〔J〕.实用癌症杂志,2013,28(1):15-19.
[10]Galletti G,Sung MS,Vahdat LT,et al.Isolation of breast cancer and gastric cancer circulating tumor cells by use of an anti HER2-based microfluidic device〔J〕.Lab Chip,2014,14(1):147-156.
Detection of Peripheral Blood T Lymphocyte Subsets and Immunoglobulin in Monitoring and Prognosis Evaluation of Gastric Cancer
SONG Zhenyu.The First People's Hospital of Liangshan,Liangshan,615000
ObjectiveTo analyze the value of T lymphocyte subsets in peripheral blood and immune globulin(Ig)detection in monitoring and prognosis evaluation of gastric cancer.Methods475 cases of gastric cancer patients,in accordance with 2-year survival rate,were divided into good prognosis group(n=266)and poor prognosis group(n=209),and 200 cases of healthy individuals was the control group,T lymphocyte subsets in peripheral blood and Ig level were compared,and its clinical significance were explored.ResultsThe peripheral blood CD3+,CD4+,CD4+/CD8+in gastric carcinoma were significantly lower than those of the control group,CD8+was significantly higher than that of the control group(P<0.05);IgG,IgA,C3,C4in gastric carcinoma were significantly lower than those of the control group(P<0.05),the IgM level had no statistically significant difference(P>0.05),T lymphocyte subsets in peripheral blood and Ig level in poor prognosis group and good prognosis group had no statistically significant difference(P>0.05).ConclusionGastric cancer patients have obvious peripheral blood T lymphocyte subsets disorders and drop of Ig expression,and the greater the index change,the poorer the prognosis,therefore,early detection of peripheral blood T lymphocyte subsets and Ig level are helpful in judging prognosis and guiding treatment countermeasures.
T lymphocyte subsets;Immunoglobulin;Gastric cancer;Disease;Prognosis;Evaluation
10.3969/j.issn.1001-5930.2015.08.006
R735.2
A
1001-5930(2015)08-1126-03
2014-11-24
2015-04-08)
(编辑:甘艳)
615000四川省凉山州第一人民医院

