中华鳖转铁蛋白基因序列特征及表达研究
李 伟史 燕赵 建洪孝友朱新平
(1. 中国水产科学研究院珠江水产研究所, 农业部热带亚热带水产资源利用与养殖重点实验室, 广州 510380; 2. 上海海洋大学水产与生命学院, 上海 201306)
中华鳖转铁蛋白基因序列特征及表达研究
李 伟1,2史 燕1赵 建1,2洪孝友1朱新平1,2
(1. 中国水产科学研究院珠江水产研究所, 农业部热带亚热带水产资源利用与养殖重点实验室, 广州 510380; 2. 上海海洋大学水产与生命学院, 上海 201306)
转铁蛋白是呼吸链的关键因子, 参与体液和免疫系统的调节, 具有抗菌抗病毒等功能。研究从嗜水气单胞菌诱导的中华鳖肝脏SMART cDNA文库中, 分离克隆了中华鳖转铁蛋白基因cDNA和gDNA全序列,对其序列特征、组织表达及原核表达进行了分析研究。结果显示, 中华鳖转铁蛋白对应全长cDNA的基因组DNA全长为19100 bp, 由17个外显子和16个内含子组成; cDNA全长为2359 bp, 开放阅读框为 2094 bp, 编码697个氨基酸; 转铁蛋白的分子量为76.6 kD, 包含2个糖基化位点, 存在4个二硫键形成区域的缺失, 两个同源结构域的相似性为37%, 信号肽位于第1—19位点。荧光定量PCR结果显示, 正常组中华鳖转铁蛋白基因在肝脏中的表达量最大; 以嗜水气单胞菌刺激后, 其在心、肝、脾和肾脏组织中的表达, 均有一个上调后减少的趋势。此外, 实验还进行了重组转铁蛋白原核表达和Western blot 检测鉴定, 为深入研究中华鳖转铁蛋白功能的提供了基础数据。
中华鳖; 转铁蛋白; 序列分析; 组织表达; 原核表达
中华鳖(Pelodiscus sinensis)是我国重要的水产养殖品种之一[1,2], 2012年养殖产量已达3.3×108kg[3]。在养殖规模扩大过程中, 出现了一些不规范的养殖方式, 产生一些影响产业健康发展的瓶颈问题, 种质混杂、种苗质量参差不齐、疾病频发等现象普遍存在[4]。近年来, 人们开始重视中华鳖的良种培育,特别是中华鳖抗病优良品种的培育。因此, 与中华鳖抗病免疫相关基因结构与功能的研究也越来越多[5]。
转铁蛋白(Transferrins Tf)分布于动物不同器官和组织, 具有不同的生理特性[6], 是细胞摄入铁的主要辅助因子之一, 是呼吸链的关键因子, 参与体液和免疫系统的调节, 具有氧化还原作用, 还是抑制细菌繁殖的重要因子[7,8]。目前, 转铁蛋白在人类(Homo sapiens)、家鼠(Rattus noruegicsu)等哺乳动物和鱼类中研究报道较多[7—9], 在龟鳖动物中的研究报道较少, 仅在黄喉拟水龟(Mauremys mutica)、红耳龟(Trachemys scripta elegans)、绿海龟(Chelonia mydas)中有一些相关研究[10,11]。中华鳖转铁蛋白基因的相关研究则尚未见报道。
近年通过构建cDNA文库来获取基因全长序列及进行EST分析的方法在生物学研究领域得到了长足的发展及广泛的应用[5,12]。本研究根据对实验室现有的嗜水气单胞诱导的中华鳖肝脏全长 cDNA文库的分析, 选择了表达丰度较高的转铁蛋白基因进行研究。在转铁蛋白 cDNA全长序列基础上, 采用PCR及TA克隆方法, 获得转铁蛋白gDNA全长序列, 并对其基因结构、组织表达及原核表达进行了研究, 以期为探索中华鳖转铁蛋白在机体中的免疫机制提供基础数据。
1 材料与方法
1.1 实验材料
实验中华鳖 本实验所用中华鳖取自绿卡实业有限公司(广东省, 东莞市), 共 33只, 平均体重为(160±16) g, 体表完好健康。随机取3只作为空白组, 其他30只随机分为5组, 每组6只(其中随机3只为对照组, 其余3只为实验组)。空白组不做处理,实验组腹腔注射500 μL浓度为1010cfu/mL新鲜培养的嗜水气单胞菌, 对照组腹腔注射 500 μL生理盐水(0.75%), 分别在0、12h、24h、36h和48h采集样本。
实验试剂 致病嗜水气单胞菌菌株, 由珠江水产研究所谭爱萍老师提供。PCR反应试剂、感受态细胞以及PCR切胶回收试剂盒等均购自广州合达生物科技有限公司; 原核表达、Western-blot试剂、引物合成、RNA以及DNA提取试剂盒等均购自英潍捷基(上海)贸易有限。
1.2 实验方法
基因组 DNA和总 RNA提取、反转录及 Tf gDNA全长序列克隆 取中华鳖肝、脾、肾、心等组织, 液氮速冻后–80℃冰箱保存备用。用试剂盒提取各组织总RNA后反转录为cDNA, 并提取空白组基因组DNA。以基因组DNA为模板, 根据Tf 基因 cDNA全长序列设计特异性引物, 扩增 Tf 基因gDNA全长。总RNA提取、cDNA反转录、PCR反应体系、产物纯化回收、连接及单克隆测序等参照高明英等的方法[10]。
组织表达 实时荧光定量 PCR采用 SYBR Green I 染料法在DNA Engine Chromo 4 Real-Time (美国 ABI公司)系统上进行, 并采用相对 CT法(2–△△Ct法)来计算相对表达量。以反转录的 cDNA为模板, 以 actin-F (TGTTACCCATACTGTGCCC ATC) 和 actin-R (GCCATCTCCTGTTCAAAATCCA)为内参, 用 Tf 特异性引物 TFf/TFr (CTACAACT ACTGGACCGACATTCA/ACACTTCTCCTTCTCG T GCTTAC)对试验样本进行荧光定量PCR分析, 每组设三个重复。
原核表达及 Western-blot印记分析 采用In-Fusion法进行重组表达载体的构建, 以合成的cDNA为模板, 以特异性引物TF1f/TF1r (CGATATC CGACCTGGAGCAGAGTAA/GAACAGGCTGGAC TCCTCTTG)和TF2f/TF2r (GTGCCGCGCGGCAGC CATATGGCCGACGTGATCCCGGCATT/TGGTGGT GGTGGTGCTCGAGCTAAGCCAAGGTCGTCAAG TCGCT)进行目的片段的扩增。PCR产物纯化、回收后连接到pET-32a载体上, 构建pET-32a-PSTf 表达载体, 并将重组后的质粒转化到 BL21感受态细胞中。诱导表达和SDS-PAGE凝胶电泳分析方法按高明英等的方法[10]。在 SDS-PAGE电泳后, PVDF膜甲醇中浸泡20s, 然后转移到Tris-Glycine转移缓冲液(5%甲醇)中平衡至少 5min; SDS-PAGE胶在Tris-Glycine转移缓冲液平衡至少30min; 在冷却条件下以 100 v恒压转膜 2h。转膜结束后, 放到T-TBS(含5%脱脂奶粉)室温封闭1h, 然后T-TBS漂洗3次, 每次5min。用增强型HRP-DAB底物显色试剂盒鉴定表达产物。
序列分析和统计学分析 用Vector NTI 11.5对获得的DNA序列进行拼接和分析。利用在线分析软件Expasy、ScanProsite和 SingalP 4.1对氨基酸序列进行分析[13,14]。用CLUSTALX2软件和MEGA 5.0程序, 以最大似然法(ML)构建系统发育进化树[15]。用ESyPred3D web server 1.0构建Tf的三维结构, 并用 RasMol-Raindy软件分析[10]。运用统计学软件SPSS 11.5进行单因素相关性分析, 实验组与对照组间P<0.05为差异显著, P<0.01则为差异极显著。
2 结果
2.1 中华鳖转铁蛋白基因序列分析
Tf基因序列分析 中华鳖转铁蛋白cDNA全长为2359 bp。开放阅读框(Open reading frame, ORF)长度为 2094 bp, 起始密码子为 ATG, 终止密码子为TAG, 编码697个氨基酸。其5′ UTR长为46 bp, 3′-UTR长217 bp, 且3′端存在一个33 bp的PolyA序列。其中, mRNA 3′端的加尾信号(AATAAA)位于polyA上游21 bp处。通过NCBI数据库, 将中华鳖转铁蛋白的cDNA序列进行blastn对比分析, 结果显示: 与其同源性最高的为绿海龟、红耳龟和黄喉拟水龟, 均高达 97%, 其次是扬子鳄(Alligator sinensis)、豹纹守宫(Eublepharis macularius)、绿头鸭(Anas platyrhynchos), 相似性均大于80%。构建的23个物种的转铁蛋白发育进化树(图1)显示, 4种龟鳖目动物在进化树中首先聚类, 后与爬行类和鸟类聚类在一起, 然后与哺乳类聚类在一起, 但与两栖类在进化树上的距离比较远。
中华鳖转铁蛋白对应全长cDNA的基因组DNA全长为19100 bp, 其中包含16个内含子, 17个外显子。每个内含子都包含剪切供体或受体连接处的“GT/AG”序列特征(表1)。基因组DNA与cDNA序列结构比较(图 2), 其中 ORF区的起始密码子位于第一个外显子处, 终止密码子位于最后一个外显子处。5′端和3′端非编码区均为单一外显子, 不包含内含子。

图1 23个物种转铁蛋白基因的系统发育进化树Fig. 1 The phylogenetic tree of Tf gene of 23 species
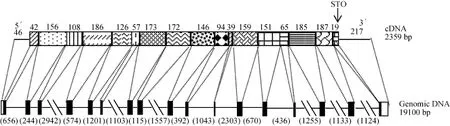
图2 中华鳖转铁蛋白基因cDNA及DNA结构示意图Fig. 2 The above schematic diagram shows the structural features of cDNA and genomic DNA of Pelodiscus sinensis Tf

表1 中华鳖转铁蛋白基因内含子与外显子的接点及两侧的序列Tab. 1 Intron-exon junctions and flanking sequences of Tf gene of Pelodiscus sinensis
Tf基因结构分析 根据ProtParam在线软件分析, 中华鳖转铁蛋白分子量为 76.6126 kD, 分子式为 C3376H5230N912O1044S41, 共包含 10603个原子,理论等电点(pI)为6.07。利用SignalP 4.1 Server在线工具对其氨基酸序列分析, 在序列的第1至第19位点,发现信号肽序列“MRFAPRAALAWALLVFCSA”。利用 ScanProsite在线工具, 预测中华鳖转铁蛋白的结构功能位点, 信号肽后的氨基酸序列可以分为两个同源的结构域: N-端的结构域(23—340位点)和C-端的结构域(349—678位点), 两个同源结构域的相似性为37%, 中间间隔8个氨基酸。每个结构域均包含两个亚基, 并分别具有4个重金属(Fe3+)结合位点(为Asp76/Asp399、Tyr108/Tyr436、Tyr 202/Tyr 532和 His261/His600)和 4个碳酸根阴离子(CO32–)结合位点(为 Thr76/Thr399、Arg108/Arg436、Ala 202/ Ala532和Gly261/ Gly600)。此外, 中华鳖Tf还包含11个二硫键形成区域(N-端5个和C-端6个)、糖基化位点2个、酰胺化位点3个、酰基化位点10个、蛋白激酶C磷酸化位点10个、cAMP- and cGMP-dependent 蛋白激酶磷酸化位点 2个以及酪蛋白激酶Ⅱ磷酸化位点20个。发现了转铁蛋白家族的标志序列, 分别为 108—117(序列为 YySVAVVKKG)、436—445(序列为YyAVAVVKKS)和532—547 (序列为YtGAFRCLvek.GDVAF)。
使用ExPASy在线分析中的SOPMA功能对中华鳖转铁蛋白氨基酸序列的二级结构进行分析, 其中α螺旋数占全结构的31.28%, 延伸链占17.79%, β转角占5.88%, 不规则卷曲占45.05%。利用EsyPred 3D web server 1.0在线软件, 对中华鳖转铁蛋白氨基酸序列的三级结构进行预测。蛋白的高级结构显示(图3), 中华鳖Tf由两个半球型功能结构叶反向结合构成一个完整的球蛋白构象; 每个功能结构域分为两个子结构域, 互靠近构成Fe3+和CO32–的结合区域。
2.2 中华鳖转铁蛋白基因组织表达特征
正常状态下中华鳖转铁蛋白基因组织表达特征通过实时荧光定量PCR检测, 转铁蛋白基因在正常(空白组)中华鳖的 4个组织中的相对表达量, 以β-actin为内参基因, 其中转铁蛋白基因在肾脏组织的表达设定为10, 其他3个组织的表达量分别是相对肾脏组织的表达量(图4)。结果表明转铁蛋白基因在中华鳖的心脏、肝脏、脾脏和肾脏组织中均有表达。其中在肝脏中的表达量最高, 且与其他组织相比差异极显著(P<0.01)。脾脏组织的表达量次之, 且与其他组织相比差异显著(P<0.05)。在心脏和肾脏组织中的表达量较低。

图3 中华鳖转铁蛋白三级结构预测图Fig. 3 The tertiary structure of Pelodiscus sinensis Tf
嗜水气单胞菌刺激诱导后中华鳖转铁蛋白基因组织表达特征 为了进一步研究转铁蛋白的功能,实验设置了嗜水气单胞菌诱导实验, 分别在中华鳖感染后0、12h、24h、36h和48h后采集对照组和实验组样本, 通过实时荧光定量PCR检测中华鳖在嗜水气单胞菌诱导刺激后, 转铁蛋白基因在中华鳖心脏、肝脏、脾脏和肾脏组织中的表达情况。结果表明, 随着诱导时间的推移, 转铁蛋白基因在心脏、肝脏、脾脏和肾脏组织中的表达均为先被诱导上调后减少的动态变化趋势(图5)。其中, 中华鳖在嗜水气单胞菌诱导 12h后, 转铁蛋白基因在肝脏和心脏中的表达出现了显著上调(P<0.05), 实验组分别是对照组的6.05倍和1.89倍; 在诱导24h后, 转铁蛋白在脾脏中的表达出现了显著上调(P<0.05), 实验组分别是对照组的5.60倍; 在诱导36h时, 转铁蛋白在肾脏中的表达出现了显著上调(P<0.05), 实验组分别是对照组的1.69倍。
2.3 中华鳖转铁蛋白原核表达及Western blot鉴定
将pET-32a-Tf重组质粒转化到大肠杆菌BL21,重组菌经0.8 mmol/L IPTG 37℃分别诱导表达1h、2h、3h及4h后, 与空载BL21/pET重组菌(37℃诱导4h)的结果一起通过SDS-PAGE电泳检测(图6)。重组诱导菌与空载菌比较发现, 在目标条带处出现了很强的蛋白条带, 且与理论推算的蛋白分子量(95 kD)相符。IPTG诱导3—4h的表达菌, 融合蛋白的表达量较大。以pET-32a 为表达载体所表达的融合蛋白带 His标签, 实验以 His-probe 抗体(H-15) (sc-803)为一抗, 羊抗兔 IgG-HRP(美国 Pierce)为二抗。进行 Western blot检测(图 7)。进行 Western blotting 分析在 95 kD 位置出现了特异的反应带,特意条带的位置与预期相符, 表明蛋白表达成功。

图 5 不同感染时间中华鳖转铁蛋白基因在不同组织中的表达特征Fig. 5 The expression characteristics of Pelodiscus sinensis TF in different tissues with different stimulation time

图6 重组菌表达SDS-PAGE电泳检测结果Fig. 6 SDS-PAGE of Pelodiscus sinensis Tf expressed in BL21

图7 Western blot 检测中华鳖重组转转铁蛋白Fig. 7 Western blot analysis of the recombinant transferrin of Pelodiscus sinensis TF
3 讨论
自 1945年人类转铁蛋白首次从血清鉴别出以来, 关于转铁蛋白的研究一直持续至今[16]。人类和家鼠等哺乳动物的转铁蛋白相关研究已经深入到临床检测和治疗应用等方面[5,17]。但是龟鳖动物的相关研究却刚刚开始, 仅在黄喉拟水龟、红耳龟、绿海龟中有一些相关研究报道[10,11]。
中华鳖转铁蛋白基因组DNA序列包含16个内含子和 17个外显子, 与家鼠、石斑鱼(Epinephelus awoara)和黄喉拟水龟的转铁蛋白基因组DNA结构组成相似[10,18]。但有报道称, 人的Tf 有17个内含子和18个外显子, 其编码区起始于第2个外显子[19]。中华鳖转铁蛋白cDNA的ORF区可编码697个氨基酸组成的多肽链, 比黄喉拟水龟短 9个氨基酸, 但两者信号肽长度相同[10]。在目前已报道的人、鼠、鸟类、鱼类以及两栖爬行类中, 转铁蛋白具有高度保守的功能结构域[20]。中华鳖具有典型转铁蛋白结构, 含有两个相似的同源结构域, 相似性为 37%,黄喉拟水龟、草鱼(Ctenopharyngodon idellus)、人和真鲷(Pagrosomus major)的为 38.4%[10]、40%[19]、31%[21]和36%[22]。每个结构域都含有 4个Fe3+和4个CO32–结合位点, 可以可逆结合运输金属离子, 完成生理功能。中华鳖转铁蛋白的铁离子结合位点包括1个Asp76、1个His和2个Tyr, 和人转铁蛋白X-ray构象研究的结果相一致, 这些活性功能位点高度保守[20]。
研究发现, 转铁蛋白的两个结构域起源于机体进化中基因复制形成的, 且 C-端结构域与铁离子的结合作用更稳定[23]。二硫键对蛋白质构象起维持稳定作用, 多数脊椎动物的转铁蛋白通常具有 15 个二硫键[24]: N端6个和C端9个。但中华鳖和黄喉拟水龟一样均存在二硫键形成区域的缺失情况, 均在N端缺少1个, C端缺少3个。在C端, 中华鳖比黄喉拟水龟多一个糖基化位点, 增加了 C-端结构域的稳定性和可修饰性。
对基因组织表达和免疫刺激表达图谱的研究,是分析基因功能的重要方法, 也可直接反应其免疫相关性。实验结果表明, 正常中华鳖转铁蛋白基因在肝脏中的表达量最高, 与黄喉拟水龟[10]等其他很多脊椎动物相似。鸡的肝脏灌流实验显示肝脏是转铁蛋白的主要合成组织, 揭示了转铁蛋白在肝脏组织中较高表达量的原因[25]。以嗜水气单胞菌刺激后,中华鳖转铁蛋白基因在心、肝、脾和肾脏组织中的表达量均有上调, 表明转铁蛋白参与了中华鳖的免疫应答反应。其中, 转铁蛋白基因在肝脏组织中的表达最先呈现显著上调, 且在肝脏和脾脏组织中的表达上调趋势最明显。通过嗜水气单胞菌的免疫刺激, 激活了中华鳖先天免疫系统, 可能导致呼吸或体液的改变, 诱导肝脏合成更多的转铁蛋白。脾脏是重要的造血器官和免疫器官, 嗜水气单胞菌引起转铁蛋白在脾脏中的表达上调[21]。此外, 中华鳖转铁蛋白原核表达的成功, 为此后蛋白分离纯化、抗菌活性以及功能研究奠定了基础。
[1] Zhou F, Ding X, Feng H, et al. The dietary protein requirement of a new Japanese strain of juvenile Chinese soft shell turtle, Pelodiscus sinensis [J]. Aquaculture, 2013, 412: 74—80
[2] Li H, Zhou Z S, Wu T, et al. Do fluctuations in incubation temperature affect hatchling quality in the Chinese soft-shelled turtle Pelodiscus sinensis [J]. Aquaculture, 2013, 406: 91—96
[3] The Ministry of Agriculture Fisheries Bureau. China fishery statistical yearbook [R]. Beijing: China Agriculture Press. 2013, 30 [农业部渔业局. 中国渔业统计年鉴. 北京: 中国农业出版社. 2013, 30]
[4] Chen J, Zhu N, Kong L, et al. First case of soft shell disease in Chinese soft-shelled turtle (Trionyx sinens) associated with Aeromonas sobria-A. veronii complex [J]. Aquaculture, 2013, 406: 62—67
[5] Zhou X X, Huang R, Guo Q L. Subtractive cDNA library construction in major organs of aeromonas hydrophila infection turtles [J]. Acta Hydrobiologica Sinica, 2007, 31(4): 509—515 [周秀霞, 黄容, 郭琼林. 嗜水气单胞菌感染的中华鳖主要器官差减 cDNA 文库的构建. 水生生物学报, 2007, 31(4): 509—515]
[6] Li Z, Weiping X, Yude S, et al. Transferrin-transferrin receptor mediated initiative targeted therapy of tumor [J]. China Pharmaceuticals, 2012, 5: 002
[7] Jurecka G F, Wiegertjes K L. Rakus A, et al. Genetic resistance of carp (Cyprinus carpio L.) to Trypanoplasma borreli: Influence of transferrin polymorphisms [J]. Veterinary Immunology and Immunopathology, 2009, 127(1): 19—25
[8] Zhang D, Nandi S, Bryan P, et al. Expression, purification, and characterization of recombinant human transferrin from rice (Oryza sativa L.) [J]. Protein Expression and Purification, 2010, 74(1): 69—79
[9] Easy R H, Trippel E A, Burt M D B, et al. Identification of transferrin in Atlantic cod Gadus morhua epidermal mucus [J]. Journal of Fish Biology, 2012, 81(6): 2059—2063
[10] Gao M Y, Zhu X P, Zhao M, et al. Cloning and expression pattern analysis of transferrin gene in yellow pond turtle [J]. Acta Hydrobiologica Sinica, 2011, 35(4): 557—564 [高明英,朱新平, 赵密, 等. 黄喉拟水龟转铁蛋白基因的克隆以及表达特征分析. 水生生物学报, 2011, 35(4): 557—564]
[11] Gao M Y, Zhu X P, Shi Y, et al. Recombinant expression and antimicrobial activity analysis of transferrin gene in yellow pond turtle [J]. Acta Hydrobiologica Sinica, 2012, 36(5): 892—897 [高明英, 朱新平, 史燕, 等. 黄喉拟水龟转铁蛋白重组表达及抗菌活性分析. 水生生物学报, 2012, 36(5): 892—897]
[12] Zhang X J, Qu G, Zhu W L, et al. Construction of intestinal cDNA library and analysis of some expressed sequence tags sequencing of Ctenopharyngodon idellus [J]. Acta Hydrobiologica Sinica, 2007, 31(2): 251—258 [张学俊, 屈刚, 朱文漓, 等. 草鱼肠道 cDNA文库构建及部分 ESTs分析. 水生生物学报, 2007, 31(2): 251—258]
[13] Bjellqvist B, Basse B, Olsen E, et al. Reference points for comparisons of two-dimensional maps of proteins from different human cell types defined in a pH scale where isoelectric points correlate with polypeptide compositions [J]. Electrophoresis, 1994, 5: 529—539
[14] Bendtsen J D, Nielsen H, von Heijne G, et al. Improved prediction of signal peptides: SignalP 3.0 [J]. Journal of Molecular Biology, 2004, 340: 783—795
[15] Kumar S, Tamura K, Nei M. MEGA3: An integrated software for molecular evolutionary genetics analysis and sequence alignment [J]. Integrative and Comparative Biology, 2003, 43: 947
[16] Holmberg C G, Laurell C B. Investigations in serum copper; nature of serum copper and its relation to the iron-binding protein in human serum [J]. Acta Chemica Scandinavica, 1946, 1(10): 944—950
[17] Gomme P T, McCann K B, Bertolini J. Transferrin: structure, function and potential therapeutic actions [J]. Drug Discovery Today, 2005, 10(4): 267—273
[18] Liu H, Takano T, Abernathy J, et al. Structure and expression of transferringene of channel catfish, Ictalurus punctatus [J]. Fish & Shellfish Immunology, 2010, (28): 159—166
[19] Wang F, Huang L Y. Cloning and sequence analysis of human transferrin gene [J]. Jinan University (Medical Sciences), 2007, 28(2): 111—119 [王峰, 黄璐圆. 人转铁蛋白基因的克隆及序列分析. 暨南大学学报(医学版), 2007, 28(2): 111—119]
[20] Mizutani K, Toyoda M, Mikami B. X-ray structures of transferrins and related proteins [J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2012, 1820(3): 203—211
[21] Wang N, Chen Q, Hu C Y. Cloning and tissue expression of carp transferrin gene [J]. Acta Hydrobiologica Sinica, 2010, 34(1): 51—56 [王娜, 陈琼, 胡成钰. 草鱼转铁蛋白基因的克隆及其组织表达. 水生生物学报, 2010, 34(1): 51—56]
[22] Cai Z H, Song L S, Gao C P, et al. Cloning and expression analysis of pagrus transferring [J]. High-tech Communications, 2005, 15(5): 105—l10 [蔡忠华, 宋林生, 高春萍,等.真鲷转铁蛋白基因的克隆与表达特征分析. 高技术通讯, 2005, 15(5): 105—l10]
[23] Gkouvatsos K, Papanikolaou G, Pantopoulos K. Regulation of iron transport and the role of transferrin [J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2012, 1820(3): 188—202
[24] Justyna Ciuraszkiewicz, Marian Biczycki, Aleksandra Maluta, et al. Reptilian transferrins: Evolution of disulphide bridges and conservation of iron-binding center [J]. Gene, 2007, (396): 28—38
[25] Vassy J M, Rissel, M Kraemer, et al. Ultrastructural indirectimmunlocaoization of transferrin in cultured rat hepatocytes Rermeabilized with saponin [J]. Journal of Histochemistry & Cytochemistry, 1984, 32: 538—540
MOLECULAR CHARACTERISTICS AND THE EXPRESSION OF TRANSFERRIN GENE IN CHINESE SOFT SHELL TURTLE
LI Wei1,2, SHI Yan1, ZHAO Jian1,2, HONG Xiao-You1and ZHU Xin-Ping1,2
(1. Key Laboratory of Tropical & Subtropical Fishery Resource Application & Cultivation of Ministry of Agriculture, Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510380, China; 2. College of Fisheries and Life, Shanghai Ocean University, Shanghai 201306, China)
Transferrin has a variety of biological functions such as iron transportation, anti-microbial, and immunoregulation. In this study, we isolated the full length cDNA of transferrin of Chinese soft shell turtle (Pelodiscus sinensis) from the constructed liver cDNA library. The cDNA sequence consisted of 2359 bp, including an open reading frame (ORF) of 2094 bp which could encode a 674-aa peptide. The genomic DNA of transferrin consisted of 19100 bp and contained 17 exons and 16 introns, with a structure similar to that of other vertebrates. Using the online software we predicted the molecular characteristics of transferrin. The results indicated that the N-lobe of transferrin had a signal peptide of 19 amino acids; this gene was composed of two similar domains with a similarity of 37%. There were 2 N-linked glycosylation sites in the N-lobe, and 11 disulfide bonding formation areas in amino acids peptide. The quantitative PCR results showed that the expression of transferrin was the highest in liver in the normal group. The results also showed that after the infection with Aeromonas hydrophila the expression of this gene was first increased and then decreased in liver, spleen, kidney and heart, and the increase was particularly high in liver and spleen. Moreover, we applied western-blot to testify the prokaryotic expression of transferrin of Chinese soft shell turtle. This study could provide insights into the biological functions of transferrin in non-specific immune responses.
Chinese soft shell turtle; Transferrin; Sequence analysis; Tissue-specific expression; Prokaryotic expression
Q781
A
1000-3207(2015)03-0482-08
10.7541/2015.64
2014-06-06;
2014-09-12
广东省海洋渔业科技推广专项(A201201E05); 广东省科技计划项目(2012B020307003); 广州市珠江科技新星专项(2012J2200091)资助
李伟(1984—), 女, 山东聊城人; 博士研究生; 研究方向为种质资源与遗传育种。E-mail: 15013083966@163.com
朱新平(1964—), 男, 研究员, 博士生导师; E-mail: zhuxinping_1964@163.com

