美洲鲥仔稚鱼异速生长模式研究
高小强洪 磊刘志峰郭正龙王耀辉雷霁霖
(1. 中国海洋大学, 青岛 266003; 2. 中国水产科学院黄海水产研究所, 农业部海洋渔业可持续发展重点实验室, 青岛市海水鱼类种子工程与生物技术重点实验室, 青岛 266071; 3. 江苏中洋集团, 南通 226600)
美洲鲥仔稚鱼异速生长模式研究
高小强1,2洪 磊2刘志峰2郭正龙3王耀辉3雷霁霖2
(1. 中国海洋大学, 青岛 266003; 2. 中国水产科学院黄海水产研究所, 农业部海洋渔业可持续发展重点实验室, 青岛市海水鱼类种子工程与生物技术重点实验室, 青岛 266071; 3. 江苏中洋集团, 南通 226600)
异速生长指生物体某一特征的相对生长速率不等于第二种特征的相对生长速率, 身体各个功能器官表现出了生长不同步的现象, 是动植物长期适应外界环境所进化保留下来的发育特征[1,2]。在鱼类早期发育过程中, 很多仔鱼的各个器官的发育也存在着不同的生长阶段, 即器官在早期发育中具有比整体更快的生长速率, 一直到器官发育完全或者发育达到某一阶段后, 生长明显变慢或与整体对比表现为等速生长[3,4]; 这种发育策略保证了仔鱼如摄食、呼吸和运动等重要器官的优先发育, 从而提高了其逃避敌害和主动摄食的能力, 为适应复杂多变的生活环境提供了保障。
美洲鲥(Alosa sapidissima), 隶属于鲱形目(Clupeiformes), 鲱科(Clupeidae), 西鲱属(Alosa), 是鲱形目中个体比较大的一种, 其肉质鲜美, 脂厚, 鳞鲜, 汤美, 口感滑润, 具有很高的营养价值; 目前其主要生活在北美洲大西洋西岸(加拿大魁北克省到美国的佛罗里达州)[5]、太平洋海岸的加州圣地亚哥到阿拉斯加[6]、俄罗斯的堪察加半岛[7]及亚洲东南部等地区[8], 是北美地区重要的经济鱼类之一。美洲鲥与中国鲥同科不同属, 它与中国鲥不仅外形及生活习性相似, 而且都具有较高的营养价值, 在中国鲥濒临绝迹的情况下, 美洲鲥养殖产业可适当的弥补我国鲥资源的缺乏和市场的空白, 具有重大的社会与经济意义。
目前, 国外学者就美洲鲥种群、迁徙及遗传等相关方面进行了研究[9—12], 而国内学者主要集中在繁育技术等方面的研究, 如美洲鲥受精卵孵化驯养[13]、苗种培育[14,15]和人工繁殖[16]等, 少数学者如洪孝友[17]及张呈祥等[18]对美洲鲥早期发育形态组织学及生长特性进行了研究, 对提高美洲鲥早期培育过程中的成活率提供了理论基础。本实验通过对美洲鲥仔、稚鱼早期异速生长模式的系统研究,旨在了解其仔、稚鱼在早期发育过程中器官发育的优先性及不同发育阶段的生长速率, 完善美洲鲥早期器官发育的基础数据, 为美洲鲥人工繁育技术和健康养殖提供理论参考。
1 材料与方法
1.1 实验材料
本实验所用美洲鲥仔、稚鱼样本来自江苏中洋集团繁育中心。取同一批次自然受精卵, 置于400 L锥形纤维玻璃钢孵化缸中连续微充气、流水孵化, 孵化水温(21.0± 0.5)℃ ,每2h分拣出坏死卵。孵出仔鱼转移到5吨水泥池(2.5 m×2 m×1.0 m)中, 培育水温为(20.5±1.0)℃ ,不间断充气, 溶解氧>7 mg/L, pH 7.3±0.2, 总氨氮<0.05 mg/L,每日清污; 3d后仔鱼开口进食, 3—15日龄时投喂轮虫,随后加喂桡足类和枝角类无节幼体, 20日龄开始添加大型桡足类和枝角类, 30日龄开始投喂山东升索微粒子颗粒饲料。养殖用水为经充分过滤、曝气及消毒处理后的地下水。
1.2 实验方法
应用光学显微镜(NIKON YS100)和解剖镜(XTL-2400)观察仔、稚鱼早期形态发育并拍照。仔、稚鱼发育阶段依据洪孝友[17]的方法进行划分, 即: 从出膜到卵黄囊和油球被完全吸收再到鳞片开始出现, 视为仔鱼期; 当鳞片出现到全身铺满鳞片为止, 视为稚鱼期。实验期间, 从初孵仔鱼即0—45日龄, 每天随机取样15尾, MS-222麻醉,用解剖镜观察各个器官形态变化, 运用光学显微镜和游标卡尺测量其全长、眼径、体高、吻长、口宽、头长、头高、躯干长、胸鳍及尾鳍长等指标(图1)。
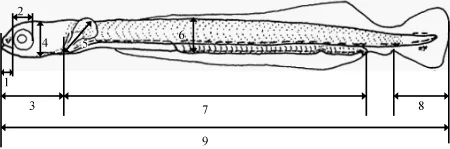
图 1 美洲鲥仔、稚鱼测量模式图Fig. 1 Illustration measurement for American shad larvae
1.3 数据处理
全长与日龄的函数关系采用指数方程表达: y=aebx,其中x为日龄, y为日龄x所对应的全长, a为初始全长, b为生长率[19]。异速生长模型以幂函数形式表示即 y=axb,其中自变量x为仔、稚鱼全长, y为与自变量x相对应的各种器官的长度, a为在y轴上截距, b为异速生长指数;当b值为1时, 表现出等速生长; 当b值大于1时, 表现出快速增长(正异速生长); 当b值小于1时, 表现出慢速增长(负异速生长)。若幂函数生长模型中含有不同生长阶段, 则以拐点分开, 不同生长阶段由不同生长方程表达: y=a1xb1, y=a2xb2。对b1、b2进行 t检验, 检测两个b值是否存在差异显著性, 同时对b1、b2是否等于1做t检验。应用SPSS18.0统计软件对模型进行非线性回归参数拟合,并应用OriginPri8.0进行分段回归模型拟合, 以决定系数R2最大和残差平方和最小为曲线拟合标准, 求得拐点值,用 SPSS 18.0统计软件进行显著性检测, P<0.05表示具有显著性差异。
2 结果
2.1 全长与日龄的关系
美洲鲥仔、稚鱼全长随日龄的变化符合指数方程y=7.978×e0.035x, 其中x表示为日龄, R2为0.993, 拟合效果较好 (图2a)。美洲鲥初孵仔鱼全长为(7.55±0.12) mm,经过 45d生长, 全长达到(37.12±1.73) mm, 生长率为0.035 mm/d。
2.2 美洲鲥早期发育过程中各功能器官的异速生长
美洲鲥身体部分的异速生长 美洲鲥头长(图2b)、头高(图 2c)、体高(图 2g)和躯干长(图 2h)从初孵仔鱼 [TL: (7.55±0.30) mm]到45日龄[TL: (37.12±1.73) mm],四者相对于全长的生长速率均表现出了异速生长现象,异速生长指数分别为1.392、1.768、1.696和0.736, 与1之间均存在显著差异(P<0.05)。由此可见, 头长、头高和体高均表现出明显的快速生长, 而躯干生长则表现出慢速生长, 数据表明在45日龄中四者均未出现生长拐点。
美洲鲥头部器官的异速生长 口宽(图 2d)的生长拐点出现在24日龄[TL: (18.34±1.24) mm], 异速生长指数为1.204 (P<0.05), 相对于全长的生长速率表现出快速生长; 自24日龄到45日龄(TL: (37.12±1.73) mm), 异速生长指数为1.032 (P>0.05), 表现为等速生长。
吻长(图 2e)的生长拐点出现在 23日龄[TL: (18.05±1.70) mm], 异速生长指数为1.777 (P<0.05), 相对于全长的生长速率表现出快速生长; 自23日龄到45日龄[TL: (37.12±1.73) mm], 异速生长指数为1.007 (P>0.05),表现为等速生长。
眼径(图2f)的生长自初孵仔鱼 [TL: (7.55±0.30) mm]到45日龄[TL: (37.12±1.73) mm]并没有出现生长拐点, 异速生长指数为 1.317 (P<0.05), 相对于全长的生长速率表现出快速生长。

图2 美洲鲥日龄、全长关系及异速生长曲线Fig. 2 Relationship between age in days and total length and allometric growth curve of Alosa sapidissima
美洲鲥游泳器官的异速生长 尾鳍长(图 2i)的生长拐点出现在24日龄[TL: (18.34±1.24) mm], 异速生长指数为1.366 (P<0.05), 相对于全长的生长速率表现出快速生长; 自24日龄到45日龄[TL: (37.12±1.73) mm], 异速生长指数为1.025 (P>0.05), 表现为等速生长。
胸鳍长(图2j) 自初孵仔鱼[TL: (7.55±0.30) mm]到45日龄[TL: (37.12±1.73) mm]并未出现生长拐点, 异速生长指数为 1.419 (P<0.05), 相对于全长的生长速率表现出快速生长。
3 讨论
在大多数硬骨鱼类中, 仔鱼早期发育和器官分化是个极其重要而又复杂的过程, 包括形态发生, 身体外形、体内新陈代谢和生活行为等变化[20,21], 所有这些变化都是对外界恶劣生活环境的适应性选择, 而这种选择在仔鱼早期发育过程中主要体现在一些功能器官如感觉、摄食、游泳等器官快速的生长即异速生长。异速生长反映了在特定环境中, 鱼类早期发育过程中形态和表型的可塑性[22,23], 是自身基因表达和外界环境共同作用的结果[24],是鱼类为了提高摄食、躲避敌害及延续种群繁衍经过长期进化所保留下来的发育特征和个体发育策略, 即优先发育对有利提高存活的那些功能器官。当仔鱼孵化后, 与摄食、游泳的一些重要功能器官优先发育, 表现出快速生长,经过一段时间后这些器官生长速度会明显减慢, 这种身体各个部分生长方式存在相对生长差异的特殊现象在很多鱼类中均存在, 如(Miichthys miiuy)[25]、鲤(Cyprinus carpio)[26]、大麻哈鱼(Oncorhynchus keta Walbaum)[27]、粗唇龟鲻(Chelon labrosus)[28], 这暗示了鱼类保持摄食和游泳器官的优先发育是其自身逃避敌害、提高成活率的一项生理机制。
很多研究表明鱼类头部优先发育是鱼类早期发育过程中普遍存在的现象, 头部的快速生长为仔鱼早期大脑、视觉、呼吸和摄食器官的发育提供了足够的生长空间, 从而保证仔鱼在生活环境中获得最佳的生态位[21,24,29]。在本实验中, 美洲鲥自初孵仔鱼生长到 45日龄, 头长、头高处于快速生长, 这与上述研究结论相一致, 这说明了美洲鲥仔鱼头部的快速生长保证了其头部各项功能器官(脑、呼吸、感觉和摄食等器官)的发育和完善, 为其获得最佳的摄食生态适应性提供了保障。
鱼类早期发育过程中躯干部的形态发生主要包括肌节、骨节的分化生长和消化系统的发育[29], 而且躯干部是链接头部和尾部的重要部位, 在运动过程中发挥着重要的作用。在本实验中, 美洲鲥仔、稚鱼躯干部的生长表现为慢速生长, 分析认为一方面可能是肌节、骨节的进一步发育和完善在美洲鲥仔鱼早期发育过程中占次要地位, 不予优先发育; 另一方面可以控制鱼体全长,减少头部和尾部间的距离, 保证仔鱼运动性更协调, 这对于游泳器官处于发育初期的仔鱼而言可能具有一定的生理意义。
仔、稚鱼摄食能力的强弱与口宽、吻长的发育和完善程度密切相关。有研究表明口裂的快速生长是仔鱼开口后,即进入混合营养期, 向外界摄取食物的压力随着卵黄囊内营养不断消耗而增大, 口仍然继续生长, 以适应大小不同的食物[26,30]。Peña等[31]研究也表明口裂快速发育是为了摄食更大的猎物。在本实验中, 美洲鲥仔、稚鱼口宽生长拐点出现在24日龄, 吻长拐点出现在23日龄, 拐点后两者均表现出等速生长, 可见, 美洲鲥仔鱼生长到 24日龄, 口的发育已经较为完善, 可以摄食较大规格的食物, 在实验中, 自20日龄便开始投喂大型动物性饵料(桡足类和枝角类), 类似的结果也在吴水清等[32]对石斑鱼杂交子代仔、稚鱼的研究中得到了证实。另外, 仔、稚鱼早期的生长发育与饵料种类及其营养组成密切相关。不同的饵料富含的营养成分存在着差异性。在美洲鲥早期发育过程中, 自3日龄开始投喂轮虫, 随着仔鱼的生长逐步添加营养更加丰富的桡足类和枝角类, 30日龄后开始添加营养全面的微粒子颗粒料; 在一系列饵料转变的阶段, 美洲鲥获得了更优的营养源, 保证了其各个器官快速生长发育, 而在23日龄和24日龄后美洲鲥吻长和口宽均呈现了相对于全长等速生长, 这暗示了吻长和口宽的生长已完成了优先发育, 进入次要发育阶段。对一些其他硬骨鱼类研究也表明, 一旦器官生长优先顺序完成, 就会进入趋向于与全长等速的生长阶段[33,34]。由此可见, 美洲鲥生长到24日龄时, 口的发育已经较为成熟, 摄食能力较强。美洲鲥仔、稚鱼体高的快速生长可能主要是消化器官及其消化腺的快速分化和发育, 以期提高美洲鲥仔、稚鱼的消化能力, 从而适应饵料系列的转变, 保证其消化生理的顺利进行。这与对斑带副鲈(Paralabrax maculatofasciatus)[31]的研究相似。
视觉器官-眼睛发育的程度直接关系到仔、稚鱼摄食和逃避敌害的效率。在对施氏鲟[35]和西伯利亚鲟[36]的研究表明, 眼睛分别在2日龄和3—4日龄便完成了快速生长阶段。在本实验中, 美洲鲥仔、稚鱼眼睛一直处于快速生长, 与上述结果不同, 这可能是不同种类眼睛发育存在着异时性; 美洲鲥早期眼睛的快速生长充分证实了视觉器官对其的重要性, 这有助于仔、稚鱼躲避敌害和提高摄食效率。
鱼类在早期发育过程中与游泳相关的器官主要有胸鳍、鳍褶和尾鳍, 其中尾鳍最为重要。初孵的仔鱼并无具备水平游泳能力, 只能依靠尾鳍的不停摆动, 做上下垂直运动, 宽大的鳍褶和一对胸鳍在运动中起到左右平衡的作用。在本实验中, 美洲鲥仔、稚鱼尾鳍在24日龄出现生长拐点, 24日龄之前相对于全长呈快速生长, 24日龄后尾鳍表现出等速生长; 胸鳍的生长一直处于快速生长。在实验过程中发现, 美洲鲥的初孵仔鱼自 3日龄便开始巡游和“蛇形”的摄食方式, 7日龄开始集群活动, 逐渐向池边集群做环游, 可见, 随着胸鳍、尾鳍快速生长和眼功能完善, 美洲鲥仔鱼游泳和摄食能力明显增强。在早期发育过程中, 仔鱼游泳器官快速生长, 增强了仔鱼摄食、运动和躲避敌害的能力, 从而能够以最有效捕食运动方式和最小的能量损耗来获得最大利益, 这是鱼类进化过程中对环境的一种适应性。另外, 美洲鲥属于快速游泳鱼类,昼夜不停歇, 运动强度大, 具有很强的游泳能力[37], 因此,美洲鲥在早期发育过程中, 迅速发育和完善游泳器官对此行为习性至关重要, 反过来此行为习性也决定了游泳器官的发育方式。
通过对美洲鲥仔、稚鱼早期发育研究表明, 与仔、稚鱼感觉、运动和摄食相关的一些器官均表现出了异速生长现象, 这些功能器官的快速发育可以有效的帮助仔、稚鱼逃避敌害, 提高摄食能力, 从而更好地适应外界恶劣的生活环境。因此, 在美洲鲥早期发育过程中, 应根据其自身器官发育特性和生长规律, 进行合理的日常管理,优化生长环境和投喂营养丰富的食物, 保证其有足够的能量和适宜的环境来完成早期器官的优先发育, 确保在短时间内获取与早期生存密切相关的生存能力, 从而提高成活率。
[1] Peter R H. The Ecological Implications of Body Size [M]. Second Edition. Cambridge University Press. 1986, 184—215
[2] Niklas K J. Plant Allometry: the Scaling of Form and Process [M]. Chicago: University of Chicago Press. 1994, 274—290
[3] Snik G M J, Boogaart J G M, Osse J W M. Larval growth patterns in Cyprinus carpio and Clarias gariepinus with attention to the finfold [J]. Journal of Fish Biology, 1997, 50(6): 1339—1352
[4] Herbing I H. Development of feeding structures in larval fish with different life histories: Winter flounder and Atlantic cod [J]. Journal of Fish Biology, 2001, 59(4): 767—782
[5] Evermann B W, Jordan D S. The Fishes of North and Middle America: A Descriptive Catalogue of the Species of Fish-like Vertebrates Found in the Waters of North America, North of the Isthmus of Panama (Volume 1) [M]. Government Printing Office. 1986, 427—428
[6] Jones P W, Martin F D, Hardy J D. Development of Fishes of the Mid-Atlantic Bight. An Atlas of Egg, Larval and Juvenile Stages. Volume 1. Acipenseridae through Ictaluridae [M]. Fish and Wildlife Service/Office of Biological Services, Center for Environmental and Estuarine Studies of University of Maryland. Contribution No.783. 1978, 98—104
[7] Tang G P, Huang A Q, Wei Q W. The Resource fluctuations and restoration of American Shad (Alosa sapidissima) [J]. Journal of Hydroecology, 2010, 3(1): 130—134 [唐国盘, 黄安群, 危起伟. 美洲鲥的资源变动及修复. 水生态学杂志, 2010, 3(1): 130—134]
[8] Du H, Wei Q W. Biological characteristics and resource status of Alosa sapidissima [J]. Freshwater Fisheries, 2004, 34(1): 62—64 [杜浩, 危起伟. 美洲鲥的生物学特征及资源状况. 淡水渔业, 2004, 34(1): 62—64]
[9] Latour R J, Hilton E J, Lynch P D, et al. Evaluating the current status of American Shad stocks in three Virginia rivers [J]. Marine and Coastal Fisheries, 2012, 4(1): 302—311.
[10] Raabe J K, Hightower J E. American Shad migratory behavior, weight loss, survival, and abundance in a North Carolina river following dam removals [J]. Transactions of the American Fisheries Society, 2014, 143(3): 673—688.
[11] Hasselman D J, Ricard D, Bentzen P. Genetic diversity and differentiation in a wide ranging anadromous fish, American shad (Alosa sapidissima), is correlated with latitude [J]. Molecular Ecology, 2013, 22(6): 1558—1573.
[12] Waldman J, Hasselman D, Bentzen P, et al. Genetic Mixed-Stock Analysis of American Shad in Two Atlantic Coast Fisheries: Delaware Bay, USA, and Inner Bay of Fundy, Canada [J]. North American Journal of Fisheries Management, 2014, 34(6): 1190—1198.
[13] Du H. Studieson key techniques in incubation, culture and transportation of American shad Alosasa pidissima [D]. Fishery college Huazhong Agricultural University, Wuhan. 2005 [杜浩. 美洲鲥 (Alosa sapidissima)人工孵化、养殖及转运关键技术的研究.硕士学位论文, 华中农业大学, 武汉. 2005]
[14] Peng J S, Bai C, Tao H Q, et al. A experiment on cultivation of Aiosa sapidissima Fries with fresh water and Sea water [J]. Journal of Guangdong Ocean University, 2012, 32(1): 97—100 [彭景书, 白成, 陶后全, 等. 美洲鲥仔稚鱼淡、海水培育试验. 广东海洋大学, 2012, 32(1): 97—100]
[15] Wu H W, Wang B, Shi W, et al. Study on culture technology of American shad (Alosa sapidissima) on a large scale I. juveniles culturing [J]. Chinese Journal of Fisheries, 2004, 17(2): 61—64 [吴文化, 王斌, 师伟, 等. 美洲鲥鱼苗种规模化养殖技术研究-稚鱼培育. 水产学杂志, 2004, 17(2): 61—64]
[16] Xu G C, Zhang C X, Zheng J L, et al. Artificial propagation and embryonic development of American Shad, Alosa sapi-dissima [J]. Marine Sciences, 2012, 36(7): 89—96 [徐钢春,张呈祥, 郑金良, 等. 美洲鲥的人工繁殖及胚胎发育的研究. 海洋科学, 2012, 36(7): 89—96]
[17] Hong X Y. Study on the morphogenesis and histology of the early American shad Alosa sapidissima [D]. Shanghai Ocean University, Shanghai. 2011 [洪孝友. 美洲鲥早期发育的形态学及组织学观察. 硕士学位论文, 上海海洋大学, 上海. 2011]
[18] Zhang C X, Xu G C, Xu P, et al. Morphological development and growth of American shad (Alosa sapidissima) at larvae, fry and juvenile stages [J]. Journal of Fishery Sciences of China, 2010, 17(16): 1227—1234 [张呈祥, 徐钢春, 徐跑,等. 美洲鲥仔、稚、幼鱼的形态发育与生长特征. 中国水产科学, 2010, 17(6): 1227—1234]
[19] Uscanga-Martinez A, Perales-Garcia N, Alvarez-González C A, et al. Changes in digestive enzyme activity during initial ontogeny of bay snook Petenia splendida [J]. Fish Physiol Biochem, 2011, 37(3): 667—680
[20] Osse J W, van den boogart J G M. Fish larvae, development, allometric growth and the aquatic environment [J]. ICES Marine Science Symposia, 1995, 201: 21—34
[21] Nogueira L B, Godinho A L, Godinho H P. Early development and allometric growth in hatchery-reared characin Brycon orbignyanus [J]. Aquaculture Research, 2014, 45(6): 1004—1011.
[22] Shingleton A W, Frankino W A, Flatt T, et al. Size and shape: the developmental regulation of static allometry in insects [J]. BioEssays, 2007, 29(6): 536—548.
[23] Khemis I B, Gisbert E, Alcaraz C, et al. Allometric growth patterns and development in larvae and juveniles of thick lipped grey mullet Chelon labrosus reared in mes ocosm conditions [J]. Aquaculture Research, 2013, 44(12): 1872—1888.
[24] Gilbert S F, Bolker J A. Ecological developmental biology:
‐preface to the symposium [J]. Evolution and Development, 2003, 5(1): 3—8.
[25] Shan X J, Dou S Z. Allometric growth of croaker Miichthys miiuy larvae and juvenile and its ecological implication [J]. Oceanologia et Limnologia Sinica, 2009, 40(6): 714—719 [单秀娟, 窦硕增.鱼(Miichthys miiuy) 仔、稚鱼发育生长方式及其生态学意义. 海洋与湖沼, 2009, 40(6): 714—719]
[26] Osse J W, van den Boogaart J G M, van Snik G M J. Priorities during early growth of fish larvae [J]. Aquaculture, 1997, 155(1): 249—258.
[27] Song H J, Liu W, Wang J L, et al. Allometric growth during yolk-sac larvae of chum salmon (Oncorhynchus keta Walabaum) and consequent ecological significance [J]. Acta Hydrobiological Sinica, 2013, 37(2): 329—335 [宋洪建, 刘伟, 王继隆, 等. 大马哈鱼卵黄囊仔鱼异速生长及其生态学意义. 水生生物学报, 2013, 37(2): 329—335]
[28] Khemis I B, Gisber E, Alcaraz C, et al. Allometric growth patterns and development in larvae and juveniles of thick-lipped grey mullet Chelon labrosus reared in mesocosm conditions [J]. Aquaculture Research, 2013, 44(12): 1872—1888.
[29] Gisber B E, Doroshov S I. Allometric growth in green sturgeon larvae [J]. Journal of Applied Ichthyology, 2006, 22 (Suppl.1): 202—207.
[30] Qu Y J, Li J E. Studies on ecological physisology of early development of grey mullet Mugil cephalus under artificial rearing condition [J]. Tropic Oceanology, 1998, 17(4): 29—39 [区又君, 李加儿. 人工培育条件下鲻鱼早期发育的生理生态研究. 热带海洋, 1998, 17(4): 29—39]
[31] Peña R, Dumas S. Development and allometric growth Patterns during early larval stages of the spotted sand bass Paralabrax maculatofasciatus (Percoidei: Serranidae) [J]. Scientia Marina, 2009, 73(s1): 183—189
[32] Wu S Q, Li J E, Qu Y J, et al. Allometric growth of hybrid grouper (Epinephelus coioides ♀×E. lanceolatus ♂) larvae and juveniles [J]. Journal of Fieshry Sciences of China, 2014, 21(3): 503—510 [吴水清, 李加儿, 区又君, 等. 斜带石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代仔、稚鱼的异速生长. 中国水产科学, 2014, 21(3): 503—510]
[33] Fuiman F A. Growth gradients in fish larvae [J]. Journal of Fish Biology, 1983, 23(1): 117—123.
[34] Clemmesen C, Malzahn A M, Peck M A, et al. Development and allometric growth patterns during early larval stages of the spotted sand bass Paralabrax maculatofasciatus (Percoidei: Serranidae) [J]. Scientia Marina, 2009, 73(Suppl. 1): 183—189.
[35] Ma J, Zhang L Z, Zhuang P, et al. Development and allometric growth patterns of larvael Acipenser schrenck [J]. Chinese Journal of Applied Ecology, 2007, 18(12): 2875—2882 [马境, 章龙珍, 庄平, 等. 施氏鲟仔鱼发育及异速生长模型. 应用生态学报, 2007, 18(12): 2875—2882]
[36] Zhuang P, Song C, Zhang L Z, et al. Allometric growth artificial bred Siberian sturgeon Acipenser baeri larvae and juveniles [J]. Chinese Journal of Ecology, 2009, 28(4): 681—687 [庄平, 宋超, 章龙珍, 等. 全人工繁殖西伯利亚鲟仔稚鱼发育的异速生长. 生态学杂志, 2009, 28(4): 681—687]
[37] Liu Q H, Jia Y J, Gao Y L, et al. Biological characteristic and intensive management of American shad [J]. Fishery Modernization, 2006, 1: 26—28 [刘青华, 贾艳菊, 高永利, 等. 美国鲥鱼的生物学特性与集约化养殖管理. 渔业现代化, 2006, 1: 26—28]
THE STUDY OF ALLOMETRIC GROWTH PATTERN OF AMERICAN SHAD LARVAE AND JUVENILE (ALOSA SAPIDISSIMA)
GAO Xiao-Qiang1,2, HONG Lei2, LIU Zhi-Feng2, GUO Zheng-Long3, WANG Yao-Hui3and LEI Ji-Lin2
(1. Ocean University of China, Qingdao 266003, China; 2. Key Laboratory for Sustainable Development of Marine Fisheries, Ministry of Agriculture, Qingdao Key Laboratory for Marine Fish Breeding and Biotechnology, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 3. Jiangsu Zhongyang Group, Nantong 226600, China)
美洲鲥; 早期发育; 仔鱼; 稚鱼; 拐点; 异速生长
Alosa sapidissima; Early ontogeny; Larva; Juvenile; Inflexion point; Allometry
S965.2
A
1000-3207(2015)03-0638-07
10.7541/2015.85
2014-07-03;
2014-09-21
国家级星火计划重大项目长江洄游珍稀鱼类产业化关键技术集成(2012GA690001)资助
高小强(1985—), 男, 河北廊坊人; 博士研究生; 主要从事鱼类繁殖生理学研究。E-mail: gao3170090@163.com
雷霁霖(1935—), 男, 中国工程院院士; 研究员, 博士生导师; 主要从事海水鱼类生态、繁殖和增养殖技术研究。E-mail: leijl@ysfri.ac.com

