镉对河南华溪蟹副性腺抗氧化酶活性及脂质、蛋白质和DNA的影响
侯宇华 李 娜 李 丹 井维鑫 王 兰
(山西大学生命科学学院, 太原030006)
镉对河南华溪蟹副性腺抗氧化酶活性及脂质、蛋白质和DNA的影响
侯宇华 李 娜 李 丹 井维鑫 王 兰
(山西大学生命科学学院, 太原030006)
随着现代工业化的发展, 重金属对水生生物的毒性影响已经引起了广泛的关注[1,2]。其中, 镉作为一种广泛存在的重金属污染物, 具有一定的生殖毒性。研究发现, 雄性生殖系统是其作用的重要靶器官, 镉对精巢[3]、精子的运动能力、成活率和受精能力[4]均能产生影响。
副性腺是溪蟹雄性生殖系统的重要组成部分[5]。关于副性腺的研究主要集中在昆虫[6,7]和哺乳动物类[8—10]。关于甲壳动物中华绒螯蟹(Eriocheir sinensis)副性腺的研究结果表明, 其副性腺蛋白可以有效地消化精荚壁, 提高精子的顶体反应率[11], 其内容物可以为精子的运动提供一定的能量和营养, 并促进精荚的破裂[12,13]。分析认为, 副性腺分泌物中含有某些蛋白, 可以使精子从精荚中游离出来, 并保持很高的活力, 从而保证了受精过程的顺利进行[14,15]。由此可见, 副性腺对于蟹类的精卵结合, 顺利地完成受精具有重要作用。
副性腺的分泌物被认为是射精过程中抗氧化酶的主要来源, 具有维护精子DNA 完整性, 使其免受外界环境氧化胁迫的重要功能[16,17]。该文在前期研究工作[18,19]基础上继续研究了镉在河南华溪蟹(Sinopotamon henanense)副性腺中的富集、对抗氧化酶(SOD、CAT和GPX)活性、脂质过氧化水平(MDA含量)、蛋白质羰基化(PCO含量)和DNA-蛋白质交联(DPC)的影响。本研究旨在进一步明确镉对雄性生殖系统的毒性及其机理, 为淡水环境的保护和水产品的安全养殖提供科学依据。
1 材料与方法
1.1 试验动物
河南华溪蟹(简称溪蟹)于2013年10月购自太原市五龙口东安水产批发市场, 在实验室水族缸(45 cm×35 cm×30 cm)暂养两周以上。
1.2 主要试剂
氯化镉(CdCl2·2.5H2O)(分析纯), 在实验前用蒸馏水配成2×104mg/L的母液备用。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)、过氧化氢酶(CAT)、丙二醛(MDA)含量和蛋白含量的测定试剂盒均购自南京建成生物工程研究所。硝酸、高氯酸为优级纯, 标准镉溶液(100 mg/L)由国家环境保护总局标准样品研究所提供。蛋白酶K、荧光染料Hoechest33258、Tris均购自Sigma公司。盐酸胍、EDTA、2, 4-二硝基苯肼(DNPH)均为国产分析纯。DNPH购自天津Kermal化学试剂开发中心。
1.3 试验设计与样品制备
将随机选取的体重为(25.0±3.0) g的健康成熟雄蟹,暴露于盛有 2 L已曝气的自来水(pH=6.8, 溶解氧 8—8.3 mg/L)的容器(40 cm×30 cm×30 cm)中。每个容器中放入8只雄蟹。
实验根据镉对溪蟹攻毒96h的LC50值, 按1/32、1/16、1/8、1/4和1/2比例分别设5个处理组和1个对照组(0 mg/L),处理组Cd2+分别为7.25、14.5、29、58和116 mg/L, 每个浓度组分别设置5个平行, 暴露3d、5d和7d, 分别从各组随机选取5只, 取副性腺称重后置于–80℃冰箱保存。染毒期间不喂食, 不换水, 每天检查华溪蟹的健康状况。
副性腺组织经浓硝酸和高氯酸硝化完全, 定容后用火焰原子吸收分光光度计(VARIAN AA240OFS)测定镉的含量(µg/g)。
按 1∶1(m∶v)的比例在各组中加入预冷的磷酸缓冲液(PBS, pH=7.4), 用电动匀浆器制备 50%的组织匀浆液, 经4℃离心10min (4000 r/min), 取上清, PCO和DPC的测量方法参照文献 [20], 按照试剂盒说明书测定3种酶活性、MDA含量和蛋白含量。
数据分析采用SPSS 16.0统计分析软件, 实验结果用平均值±标准差(Mean±SD)表示, 采用单因素方差分析(One-Way ANOVA), P<0.05 *为显著性差异, P<0.01 **为极显著性差异。
2 结果
2.1 镉在河南华溪蟹副性腺中的富集
如图1所示, 与对照组相比, 河南华溪蟹副性腺中镉的富集量随染毒浓度的增加和暴露时间的延长而呈现出逐渐升高的趋势。镉浓度116 mg/L, 染毒的3个时间, 镉在副性腺中的富集均较对照组差异极显著(P<0.01), 其中染毒 7d的富集量最高, 较对照组差异极显著(P<0.01)。
2.2 镉对河南华溪蟹副性腺SOD活性的影响
由图2可见, 随着浓度的增加和暴露时间的延长, 河南华溪蟹副性腺中SOD活性均表现出先升后降的趋势。镉浓度14.5 mg/L, 染毒5d, SOD活性最高, 较对照组差异极显著(P<0.01)。在镉暴露7d、浓度为14.5、29和58 mg/L时, SOD活性较对照组存在极显著性差异 (P<0.01)。
2.3 镉对河南华溪蟹副性腺CAT 活性的影响
由图3可见, 河南华溪蟹副性腺中CAT活性随镉浓度的升高和暴露时间的延长而呈现先升后降的趋势。镉浓度为29 mg/L 染毒5d活性最高, 较对照组差异极显著(P<0.01)。镉浓度14.5和29 mg/L染毒7d时, 较对照组存在极显著性差异(P<0.01)。

图1 镉在河南华溪蟹副性腺中的富集Fig. 1 Cd2+bioaccumulation in male accessory gland of S. henanense

图2 镉对河南华溪蟹副性腺SOD活性的影响Fig. 2 Effect of Cd2+on SOD activity in male accessory gland of S. henanense
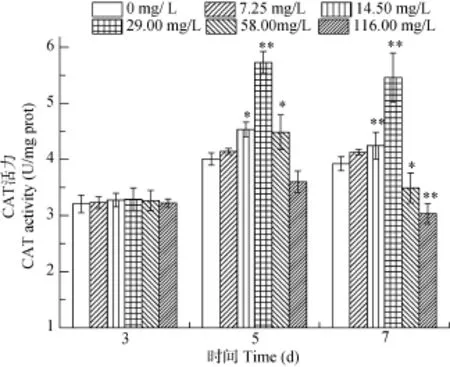
图3 镉对河南华溪蟹副性腺CAT活性的影响Fig. 3 Effect of Cd2+on CAT activity in male accessory gland of S. henanense
2.4 镉对河南华溪蟹副性腺GPX活性的影响
从图4可知, 在不同的镉处理组, 河南华溪蟹副性腺中GPX基本高于对照组。同一时间不同浓度, 随着浓度的升高, GPX活性呈现先升后降的趋势。同一浓度不同时间, 随着时间的延长, GPX活性基本呈现逐渐升高的趋势。其中暴露于14.5 mg/L浓度的镉溶液时, 该酶活性达到最高, 较对照组差异极显著(P<0.01)。镉浓度7.25、14.5 和29 mg/L, 染毒7d, 较对照组存在极显著性差异(P<0.01)。
2.5 镉对河南华溪蟹副性腺MDA含量的影响
由图 5可见, 所有镉处理组, 河南华溪蟹副性腺中MDA含量均高于对照组。表现出MDA含量随染毒浓度的增加和暴露时间的延长而呈现出逐渐升高的趋势。镉染毒浓度为58和116 mg/L染毒7d时, MDA含量较对照组存在极显著性差异(P<0.01), 其中镉浓度为116 mg/L时, MDA含量最高, 较对照组差异极显著(P<0.01)。

图4 镉对河南华溪蟹副性腺GPX活性的影响Fig. 4 Effect of Cd2+on GPXactivity in male accessory gland of S. henanense

图5 镉对河南华溪蟹副性腺MDA含量的影响Fig. 5 Effect of Cd2+on MDA content in male accessory gland of S. henanense
2.6 镉对河南华溪蟹副性腺DPC的影响
从图6可见, 在所有镉处理组中, DPC均高于对照组。表现出DPC随染毒浓度和暴露时间的延长逐渐升高。其中镉浓度为116 mg/L, 染毒5d和7d, DPC较对照组差异极显著(P<0.01)。染毒7d, DPC达到最高, 较对照组差异极显著(P<0.01)。
2.7 镉对河南华溪蟹副性腺PCO含量的影响
由图7可见, 所有的镉处理组PCO含量均高于对照组。随着镉染毒浓度的增加和染毒时间的延长, PCO含量逐渐升高。镉浓度为116 mg/L, 染毒5d和7d, PCO含量较对照组差异极显著(P<0.01)。染毒7d, PCO含量最高, 较对照组差异极显著(P<0.01)。

图6 镉对河南华溪蟹副性腺DPC的影响Fig. 6 Effect of Cd2+on DPC in male accessory gland of S. henanense

图7 镉对河南华溪蟹副性腺PCO含量的影响Fig. 7 Effect of Cd2+on PCO content in male accessory gland of S. henanense
3 讨论
3.1 镉在河南华溪蟹副性腺中的富集
从本次的研究结果中发现, 随着染毒浓度的增加和暴露时间的延长, 镉在溪蟹副性腺中的富集量逐渐增加, 尤其染毒高浓度组(116 mg/L)在染毒的3个时间, 均较对照组发生了极显著升高, 说明镉在溪蟹副性腺中的富集可以作为水环境中镉污染和毒性检测的有效指标之一。本次的研究结果显示, 镉暴露一定程度上影响了溪蟹副性腺的抗氧化能力。3种抗氧化酶(SOD、CAT和GPX)对镉胁迫的应答反应趋势基本相同, 即先上升后下降。镉诱导产生自由基
(ROS), 造成氧化损伤, 促使副性腺自身的防御系统产生应答, 抗氧化酶活性升高; 但随着镉暴露浓度的升高, 时间延长, 镉通过耗尽谷胱甘肽(GSH)或干扰抗氧化系统的必需金属元素等方式, 使抗氧化系统遭到破坏, 使其活性降低。随着镉胁迫程度的加深, 副性腺中的生物大分子: 脂质、蛋白质和DNA的氧化损伤程度不断加剧, MDA、PCO含量以及DNA-蛋白质交联率持续上升。
3.2 镉对河南华溪蟹副性腺SOD、CAT和GPX活性的影响
SOD是抗氧化系统的重要酶之一, 也是抵抗外界损伤的重要防御系统之一[21], 可清除O–2, 将其转化为H2O2[22]。CAT 和GPX都可以将H2O2转化成H2O和O2[23], 即二者通过清除 H2O2来减少其对组织的损伤, 也是抵抗镉胁迫毒性的重要酶。GPX是一种与硒相关的酶。一般来说, GPX的活性降低或者是因为硒的缺失[24], 或者是因为GSH 浓度的降低[25]。Cd2+与GPX活性部位的结合, 可以减轻Cd2+对器官的毒性作用, 也可以导致GPX活性部位的改变, 进而使其活性降低[26]。有研究表明, GPX是与雄性生殖具有重要密切关系的因素之一[27]。副性腺中GPX活性的降低, 预示着高浓度的镉暴露对溪蟹副性腺乃至雄性生殖造成了损伤。本次的实验结果显示, 在染毒的3个时间段, SOD、CAT 和GPX活性都表现出先升高后降低的趋势。这与“促进-抑制”效应机制吻合, 即低浓度镉暴露时, 可使生物体内的抗氧化酶活性升高, 出现“毒性兴奋效应”, 而高浓度时, 则通常会使生物体内的抗氧化酶活性受抑制而降低, 生物体内活性氧过量积累, 导致生物体损伤。以上三个酶活结果与Pan和Zhang[28]的研究结果相近, 该研究认为将海洋蟹—日本(Charybdis japonica)暴露于梯度镉溶液后, 鳃和肝胰腺三种抗氧化酶活性均先上升后下降。可见对于不同的镉染毒浓度和暴露时间, 海洋蟹和淡水蟹的不同组织呈现相似的应答趋势。
3.3 镉对河南华溪蟹副性腺MDA、PCO含量和DPC的影响
如果外界的氧化胁迫作用超过生物组织自身的抗氧化能力时, 那么组织的氧化损伤就会显现出来, 其中, 脂质过氧化水平即MDA含量变化被认为是细胞氧化损伤机制的主要标志之一[29], 在抵抗外源性毒物的过程中产生重要的作用[30]。它被认为与组织破坏及伴随产生的生物膜功能缺失是相关的[31]。溪蟹副性腺在暴露于Cd2+浓度116 mg/L 时, MDA含量较对照组发生极显著性升高, 表明镉极显著性的诱导了ROS的产生, 随着镉浓度的升高, 膜脂质过氧化损伤的程度也在不断加深, 也就是说抗氧化能力的丧失, 会导致 MDA含量本质性的累积, 这可以作为判断自由基产生的可靠指标。而Jiang等[32]将红螯螯虾(Cherax quadricarinatus)暴露于梯度镉溶液中, MDA的含量并没有显著的变化。分析两种结果的差别与镉的浓度、暴露时间、物种的差异性及组织的特异性有关。已有的研究表明, 副性腺可以促进精荚的裂解, 为精子的运动提供能量, 这些功能与其上皮细胞中丰富的线粒体是相关的, 本次实验中MDA含量升高, 推测在高浓度 Cd2+暴露的情况下, 线粒体膜受损, 进而使其结构乃至功能受到破坏, 从而可能会影响精子的成活率和运动能力, 而这与马丹旦等[33]关于急性镉胁迫对溪蟹精子质量的影响结果是一致的。
DNA也会被ROS攻击, 从而严重影响其结构和功能[34]。蛋白质可以直接通过活性氧机制直接和DNA交联, 也可以通过与金属离子结合后间接与DNA交联。DNA-蛋白质交联会扰乱DNA的正常代谢过程[35]。另外, 蛋白质羰基化也是镉诱导氧化损伤的指示物之一[36]。本次的研究结果显示, 染毒的最高浓度组(116 mg/L)在染毒的5d和7d, DNA-蛋白质交联率(DPC)和蛋白质羰基化(PCO)含量均较对照组发生极显著升高。Ma等[19]发现, 将溪蟹暴露于镉溶液(116 mg/L)7d后, 其精子中PCO含量、DPC显著高于对照组, 表明高浓度的镉胁迫对副性腺的损伤程度与精子的基本相同。结合前期研究分析认为, 镉对副性腺中蛋白质的损伤, 会干扰其功能(如消化精荚壁)的正常实行, 进而影响副性腺的功能, 从而对溪蟹的雄性生殖造成影响。以上结果提示, 镉诱导产生OH–等自由基, 攻击副性腺中的脂质、蛋白质氨基酸和细胞内DNA, 进而影响副性腺的功能, 乃至遗传等生命活动的正常进行。
4 小结
(1) 随着镉浓度的增加和染毒时间的延长, 河南华溪蟹副性腺中镉的富集量逐渐升高, 提示镉可能引起了副性腺抗氧化系统和蛋白质等生物大分子的损伤。(2)镉胁迫不但能诱导副性腺氧化应激水平的升高, 而且进一步导致了副性腺中脂质、蛋白质和DNA生物大分子的损伤。(3)抗氧化酶活性、脂质过氧化水平、蛋白质羰基化含量和DNA-蛋白质交联率的变化程度能够灵敏反映镉对水生动物生殖系统的胁迫程度和损伤程度, 可以作为水环境重金属生殖毒性效应机理研究的评估指标。
[1] Tang J X, Tang Y Y, Sun H X, et al. Effects of Cu2+and Pb2+(single factor and joint toxicity) on DNA damage in Misgurnus anguillicaudatus oocytes [J]. Acta Hydrobiologica Sinica, 2013, 37(3): 501—506 [唐建勋, 唐奕扬, 孙红祥, 等. 重金属Cu2+、Pb2+单因子及联合毒性对泥鳅卵细胞DNA的损伤效应. 水生生物学报, 2013, 37(3): 501—506]
[2] Jiang H C, Liu A Y, Song X K, et al. The toxic effects of heavy metals on the embryonic development of Apostichopus japonicus [J]. Acta Hydrobiologica Sinica, 2014, 38(2): 393—400 [姜会超, 刘爱英, 宋秀凯, 等. 重金属胁迫对刺参胚胎发育的影响. 水生生物学报, 2014, 38(2): 393—400]
[3] Jia X Y, Shi C L, Zhang H J. DNA damage and oxidative damage in testes of Rana nigromaculata exposed to cadmium [J]. Acta Scientiae Circumstantiae, 2011, 31(7): 1537—1541 [贾秀英, 施蔡雷, 张杭君. 镉暴露对黑斑蛙精巢氧化损伤与DNA损伤. 环境科学学报, 2011, 31(7): 1537—1541]
[4] Dietrich G J, Dietrich M, Kowalski R K, et al. Exposure of rainbow trout milt to mercury and cadmium alters sperm motility parameters and reproductive success [J]. Aquatic Toxicology, 2010, 97: 277—284
[5] Wang L, Du N S, Lai W. Ultrastructure of vas deferens and formation of spermatophore of freshwater crab, Sinopotamon yangtsekiense (Crustacea, Decapoda) [J]. Oceanologia et Limnologia Sinica, 1996, 27(4): 374—379 [王兰, 堵南山,赖伟. 长江华溪蟹输精管的超微结构与精荚形成的研究.海洋与湖沼, 1996, 27(4): 374—379]
[6] Lung O, Kuo L, Wolfner M F. Drosophila males transfer antibacterial proteins from their accessory gland and ejaculatory duct to their mates [J]. Journal of Insect Physiology, 2001, 47: 617—622
[7] Baldini F, Gabrieli P, Rogers D W, et al. Function and composition of male accessory gland secretions in Anopheles gambiae: a comparison with other insect vectors of infectious diseases [J]. Pathog Glob Health, 2012, 106(2): 82—93
[8] Chen H, Cheung M P L, Chow P H, et al. Protection of sperm DNA against oxidative stress in vivo by accessory sex gland secretions in male hamsters [J]. Reproduction, 2002, 124: 491—499
[9] Chen H, Liao S B, Cheung M P L, et al. Effects of sperm DNA damage on the levels of RAD51 and p53 proteins in zygotes and 2-cell embryos sired by golden hamsters without the major accessory sex glands [J]. Free Radical Biology and Medicine, 2012, 53(4): 885—892
[10] Henault M A, Killian G J, Kavanaugh J F. Effect of accessory sex gland fluid from bulls of differing fertilities on the ability of cauda epididymal sperm to penetrate zone-free bovine oocytes [J]. Biology of Reproduction, 1995, 52(2): 390—397
[11] Hou X L, Mao Q, He L, et al. Accessory sex gland proteins affect spermatophore digestion rate and spermatozoa acrosin activity in Eriocheir sinensis [J]. Journal of Crustacean Biology, 2010, 30(3): 435—440
[12] Wang J, Fang D A, Wang Y, et al. Cathepsin A protein from the accessory sex gland of the Chinese mitten crab (Eriocheir sinensis) plays a key role in spermatophore digestion [J]. Journal of Insect Physiology, 2013, 59(9): 953—960
[13] Sun J X. Study on the structure and function of male accessory gland of Eriocheir sinensis [D]. The dissertation of master degree. East China Normal University, Shanghai. 2007 [孙菊香. 中华绒螯蟹(Eriocheir sinensis)副性腺的结构和功能研究. 硕士学位论文, 华东师范大学, 上海. 2007]
[14] Mao Q. Studies on the function of the male accessory gland protein in Eriocheir sinensis [D].The dissertation of master degree. East China Normal University, Shanghai. 2009 [毛倩.中华绒螯蟹副性腺蛋白功能的初步研究. 硕士学位论文,华东师范大学, 上海. 2009]
[15] Hou X L. Studies on the differentially expressed genes in accessory sex gland and function of Eriocheir sinensis [D]. The dissertation of master degree. East China Normal University, Shanghai. 2009 [侯雪丽. 中华绒螯蟹副性腺差减cDNA文库的构建及内容物功能的研究. 硕士学位论文,华东师范大学, 上海. 2009]
[16] O W, Chen H, Chow P H. Male genital tract antioxidant enzymes—Their ability to preserve sperm DNA integrity [J]. Molecular and Cellular Endocrinology, 2006, 250: 80—83
[17] Jelezarsky L, Vaisberg C, Chaushev T, et al. Localization and characterization of glutathione peroxidase (GPx) in boar accessory sex glands, seminal plasma, and spermatozoa and activity of GPx in boar semen [J]. Theriogenology, 2008, 69: 139—145
[18] Wang L, Xu T, Lei W W, et al. Cadmium-Induced oxidative stress and apoptotic changes in the testis of freshwater crab, Sinopotamon henanense [J]. PLoS ONE, 2011, 6 (11)e27853
[19] Ma D D, Hou Y H, Du L J, et al. Oxidative damages and ultrastructural changes in the sperm of freshwater crab Sinopotamon henanense exposed to cadmium [J]. Ecotoxicology and Environmental Safety, 2013, 98: 244—249
[20] Li R J, Zhou Y Y, Ji J F, et al. Oxidative damages by cadmium and the protective effects of low-molecular-weight chitosan in the freshwater crab (Sinopotamon yangtsekiense Bott 1967) [J]. Aquaculture Research, 2011,42: 506—515
[21] Bian P J, Qiu C G, Xu S L, et al. Effects of salinity on growth, activity of non-specific immune and antioxidant enzymes in obscure puffer takifugu obscure [J]. Acta Hydrobiologica Sinica, 2014, 38(1): 108—114 [边平江, 邱成功, 徐善良,等. 鲀盐度对暗纹东方 生长、非特异性免疫和抗氧化酶活力的影响. 水生生物学报, 2014, 38(1): 108—114]
[22] Lawniczak M, Romestaing C, Roussel D, et al. Preventive antioxidant responses to extreme oxygen level fuctuation in a subterranean crustacean [J]. Comparative Biochemistry and Physiology (Part A), 2013, 165: 299—303
[23] Yao C L, Wang Z Y, Xiang J H. Crustacean haemocytes and their function in immune responses [J]. Zoological Research, 2006, 27: 549–557
[24] Zumkley H. Clinical aspects of selenium metabolism [J]. Biological Trace Element Research, 1988, 15:139–146
[25] Lavarías S, Heras H, Pedrini N, et al. Antioxidant response and oxidative stress levels in Macrobrachium borellii (Crustacea: Palaemonidae) exposed to the water-soluble fraction of petroleum [J]. Comparative Biochemistry and Physiology (Part C), 2011, 153: 415—421
[26] Zhu S L, Chen L. The research advance of cadmium toxicity and its mechanism [J]. Biology Teaching, 2006, 31(8): 2—5 [朱善良, 陈龙. 镉毒性损伤及其机制的研究进展. 生物学教学, 2006, 31(8): 2—5]
[27] Wu L T, Chu K H. Characterization of an ovary-specifc glutathione peroxidase from the shrimp Metapenaeus ensis and its role in crustacean reproduction [J]. Comparative Biochemistry and Physiology (Part B), 2010, 155: 26—33
[28] Pan L Q, Zhang H X. Metallothionein, antioxidant enzymes and DNA strand breaks as biomarkers of Cd exposure in a marine crab, Charybdis japonica [J]. Comparative Biochemistry and Physiology (Part C), 2006, 144: 67—75
[29] Del Rio D, Stewart A J, Pellegrini N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress [J]. Nutrition Metabolism Cardiovas, 2005, 15: 316—328
[30] Geihs M A, Vargas M A, Maciel F E, et al. Effect of melatonin in the antioxidant defense system in the locomotor muscles of the estuarine crab Neohelice granulata (Decapoda, Brachyura) [J]. General and Comparative Endocrinology, 2010, 166: 72—82
[31] Parrilla-Taylor D P, Zenteno-Savín T, Magallón-Barajas F J. Antioxidant enzyme activity in pacific whiteleg shrimp (Litopenaeus vannamei) in response to infection with white spot syndrome virus [J]. Aquaculture, 2013, 380—383: 41—46
[32] Jiang Q C, Dilixiati A, Zhang C, et al. Metabolic and antioxidant responses in juveniles of Cherax quadricarinatus under acute cadmium stress [J]. Journal of Crustacean Biology, 2013, 33(4): 552—556
[33] Ma D D, Lei W W, Wu H, et al. Effects of acute cadmium on sperm quality of Sinopotamon henanense [J]. Acta Scientiae Circumstantiae, 2013, 33(7): 2044—2049 [马丹旦, 雷雯雯,吴昊, 等. 急性镉染毒对河南华溪蟹精子质量的影响. 环境科学学报, 2013, 33(7): 2044—2049]
[34] Jena N R. DNA damage by reactive species: Mechanisms, mutation and repair [J]. Journal of Biosciences, 2012, 37(3): 503—517
[35] Barker S, Weinfeld M, Murray D, et al. DNA-protein crosslinks: their induction, repair, and biological consequences [J]. Mutation Research, 2005, 589: 111–135
[36] Dorts J, Silvestre F, Tu H T, et al. Oxidative stress, protein carbonylation and heat shock proteins in the black tiger shrimp, Penaeus monodon, following exposure to endosulfan and deltamethrin [J]. Environmental Toxicology and Pharmacology, 2009, 28: 302—310
BIOACCUMULATION OF CADMIUM AND ITS EFFECTS ON ANTIOXIDANT ENZYME ACTIVITIES, LIPID, PROTEIN AND DNA IN MALE ACCESSORY GLAND OF THE FRESHWATER CRAB SINOPOTAMON HENANENSE
HOU Yu-Hua, LI Na, LI Dan, JING Wei-Xin and WANG Lan
(School of Life Science, Shanxi University, Taiyuan 030006, China)
河南华溪蟹; 副性腺; 镉; 抗氧化酶活性; 脂质过氧化水平; DNA-蛋白质交联率; 蛋白质羰基化含量
Sinopotamon henanense; Male accessory gland; Cadmium; Antioxidant enzyme activity; Lipid peroxidation; DNA-protein crosslink; Protein carbonyl derivates
X171.5
A
1000-3207(2015)03-0621-06
10.7541/2015.82
2014-08-04;
2014-12-02
高等学校博导类基金(No. 20111401110010); 山西省特色学科重点项目(No.2011-SXDX-SWX-003)资助
侯宇华(1989—), 女, 山西省孝义市人; 硕士; 主要从事动物生殖毒理学研究。E-mail: hyh0163@163.com
王兰, 主要从事环境生物学与基因调控的研究。E-mail: lanwang@sxu.edu.cn

