反义miR-224对乳腺癌细胞增殖和凋亡的影响
骆 萍 石冬梅 邱 杨 钟晓鸣
MicroRNAs(miRNA)是1种大小约为21~25个碱基的非编码单链小分子RNA,是一类新的基因调节子,其在控制细胞的生长、发育、分化、新生血管形成和凋亡等生物学过程中发挥着非常重要的作用[1]。研究已经证实miR-224在多种恶性肿瘤中表达失调[2-8],然而miR-224在乳腺癌中的表达及功能研究尚未见报道。本实验采用TagMan MGB探针法检测miR-224在乳腺癌组织中的表达情况,同时利用反义寡核酸技术(antisense oligonucleotide,ASO)抑制 miR-224在乳腺癌细胞中的表达,分析miR-224对乳腺癌细胞增殖和凋亡的影响。
1 材料与方法
1.1 临床资料
收集2013年10月至2014年06月江西省肿瘤医院和南昌市第三医院乳腺外科乳腺癌及对应癌旁组织手术标本120份。所有标本均经病理学检查确诊,均为女性,年龄28~62岁,患者术前均未接受放化疗。
1.2 主要试剂和仪器
乳腺癌MCF-7细胞由本实验室保存;TaqMan miRNA分析试剂盒(美国ABI公司);DMEM高糖培养基(美国Gibco公司)、胎牛血清(美国Hyclone公司)、脂质体Lipfectamine 2000(美国Invitrogen公司);反义miR-224寡核苷酸(miR-224 ASO)(大连宝生物公司);Annexin V-FITC凋亡检测试剂盒(南京凯基公司);总蛋白提取试剂盒(碧云天);鼠抗人Bcl-2单克隆抗体(美国santa cruz公司);实时荧光定量PCR分析仪(美国ABI公司),流式细胞仪(美国BD公司)。
1.3 方法
1.3.1 实时荧光定量PCR检测miR-224的表达 采用Trizol试剂提取肿瘤组织及对照组织中总RNA,采用紫外分光光度计测定浓度,-80℃保存,运用miR-224检测试剂盒检测miR-224的表达。首先取2 μg总RNA为反应模板与3 μl逆转录酶相互混合,反应体系为20 μl,反应条件为:16 ℃ 30 min,42 ℃ 30 min,85℃ 5 min。反应结束后,收集cDNA,将其稀释150倍,然后取1 μl稀释的cDNA与 2 μl TaqMan引物相混合,20 μl反应体系:95 ℃ 10 min,随后95 ℃ 15 s,59℃ 60 s,40个循环。相对miRNA表达采用ct值精确计算,将U6 snRNA作为内参。
1.3.2 反义miR-224单核苷酸序列设计 MiRBase提供的miRNA基因序列获取人miR-224的序列,并设计其反义寡核苷酸序列,同时运用核酸序列数据库检索程序以排除其它的同源序列。另外,同时设计一条随机对照序列,如下所示:miR-224 sense:5'AGUCACUAGUGGUUCCGUUUA 3',反义 miR-224 antisense:5 'TAAACGGAACCACTAGTGACT 3',随机序列 sense:5'UUCUCCGAACGUGUCACGUTT3 ',antisense:5 'ACGUGACACGUUCGGAGAATT 3',送 Invitrogen 公司合成,PAGE纯化,全硫代修饰。
1.3.3 细胞培养和反义寡核苷酸转染 将MCF-7乳腺癌细胞接种于DMEM培养基(含10%胎牛血清),5%CO2、37℃条件下培养。严格遵照Lipfectamine TM 2000转染试剂盒操作程序进行转染,反义miR-224寡核苷酸终浓度分别为:50 nmol/L、100 nmol/L,150 nmol/L,200 nmol/L,本实验组前期初步筛选出最佳终干扰浓度为100 nmol/L。转染后培养时间分别为24 h、48 h、72 h,初步筛出最佳作用时间为48 h。将荧光对照的反义寡核苷酸转染后放置于倒置荧光显微镜下进行观察,上述操作重复3次。转染效率(88.5%±6.4)%。
1.3.4 转染miR-224 ASO后对miR-224表达的影响转染 miR-224 ASO与对照 ASO 48 h后,提取总RNA,测定浓度,逆转录为 cDNA(反应条件同1.2.1),测定cDNA浓度。运用miR-224检测试剂盒检测miR-224的表达(具体条件同1.2.1)。上述操作重复3次。
1.3.5 克隆形成实验检测MCF-7细胞的增殖 乳腺癌MCF-7细胞经转染后,取对数生长期的细胞,用含3%胰蛋白酶消化细胞。接种于6孔培养板中,大约500~600个细胞/孔,置37 ℃、5%CO2,饱和湿度的条件下,培养2~3周。观察细胞生长情况,当培养皿中出现肉眼可见的克隆细胞团时,终止培养。移去上清液,运用PBS漂洗2次。加甲醇固定20 min,去除固定液,加适量Giemsa应用染色液染30 min,用ddH2O清洗染色液,经干燥后在显微镜下计数大于50个细胞的克隆数,克隆形成率=克隆数/接种细胞数×100%。上述操作重复3次。
1.3.6 MTT检测MCF-7细胞增殖情况 收集MCF-7细胞,将各组细胞悬液在离心管内反复充分打匀,接种于96孔培养板(6×103/孔),24 h后换液。实验分组同1.2.4,每组设有6个复孔。转染后1 d~4 d每孔加入 MTT 试剂(浓度为 5 mg/mL)20 μL,在 5%CO2、37℃条件下继续孵育4 h。用移液器吸取各孔上清,加入DMSO 150 μL/孔,在室温条件下摇10 min(置水平摇床)以充分完全溶解MTT结晶。测定各孔吸光值(波长490 nm)。每组重复3次。按下列公式计算细胞生长抑制率(%):细胞生长抑制率 =(实验组平均A490-对照组平均A490)/对照组平均A490×100%。上述操作重复3次。
1.3.7 活体内检测miR-224 ASO对MCF-7细胞增殖的影响 将20只(4~5周龄)裸鼠(上海斯莱克公司)饲养于SPF无菌环境下。MCF-7细胞在浓度为300 μg/ml的G418抗生素条件下,筛选出稳定克隆对照ASO或miR-224 ASO的U2-OS细胞株,取对数期生长的细胞(约2~ ×106个)制成150 μl细胞悬液,运用微量注射器接种于裸鼠左侧大腿背部皮下。成瘤后定期测量肿瘤的大小,并运用公式(V=D×d2×π/6)(D,d分别代表肿瘤的最大直径和最小直径)计算肿瘤的体积[6],绘制肿瘤生长曲线。饲养6周后处死裸鼠,取瘤称重。经福尔马林固定、石蜡包埋、HE染色后,在光镜下观察肿瘤组织的病理学特征。
1.3.8 流式细胞术分析细胞早期凋亡 实验分组同1.3.4,将细胞接种于6孔板中,转染反义miR-224寡核苷酸。经48 h后收集细胞并制备为单细胞悬液,采用PBS漂洗2次,离心、弃上清。最后运用Annexin V-FITC早期凋亡试剂盒和流式细胞仪检测各组细胞的早期凋亡情况。上述操作重复3次。
1.3.9 检测各组细胞Bcl-2 mRNA的表达水平 各组培养细胞加入Trizol裂解液,提取总RNA,逆转录为cDNA,应用SYBR Green Real Time PCR Master Mix通过荧光定量PCR方法检测Bcl-2的mRNA表达。Bcl-2的引物序列为上游:5'-AACTGGGG GAGGATTGTGGC-3';下游:5 '-GATCCAGGTGTGCAGGTGCC-3 '。反 应条件:95℃变性45 s,58℃退火45 s,72℃延伸30 s,40个循环。以GAPDH作为内参。在ABI7500反应平台上进行PCR反应。
1.3.10 检测各组细胞Bcl-2蛋白的表达水平 收集转染miR-224 ASO的MCF-7细胞,运用总蛋白提取试剂盒提取总蛋白,经10%SDS-PAGE电泳后转膜,将膜放在含5%脱脂奶粉的TBST缓冲液中37℃封闭2 h,加一抗稀释液1∶500稀释鼠抗人Bcl-2单克隆抗体在4℃孵育过夜,1×TBST缓冲液洗膜10 min×3次,加辣根过氧化物酶标记的山羊抗鼠IgG(1∶1 000稀释),置于37℃孵育2 h,1×BST缓冲液洗膜10 min×3次,应用ECL化学发光法检测目的蛋白条带,以βactin作为内参。
1.4 统计学处理
2 结果
2.1 乳腺癌组织中miR-224的表达情况
应用实时荧光定量PCR检测发现120例乳腺癌患者的癌组织及癌旁组织,结果发现:69.17%(83/120)的乳腺癌组织miR-224表达水平明显高于相对应的正常癌旁组织的,有统计学意义(P=0.00)(图1)。
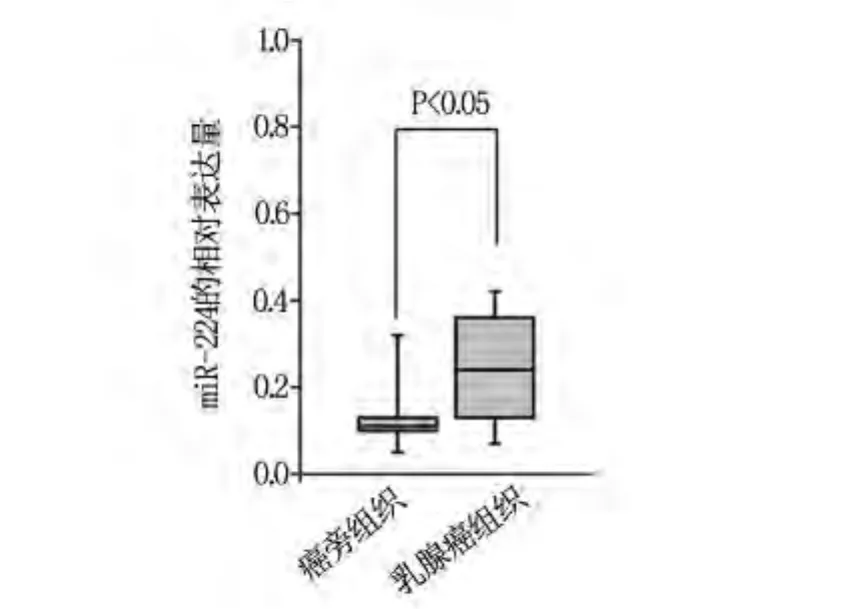
图1 癌组织及癌旁组织中miR-224的表达
2.2 降低miR-224的表达对MCF-7细胞存活率的影响
转染miR-224 ASO后,通过荧光定量PCR方法检测发现miR-224的相对表达量(0.09±0.01)较对照组(0.50 ±0.07)明显降低(P=0.00)(图 2A)。同时MTT检查结果发现:转染miR-224 ASO后组细胞生长较对照组明显降低,其24 h、48 h和96 h的细胞生长抑制率分别为:53.57%、59.13%和 70.08%,两者差异均有统计学意义(P<0.05)(图2B)。
2.3 降低miR-224的表达对体外MCF-7细胞增殖的影响
观察克隆形成实验结果发现:miR-224ASO经转染后,MCF-7细胞克隆形成率[(5.33±0.74)%]较对照组[(33.33 ±8.38)%]有明显降低(P=0.00)。
2.4 降低miR-224的表达对MCF-7细胞凋亡的影响
乳腺癌细胞MCF-7转染miR-224 ASO后,流式细胞仪检测细胞凋亡的结果显示:MCF-7细胞在转染miR-224 ASO 后,凋亡指数(15.68±1.46)增加明显,而对照组ASO转染后凋亡指数(3.36±0.88)无明显变化(P=0.02)(图3)。
2.5 降低miR-224的表达对Bcl-2 mRNA和Bcl-2蛋白表达的影响
miR-224 ASO转染MCF-7细胞后,应用荧光定量PCR和western blot检查各组细胞中Bcl-2 mRNA和Bcl-2蛋白表达水平,结果发现miR-224 ASO组Bcl-2 mRNA和Bcl-2蛋白的相对表达水平[(1.05 ±0.04)和(0.21±0.03)]明显低于对照 ASO 转染组[(4.87±0.96)和(0.88 ±0.09)],两者差异有统计学意义(P=0.00,P=0.00(图4)。
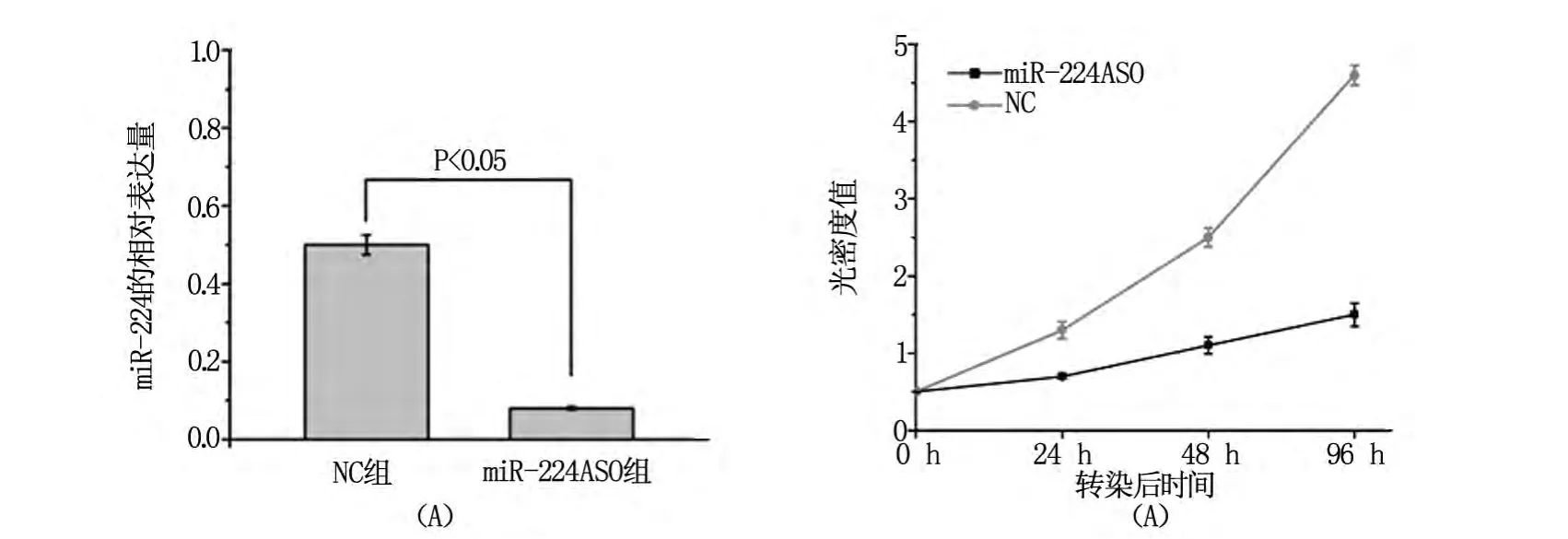
图2 转染miR-224 ASO后MCF-7细胞miR-224的表达和生长情况变化

图3 流式细胞仪检测miR-224 ASO转染后的MCF-7细胞凋亡情况

图4 Bcl-2 mRNA和蛋白在转染miR-224 ASO的MCF-7细胞中的表达情况
2.6 降低miR-224的表达对活体肿瘤增殖的影响
本实验所有的裸鼠肿瘤成瘤率为100%,实验结果发现miR-224ASO稳定转染组的肿瘤生长速度较对照组明显减慢,差别有统计学意义(P=0.01)(图5)。
3 讨论
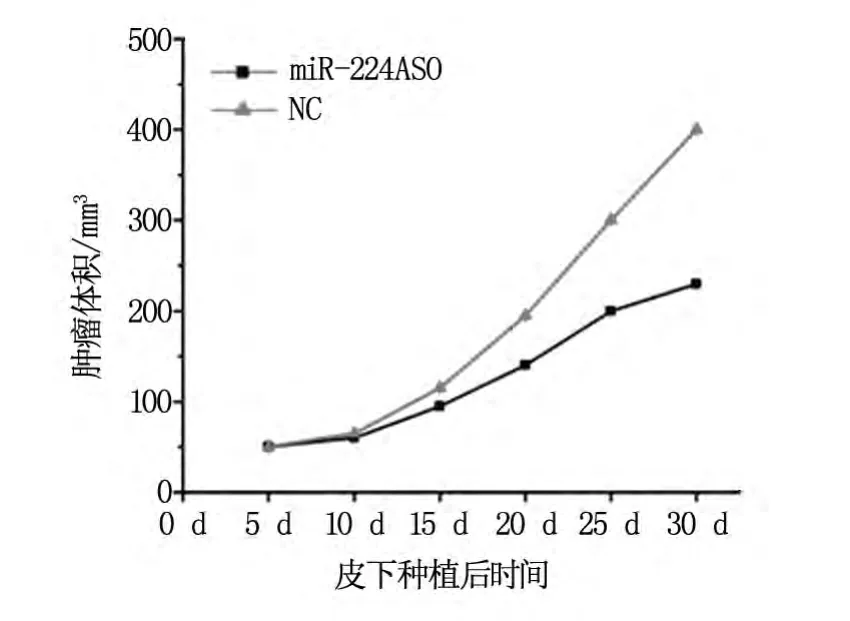
图5 活体内miR-224ASO转染的MCF-7细胞所形成肿瘤的体积变化
乳腺癌是危害妇女生命健康的主要疾病,近年来在我国特别是一些大城市和沿海经济发达地区,其发病率呈迅速上升趋势,近年来乳腺癌的防治水平取得了较大的进步,其主要归功于早期发现和诊断的成功及综合治疗的发展。miRNAs是一类新的基因调控因子,在控制细胞的增殖、凋亡等过程中发挥着十分重要的作用。miRNA通过与靶mRNA的3'非编码区近乎完全互补结合在转录后水平使其降解,或者与之不完全互补结合在翻译水平抑制蛋白合成,从而在基因表达中发挥重要的调节作用。近年随着miRNAs研究的不断深入,发现miRNAs与恶性肿瘤关系密切,一些miRNA可能通过调控细胞的增殖和凋亡直接参与肿瘤形成,另一些可能通过靶定癌基因或抑癌基因而对肿瘤发生进行调控。因此,miRNAs可能成为诊断肿瘤的新的分子标志和判断肿瘤治疗及预后的分子靶点,而且miRNAs在转录后水平调节靶基因的表达,这更有助于恶性肿瘤的早期发现、早期诊断和早期治疗,也为乳腺癌的早期诊治提供了新的希望。
最近研究发现,miR-224在多种恶性肿瘤中表达异常,且与肿瘤的发生、发展密切相关。Shen等[9]检测了miR-224在宫颈癌组织中的表达显着高于癌旁正常组织,且与分期、组织学分级、HPV感染、淋巴结转移等临床病理特征显著相关,因此认为,miR-224是一个独立的宫颈癌的预后指标。另有研究报道,miR-224在结肠癌、非小细胞肺癌等恶性肿瘤中也表达失调,且与肿瘤的临床分期、病理分级密切相关,提示miR-224与肿瘤细胞的增殖和转移密切相关[10-11]。关于miR-224表达异常的研究在肝癌中报道较多。Murakami等[12]首次报道 miR-224在肝癌呈过表达;向邦德等[13]发现miR 224的表达与癌组织表达量呈正相关,故血浆miR 224有可能作为1种新的血清学指标用于肝癌诊断。另有报道,在肝癌细胞中miR-224是其中一个最普遍上调miRNA,且miR-224在肝癌细胞中过表达增加肝癌细胞增殖和凋亡、细胞迁移和侵袭[14-15]。MA 等[16]研究结果表明,miR-224 作为致癌基因在肝癌细胞中可能通过PPP2R1B激活AKT信号通路,从而促进肝癌细胞的增殖,迁移和侵袭,因此可能在肝癌发生和发展过程中的扮演着致癌作用。但miR-224在乳腺癌中的表达及其作用机制目前还不清楚。本实验首先利用实时荧光定量PCR检测临床乳腺癌标本和对应的正常癌旁组织,结果发现miR-224在肿瘤组织中相对于对应的正常癌旁组织呈明显高表达,两者差异具有统计学意义。为进一步了解miR-224对乳腺癌细胞功能的影响,本实验首先通过转染miR-224 ASO降低乳腺癌细胞MCF-7中miR-224的表达,同时利用MTT方法检测降低miR-224的表达后MCF-7细胞生长情况,结果发现转染miR-224 ASO的MCF-7细胞存活率较转染前明显降低。同时运用克隆形成实验还发现转染miR-224 ASO后,MCF-7细胞克隆形成率比对照ASO组明显减少。同时本实验在活体内实验进一步证实稳定转染miR-224 ASO组MCF-7细胞皮下形成肿瘤的体积减小较对照ASO组显著减小,两者差异别有统计学意义。以上实验结果表明miR-224在乳腺癌细胞的增殖生长中起着重要作用。
此外,本实验运用流式细胞技术检测细胞凋亡情况,结果发现转染miR-224 ASO组细胞凋亡较对照组明显增加。众所周知,Bcl-2是细胞凋亡调控基因,为了进一步找出miR-224表达对乳腺癌细胞凋亡情况的调控机制,本实验通过检测miR-224 ASO组和对照组Bcl-2的mRNA和蛋白变化,结果发现转染miR-224 ASO组Bcl-2 mRNA和蛋白水平较对照组明显降低。这表明miR-224可能通过对Bcl-2表达的调节来调控乳腺癌细胞的凋亡,进而达到对乳腺癌细胞增殖能力的调控。
综上所述,miR-224不但在乳腺癌发生发展中发挥作用,而且在调控乳腺癌细胞的增殖和凋亡方面也起着重要作用,很可能成为为乳腺癌诊治的一个新的癌前标记物和临床基因治疗的新靶点。但其具体的作用机制有待于进一步深入研究。
[1]Brennecke J,Hipfner DR,Stark A,et al.Bantam encodes a developmentally regulated microRNA that controls cell proliferation and regulates the proapoptotic gene hid in drosophila〔J〕.Cell,2003,113(1):25-36.
[2]Li Q,Wang G,Shan JL,et al.MicroRNA-224 is unregulated in HepG2 cells and involved in cellular migration and invasion〔J〕.J Gastroenterol Hepatol,2010,25(1):164-171.
[3]Boguslawska J,Wojcicka A,Piekielko-Witkowska A,et al.MiR-224 targets the 3 'UTR of type 1 5 '-iodothyronine deiodinase possibly contributing to tissue hypothyroidism in renal cancer〔J〕.PLoS One,2011,6(9):e24541.
[4]White NM,Chow TF,Mejia-Guerrero S,et al.Three dysregulated miRNAs control kallikrein 10 expression and cell proliferation in ovarian cancer〔J〕.Br J Cancer,2010,102(8):1244-1253.
[5]Prueitt RL,Yi M,Hudson RS,et al.Expression of microRNAs and protein-coding genes associated with perineural invasion in prostate cancer〔J〕.Prostate,2008,68(11):1152-1164.
[6]Wotschofsky Z,Busch J,Jung M,et al.Diagnostic and prognostic potential of differentially expressed miRNAs between metastatic and non-metastatic renal cell carcinoma at the time of nephrectomy〔J〕.Clin Chim Acta,2013,416(1):5-10.
[7]Wang Y,Lee AT,Ma JZ,et al.Profiling microRNA expression in hepatocellular carcinoma reveals microRNA-224 upregulation and apoptosis inhibitor-5 as a microRNA-224-specific target〔J〕.J Biol Chem,2008,283(19):13205-13215.
[8]Mees ST,Mardin WA,Sielker S,et al.Involvement of CD40 targeting miR-224 and miR-486 on the progression of pancreatic ductal adenocarcinomas〔J〕.Ann Surg Oncol,2009,16(8):2339-2350.
[9]Shen SN,Wang LF,Jia YF,et al.Up-regulation of microRNA-224 is associated with aggressive progression and poor prognosis in human cervical cancer〔J〕.Diagn Pathol,2013,8(4):69-75.
[10]叶晶珠,詹丽英,李志晋,等.miR-224在结肠癌中的表达及其意义〔J〕.南昌大学学报(医学版),2012,52(10):4-7.
[11]张洪岩,鲁继斌,杨 伟,等.miR-224、miR-135a在非小细胞肺癌中的表达及与临床病理的关系〔J〕.现代肿瘤医学,2012,20(10):2057-2059.
[12]Murakami Y,Yasuda T,Saigo K,et al.Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues〔J〕.Oncogene,2006,25(17):2537-2545.
[13]向邦德,高军平,倪航航,等.血浆MicroRNA-224在肝细胞癌患者的表达及其临床意义〔J〕.中华肝胆外科杂志,2012,18(10):794-795.
[14]Zhang Y,Takahashi S,Tasaka A,et al.Involvement of microRNA-224 in cell proliferation,migration,invasion and anti-apoptosis in hepatocellular carcinoma〔J〕.J Gastroenterol Hepatol,2013,28(3):565-575.
[15]Wang Y,Toh HC,Chow P,et al.MicroRNA-224 is up-regulated in hepatocellular carcinoma through epigenetic mechanisms〔J〕.FASEB J,2012,26(7):3032-3041.
[16]Dong LM,Xuan CT,Feng G,et al.miR-224 functions as an onco-miRNA in hepatocellular carcinoma cells by activating AKT signaling〔J〕.Oncol Lett,2012,4(3):483-488.

