MMP-2、MMP-9在老年结直肠癌中的表达及与其临床病理特征的关系
陈 翔 吴曙辉 陆宝华 袁 杰 耿春华 曾小兵
结直肠癌是临床上常见的恶性肿瘤之一,近几年来,发病率明显上升,临床上判断预后多通过分析肿瘤大小、淋巴结转移情况、分期、组织分级等。基质金属蛋白酶中的基质金属蛋白酶2(MMP-2)、基质金属蛋白酶9(MMP-9)主要降解VI型胶原,参与肿瘤血管形成、肿瘤细胞的侵袭和转移[1]。本文通过免疫组织化学法检测老年结直肠癌患者中MMP-2、MMP-9的表达,探讨两者与结直肠癌患者临床病理特征的关系。
1 材料与方法
1.1 一般资料
选取于2012年3月至2014年9月在我院普外科住院行结直肠癌根治术患者86例作为实验组,均经过病理组织学切片检查明确诊断,其中男性49例,女性37例,年龄63~84岁,平均年龄(65.2±5.3)岁。组织学类型:腺癌63例,其他类型23例。病理学分级:高分化32例,中分化33例,低分化21例。肿瘤直径<5 cm者37例,5~10 cm者34例,>10 cm者15例;局部有淋巴结转移者49例,无转移者37例;TNM分期:Ⅰ期23例,Ⅱ期31例,Ⅲ期26例,Ⅳ期6例。取该组病例距肿瘤边缘5 cm以上相应癌旁正常组织作为对照组。所有患者术前均未接受放疗、化疗或生物治疗。
1.2 试剂及仪器
兔抗人MMP2、MMP-9多克隆抗体、SP通用型试剂盒、DAB试剂盒、多聚赖氨酸、柠檬酸抗原修复液、PBS、过氧化氢、二甲苯,无水乙醇,石蜡,苏木精,中性树胶(北京中杉金桥生物技术有限公司)。
超净工作台(Formal205型,美国);倒置显微镜(Olympus,日本);水浴箱(江苏金坑市医疗仪器厂);组织包埋机(SAKURA,日本);脱水机(TIYODA,日本);超薄切片机(Leica,德国);台式恒温振荡器(中国上海精宏实验设备有限公司);高压锅(美的,中国);电热风干燥箱(中国上海圣欣科学仪器有限公司);耐高温塑料染色架(中国福州迈新生物科技有限公司);计算机图像分析系统(惠普,美国)。
1.3 实验方法
福尔马林液固定;脱水、透明;浸蜡、包埋;切片、贴片、烤片;脱蜡、脱水;高压热修复;阻断:3%过氧化氢孵育10 min;封闭:山羊血清封闭液室温孵育10 min;加一抗50 μl室温静置1 h;加辣根过氧化物酶标记的二抗50 μl静置10 min;加链霉亲和素-过氧化物酶50 μl静置10 min;显色;终止;苏木精复染,盐酸酒精分化;常规脱水、透明;封片;显微镜下观察。
1.4 判断标准
以已知的该指标的免疫组化染色阳性片作为阳性对照,以PBS缓冲液代替一抗作为阴性对照,HE切片作为对照观察。
MMP-2、MMP-9阳性结果判定以细胞核不染色,细胞膜或胞质内出现棕色或棕黄色颗粒为阳性染色,阴性(-):染色细胞数≤10%;弱阳性(+):染色细胞数11% ~25%;阳性(++):染色细胞数26% ~50%;强阳性(+++):染色细胞数>50%。以上均以(-)为阴性;(+)~(+++)为阳性。图像分析:计算机图像系统拍照,每张切片随机选取5个视野,并记录。
2 结果
2.1 MMP-2、MMP-9在两组中的表达情况
对两组组织进行免疫组化SP法检测,结果发现,实验组 MMP-2强阳性(+++)28例,阳性率73.26%,MMP-9强阳性(+++)表达32例,阳性率69.77%;对照组 MMP-2、MMP-9 均无强阳性表达,阳性率分别为11.63%、9.30%,两组比较差异均有统计学意义(MMP-2 χ2=66.853,MMP-9 χ2=65.765,P 均<0.01),见表1。
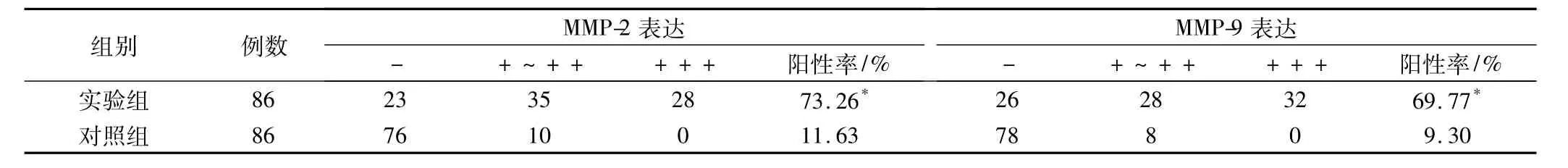
表1 MMP-2、MMP-9在两组中的表达情况
2.2 MMP-2、MMP-9表达与结直肠癌临床病理特征的关系
MMP-2和MMP-9的表达水平均与患者性别、肿瘤部位、肿瘤大小和病理学类型、组织学类型无关,而与肿瘤浸润深度、有无淋巴结转移及TNM分期有关(P <0.05),见表 2。
3 讨论
结直肠癌作为常见的恶性肿瘤,老年人的发病率逐年升高,是由多因素、多基因、多阶段参与的,其恶性程度主要由浸润和转移特性决定,而这种特性又是由恶性肿瘤细胞的增殖、细胞外基质的降解及大量血管生成决定的[2]。
基质金属蛋白酶家族(MMPs)是蛋白水解酶家族,主要依赖锌离子,能够降解基底膜和细胞外基质,参与肿瘤的侵袭、转移[3]。MMP-2是非糖化明胶酶,研究表明MMP-2能够导致肿瘤细胞介导的细胞外基质降解,参与肿瘤新生血管形成、肿瘤细胞的浸润和转移[4]。除此之外,MMP-2还能调节细胞粘附,降低细胞间粘附力,肿瘤细胞易于脱落形成远处转移[5]。
MMP-9是明胶酶B,能够降解明胶、弹性纤维、Ⅱ、Ⅳ、Ⅴ、Ⅶ和X型胶原,在多种恶性肿瘤中高表达,研究发现结直肠癌基底膜Ⅳ型胶原蛋白的缺失与组织MMP-9表达增强有关[6]。有报道称MMP-9拮抗剂抑制结直肠癌细胞黏附,表明MMP-9促进结直肠癌细胞的侵袭和转移[7]。
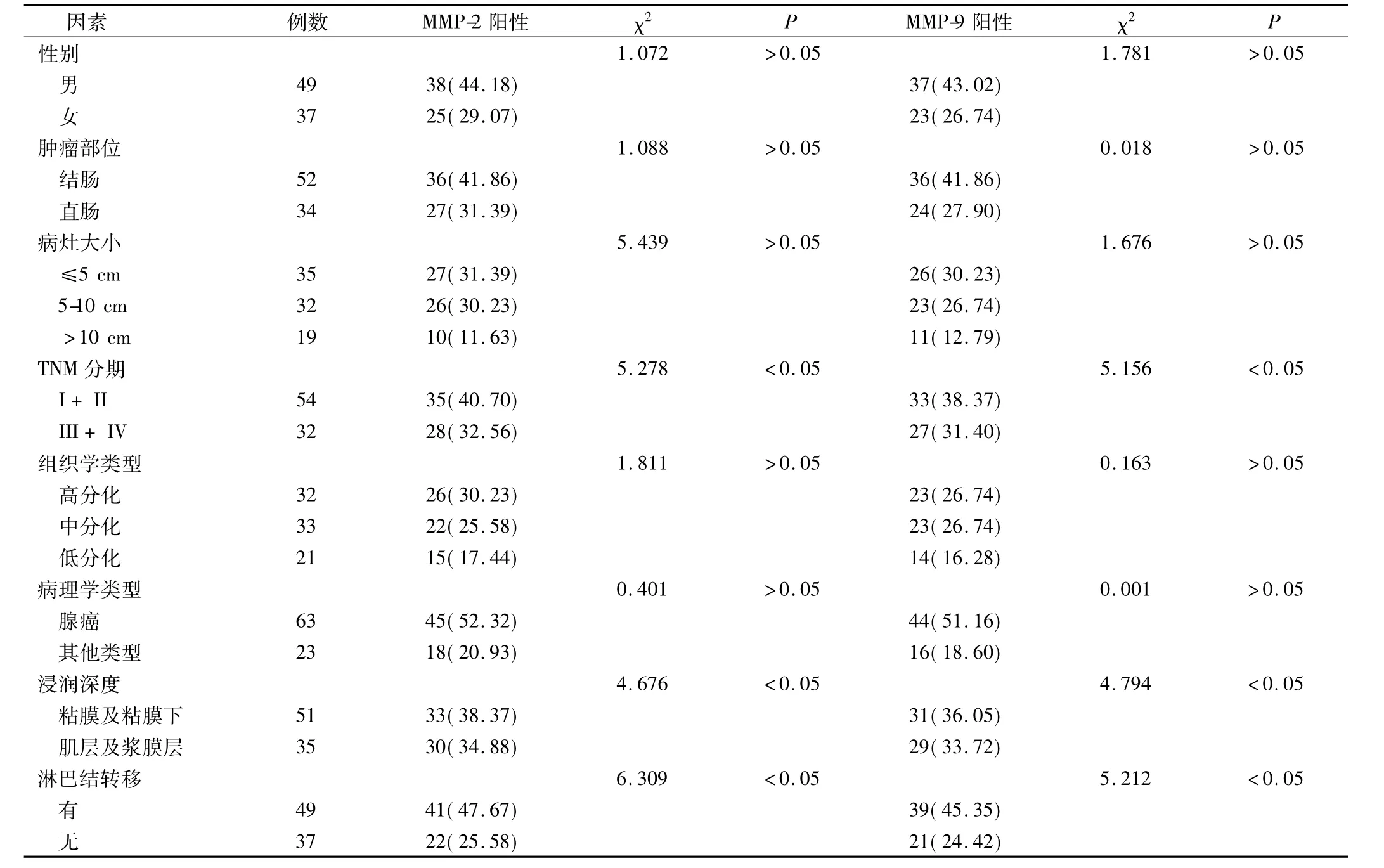
表2 MMP-2、MMP-9表达与结直肠癌临床病理特征的关系(例,%)
在本实验中,选取经病理证实为结直肠癌的组织作为实验组,癌旁正常组织作为对照组,采用免疫组织化学法检测两组组织内MMP-2、MMP-9的表达,结果发现实验组 MMP-2强阳性28例,阳性率73.26%,MMP-9强阳性表达32例,阳性率69.77%;对照组MMP-2、MMP-9均无强阳性表达,阳性率分别为11.63%、9.30%,两组比较差异有统计学意义。对两组组织中MMP-2、MMP-9的表达与性别、肿瘤部位、病灶大小、TNM分期、组织学类型、病理学类型、浸润深度、淋巴结转移等方面的关系进行分析,结果发现MMP2和MMP-9的表达水平均与患者性别、肿瘤部位、肿瘤大小和病理学分型、组织学类型无关,与肿瘤浸润深度、淋巴结转移及TNM分期有关,统计学显示有差异。这提示,MMP-2、MMP-9在结直肠癌组织中表达升高,并且随着肿瘤浸润深度深、有淋巴结转移、TNM分期越晚,结直肠癌组织中MMP2和MMP-9表达越高。既往研究表明,在人体多种恶性肿瘤中,MMP-2高表达导致细胞外基质降解,肿瘤新生血管生成,肿瘤发生浸润转移[8]。MMP-9在结直肠癌组织中高表达,在非癌组织中也有少量的表达,能够起到肿瘤抑制因子的作用[9]。截止目前,绝大部分研究均发现MMP-9能够加速肿瘤细胞增殖,促进结直肠癌的发生发展[10]。这均与本实验结果相一致。
综上所述,本研究发现MMP-2、MMP-9在结直肠癌组织中高表达,两者的表达与结直肠癌浸润深度、有无淋巴结转移及TNM分期有关,可能在肿瘤的发生、发展、浸润、转移过程中发挥重要作用。MMP-2和MMP-9与结直肠癌发生发展的具体机制仍需进一步实验研究,为临床上寻找结直肠癌新的治疗方式提供理论依据。
[1]Puljiz M,Puljiz Z,Vucemilo T,et al.Prognostic significance of matrix metalloproteinases 2 and 9 in endometrial cancer〔J〕.Coll Antropol,2012,36(4):1367.
[2]Lvaska J,Heino J.Adhesion receptors and cell invasion:mechanisms of integrin-guided degradation of extracellular matrix〔J〕.Cell MolLife Sci,2000,57(11):16-24.
[3]Edge SB,Byrd DR,Compton CC,et al.AJCC cancer staging manual〔M〕.7th ed.New York:Springer,2010.
[4]王光茂,原银萍,赵翠秀,等.结肠癌组织 MMP-2和MMP-9及VEGF表达临床意义的研究〔J〕.中华肿瘤防治杂志,2011,18(16):1267-1269.
[5]刘玲莉,朱德茂.乳腺癌组织中MMP-2、MMP-9表达与其预后的相关性〔J〕.实用癌症杂志,2010,25(3):300.
[6]袁宗怀,陈希平,张爱莉,等.转化生长因子β1和基质金属蛋白酶2在多发病灶乳头状甲状腺癌肿的表达及意义〔J〕.中华临床医师杂志(电子版),2011,5(3):691-695.
[7]Garg P,Sarma D,Jeppsson S,et al.Matrix metalloproteinase-9 functions as a tumor suppressor in colitis-associated cancer〔J〕.Cancer Res,2010,70(2):792-801.
[8]Kapral M,Wawszczyk J,Jurzak M,et al.Evaluation of the expression of metalloproteinases 2 and 9 and their tissue inhibitors in colon cancer cells treated with phytic acid〔J〕.Acta Pol Pharm,2010,67(6):625-629.
[9]Kim SM.ERK5 regulates invasiveness of osteosarcoma by inducing MMP-9〔J〕.J Orthop Res,2012,30(7):1040-1044.
[10]赵 丹,龚光伟,李胜文.MMP-2、MMP-9在胃癌中表达的相关性及其与胃癌生物学行为的关系〔J〕.实用癌症杂志,2013,28(4):341-343.

