人工感染猪圆环病毒2型仔猪的组织病理学观察
李 勇,郭 慧,钟友宝(江西农业大学动物科学技术学院,江西南昌330045)
人工感染猪圆环病毒2型仔猪的组织病理学观察
李勇,郭慧,钟友宝
(江西农业大学动物科学技术学院,江西南昌330045)
摘 要:为探索猪圆环病毒2型(PCV-2)对仔猪的致病机理,采用免疫组化方法和HE染色对人工感染PCV-2仔猪的呼吸、消化及淋巴系统主要器官进行抗原定位和组织病理观察。结果显示,淋巴器官的组织广泛分布阳性抗原,尤其在淋巴小结较为密集,组织出现不同程度的棕黄色着色,不均匀分布在胞质中。消化与呼吸系统的实质性器官功能性小叶不完整,组织结构紊乱,组织细胞呈不同程度的胞质溶解、胞核固缩及出现包涵体等病理变化。淋巴器官的组织细胞出现不同程度的裂解与消失,严重病例中大多数淋巴细胞成团消失,难以发现较为完整的淋巴小结,并在细胞质中出现球形的包涵体,也具有呈单或团状的类上皮样组织结构,细胞质出现溶解或消失,仅剩细胞膜的结构,出现胞核固缩,导致组织的空泡化现象。
关键词:仔猪;猪圆环病毒2型;组织病理学
1974年德国Tischer发现猪圆环病毒(Porcine circovirus,PCV)是已知的最小动物病毒之一。该病毒在分类学上属圆环病毒科圆环病毒属,是直径为17nm、呈20面体对称结构、基因组大小约为1.76kb、无囊膜的单股环状DNA病毒。PCV对外界理化因子的抵抗力较强,即便在pH 3的酸性或70℃的高温环境中也能存活一段时间,氯仿作用不失活。现已知PCV有非致病性的PCV-1和致病性的PCV-2两个血清型。猪对PCV-2具有较高的易感性,感染猪可自鼻液、粪便等排泄物中排出病毒,可经口腔及呼吸道途径感染不同年龄的猪。PCV-2是断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)和皮炎与肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)的主要病原。PMWS最早发现于加拿大,主要发生于5周龄~16周龄的猪,最常见于6周龄~8周龄的断奶仔猪,极少感染乳猪。一般仔猪断奶后2d~3d或1周开始发病,急性发病猪群的病死率可达10%,耐过猪后期的生长发育明显受阻,常常由于并发或继发细菌与病毒感染而使病死率增加至25%以上。研究发现PCV-2具有多种动物易感性,除引起保育猪和育肥猪的系统性疾病和亚临床感染,两者共同表现为减少平均日增重[1],此外还可以感染小牛和野猪[2-3],在鸟类、蚊子和啮齿类等动物中也检测到该病毒[2],而且常与多种病菌混合感染,如细小病毒可能成为猪圆环病毒关联疾病的重要因子[4],PCV-2引起的多系统衰竭综合征常意味着对养猪企业的巨大经济意义[5],猪圆环病毒关联疾病的细胞和分子发病机理复杂[6],研究表明不同日龄感染猪浆细胞产生的IgA、IgG和IgM表现出随小肠腺的高度降低而增多,而浆细胞分布密度从十二指肠至回肠逐渐呈现下降趋势[7]。
免疫器官在对抗病毒的侵袭中承担关键作用,对感染猪的免疫器官研究具有重要意义,尤其是断奶仔猪的免疫器官正处于发育过程中,免疫器官功能还未完善,如受到病毒的感染易使免疫器官发生病理变化。以往研究显示圆环病毒感可导致猪免疫器官淋巴组织T细胞和B细胞减少,且淋巴细胞数量的变化受伴发病原的影响,其中猪瘟病毒影响最大,伪狂犬病病毒和猪繁殖与呼吸综合征病毒次之[8]。大多数研究认为仅从临床症状、肉眼病变及分子检测不足以对猪圆环病毒病进行诊断[9],为深入探索人工感染PCV-2仔猪的病理变化,分别应用免疫组化方法定位淋巴器官的PCV-2的分布,经典HE染色观察致病猪的呼吸与消化系统主要器官及相关淋巴器官的组织病理变化,尤其是分析淋巴器官的病理损害,通过对组织病理特征的综合评估,探讨此病毒致病的病理变化规律。
1 材料与方法
1.1材料
1.1.1试验用动物 试验选用健康SPF仔猪经鼻喷入PCV-2病毒感染致病,待仔猪出现明显临床症状,处死剖检仔猪,观察主要内脏器官的大体病理变化,并迅速采集呼吸与消化系统的主要器官,淋巴结及脾脏经PBS洗净后置入Bouin氏液和40g/L多聚甲醛溶液进行固定保存。
1.1.2主要仪器设备和试剂 XSP-12CE电脑型生物显微镜为上海长方光学仪器有限公司产品;JD4000-2电子分析天平为沈阳龙腾电子有限公司产品;YD-202A-Ⅲ型电脑快速冷冻石腊两用切片机为浙江省金华市益迪医疗设备有限公司产品;KD-P电脑生物组织摊片机、KD-H电脑生物组织烘片机为浙江省金华市科迪仪器设备有限公司产品;DK-8D电热恒温水槽为上海森信实验仪器有限公司产品;WDP-9162电热恒温培养箱为上海安亭科学仪器有限公司产品;SZ-2自动双重蒸馏水器为上海沪西分析仪器厂产品;TFG-1200通风柜为苏州苏洁净化设备有限公司产品;HE染液等。
1.2方法
1.2.1切片制作及HE染色 将固定器官经脱水、透明、浸蜡、包埋、并制作5μm厚的切片。采用HE染色,经XSP-12CE电脑型生物显微镜观察和拍照。1.2.2 免疫组化染色 切片脱蜡、水化;30mL/L H2O2室温孵育、抗原修复、羊血清室温封闭;滴加稀释的兔抗PCV-2多克隆抗体及IgG抗体,室温孵育、PBS冲洗、DAB显色[10-11];经复染、脱水、透明及封片。用PBS代替一抗作为阴性对照,采用XSP-12CE电脑型生物显微镜观察和拍照。PCV-2抗原阳性细胞呈棕黄色,阴性细胞不着色。
2 结果
2.1症状与剖检变化
试验证明经鼻腔呼吸感染属于该病毒传播的有效途经,仔猪难以抵抗经呼吸道的病毒侵入。感染仔猪在不同时期出现明显临床症状,诸如呼吸困难、咳嗽、厌食、精神委糜、被毛粗乱等,严重患病仔猪卧地不起,呼吸衰竭甚至死亡。病理剖检显示,肺存在实质性病理变化并肿大,颜色由粉红色变为深红色,成为最严重的病变器官。除了呼吸道沿线的淋巴结和扁桃体呈现严重肿大、出血、大理石花纹等病变之外,位于其他部位的淋巴结,诸如腹股沟淋巴结、肩前淋巴结、髂下淋巴结等均出现肿大、出血等不同程度的病理变化。
2.2呼吸与消化主要器官的组织病理
整个肝组织结构较为散乱,肝小叶的组织边界不明显,细胞边缘模糊,大小形态不清晰,相邻的肝细胞出现融合或肿大,胞核出现固缩或崩解,在病变严重的区域肝组织甚至出现空泡化(图1A中的a)。肺的组织结构出现实质性病理变化,细胞增生及组织细胞浸润并填充肺泡,肺泡间隔纤维化,肺泡崩裂至界限不清晰并填充较多血细胞(图1B中的b)。小肠黏膜上皮脱落,边缘模糊,且较为凌乱,隐窝被组织填充,固有膜中淋巴集结形态不一,稍增大且出现类上皮样组织增生,淋巴细胞分布疏松,可见明显的空隙,细胞具有融合及肿大现象,细胞核固缩甚至消失(图1D中的c),并出现病毒包涵体(图1D中的d)。
2.3外周淋巴器官的组织病理
在检测的淋巴结、脾及扁桃体等外周淋巴器官中,组织细胞出现不同程度的裂解与消失,严重病例的淋巴器官可见淋巴小结中大多数淋巴细胞成团消失,难以发现较为完整的组织,而且在细胞质中具有较多小球形的包涵体(图1D、E、F中的d),围绕小结中心出现呈单或团状的类上皮样组织(图1F中的e),细胞肿大,细胞质出现溶解或消失,仅剩下细胞膜的结构,同时有些细胞出现核固缩,比正常细胞核更小,导致组织的空泡化现象。而症状较轻的病例则出现细胞肿胀、胞核固缩、细胞边界不清晰、胞核不明显等组织病理变化(图1F)。脾小结中心结构不完整,细胞排列出现紊乱,中心的较多细胞类上皮样化,细胞出现核固缩甚至崩解,同时淋巴小结周围结缔组织增生。
2.4淋巴器官的抗原分布
病变淋巴器官的免疫组化观察与分析结果显示,蓝色为组织的背景色,携有阳性抗原的组织出现不同程度的棕黄色颗粒着色,不均匀分布在胞质中。淋巴器官均有阳性抗原的分布,严重病例的淋巴结阳性着色区域分布非常密集,呈现许多大小不规则的颗粒状(图2A中的f),与细胞核着色呈明显对照性的两个区域,而较为完整的组织则难以观察到阳性着色颗粒,这些免疫组化结果显示阳性抗原分布的组织染色程度与病理组织的损伤程度表现一致,即淋巴器官的组织病理变化越严重,其病毒抗原分布越多。此外,不同的淋巴器官或同一淋巴器官的不同部位呈现不同程度的阳性着色。根据PCV-2阳性显色细胞基本可分为严重、中等及轻微3个不同等级的群体,但在所有淋巴器官中较为共同的特征是着色区域常出现在淋巴小结或淋巴组织的中心部位,并且不管是严重病例或是轻微病例均以沿其中心的方向出现阳性着色逐渐增加这一趋势。
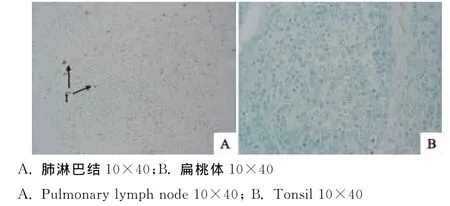
图2 阳性抗原分布Fig.2 Distribution of positive antigen
3 讨论
在检测的消化、呼吸及淋巴器官中,肺的组织病理变化最为严重,同时消化器官尤其是肝和小肠也出现病理变化,而与之相对应的淋巴器官则呈现淋巴小结细胞核固缩、淋巴细胞消失等常见变化,同时出现淋巴细胞类上皮样变化及结缔组织增生。其中部分严重病例的淋巴器官出现淋巴细胞减少、坏死,甚至形成肉芽肿和大小不等的球形包涵体,与之前野外感染的病理变化具有类似特征[12]。
淋巴器官及组织病理的结果可以说明应用免疫组织化学方法有助于查找PCV-2抗原分布及辅助诊断其所致PMWS疾病,病毒侵袭及所造成的病理损伤与阳性抗原的分布呈现一致性,根据以上结果建立淋巴器官的组织病理损害程度,有利于深入探寻这种病毒的致病性规律。
参考文献:
[1] López S S,Sibila M,Nofrarías M,et al.Effect of porcine circovirus type 2(PCV2)load in serum on average daily weight gain during the postweaning period[J].Vet Microbiol,2014,174(3-4):296-301.
[2] Halami M Y,Freick M,Shehata A A,et al.Susceptibility of calves to porcine circovirus-2(PCV2)[J].Vet Microbiol,2014,173(1-2):125-131.
[3] An Dong-jun,Lim Seong-In,Kim Yong Kwan,et al.Genetic characterization of porcine circovirus type 2in the Korean wild boar population[J].Vet Microbiol,2013,169(3-4):147-153.
[4] Tanja Opriessnig,Xiao Chao-Ting,Gerber Priscilla F,et al. Identification of recently described porcine parvoviruses in archived North American samples from 1996and association with porcine circovirus associated disease[J].Vet Microbiol,2014,173(1-2):9-16.
[5] Alarcon P,Rushton J,Wieland B.Cost of post-weaning multisystemic wasting syndrome and porcine circovirus type-2subclinical infection in England-An economic disease model[J]. Prev Vet Med,2013,110(2):88-102.
[6] Dvorak Cheryl M T,Puvanendiran S,Murtaugh M P.Cellular pathogenesis of porcine circovirus type 2infection[J].Virus Res,2013,174(1-2):60-68.
[7] Bianco C,Felice V,Panarese S,et al.Quantitative immunohistochemical assessment of IgA,IgM,IgG and antigen-specific immunoglobulin secreting plasma cells in pig small intestinal Lamina propria[J].Vet Immunol Immunop,2014,160(3-4):281-287.
[8] 聂立欣,罗满林,孔小明,等.猪圆环病毒感染后部分免疫器官的组织化学检测[J].动物医学进展,2006,27(1):58-61.
[9] 尹业师,黄伟坚,陈 琼,等.猪圆环病毒感染的病理组织学和致病机理研究进展[J].动物医学进展,2006,27(11):18-21.
[10] Kawashima K,Yamada S,Kobayashi H,et al.Detection of porcine reproductive and respiratory syndrome virus and Mycoplasma hyorhinis antigens in pulmonary lesions of pigs suffering from respiratory distress[J].J Comp Pathol,1996,114:315-323.
[11] Kawashima K,Tsunemitsu H,Horino R,et al.Postweaning multisystemic wasting syndrome in pigs in Japan:clinical manifestation of the diseased pigs,experimental infection of porcine circovirus type 2,and epidemiological investigation of PCV2and PMWS[J].Bulletin of the National Institute of Animal Health,2002,109:9-16.
[12] 聂立欣,孔小明,罗满林,等.仔猪感染PCV-2的病理组织学变化[J].畜牧与兽医,2006,38(8):51-52.
Histopathological Observation on Piglets Artificially Infected with PCV-2
LI Yong,GUO Hui,ZHONG You-bao
(College of Animal Science and Technology,Jiangxi Agricultural University,Nanchang,Jiangxi,330045,China)
Abstract:In order to investigate pathogenesis of piglets artificially infected with PCV-2,histopathological observation and antigen location of main organs in respiratory,digestive and lymphatic system of piglets artificially infected with PCV-2were carried out by immunohistochemistry method and HE staining.The results showed as follows:positive antigen distributes widely in tissues of lymphatic organs,especially intensively in lymphoid follicles.Brown yellow staining occurs in lymph tissues at different extent and distributes unevenly in cytoplasm.Functional leaflets in parenchymatous organs of digestive and respiratory systems are not integrated.Histological structures are in disorder,with pathological lesions such as plasmolysis,karyopycnosis and inclusion bodies at uneven extent and so on.Histocytes in lymphatic organs clearage and disappear variously.Most of lymphocytes disappear in clusters at severe piglet cases.It is difficult to find intact lymphoid follicles,moreover,global inclusion bodies emerge in cytoplasm with simple or group epithelium tissue structures.Cytoplasm becomes dissolved and disappeared,and cellular membrane is only left with karyopycnosis leading to vacuolization phenomenon.
Key words:piglet;PCV-2;pathology
作者简介:李 勇(1970-),男,江西芦溪人,副教授,博士,主要从事畜禽组织结构研究。
基金项目:国家自然科学基金项目(31360592);江西省科技厅支撑计划(赣财教[2007]173号);江西省教育厅科技计划项目(GJJ13288);江西省农业厅项目;江西农业大学博士基金项目
收稿日期:2014-12-09
中图分类号::S852.31;S852.659.2
文献标识码:A
文章编号:1007-5038(2015)07-0071-04

