种猪群猪圆环病毒病的净化技术研究
管 亮,华 耀,施 雷,李 郁,2,魏建忠,2*(.安徽农业大学动物科技学院,安徽合肥230036;2.安徽省畜禽产业共性技术研究院,安徽合肥230036)
种猪群猪圆环病毒病的净化技术研究
管亮1,华耀1,施雷1,李郁1,2,魏建忠1,2*
(1.安徽农业大学动物科技学院,安徽合肥230036;2.安徽省畜禽产业共性技术研究院,安徽合肥230036)
摘 要:为探究种猪群猪圆环病毒病(PCVD)的净化控制措施,通过对种猪群实施猪圆环病毒2型(PCV-2)灭活疫苗免疫(基础免疫2次,以后每隔4个月加强免疫1次),检测(基础免疫前、二免后20d和二免后3个月、加强免疫后3个月分别采集前腔静脉血,分离血清,采用ELISA检测PCV-2抗体、猪瘟抗体,PCR方法检测PCV-2核酸),淘汰加强免疫后PCV-2核酸仍为阳性的种猪,结合分析母猪PCV-2疫苗免疫前后繁殖性能的差异。为期1年净化措施实施的结果显示,种猪群的PCV-2核酸阳性率从33.33%显著下降到3.42%,其中后备猪的PCV-2核酸阳性率从39.02%下降到8.57%,种公猪从33.33%下降到0、经产母猪从15.38%下降到1.56%;母猪窝产仔数增加0.52头(P<0.05),窝产活仔数增加0.78头(P<0.01),窝产木乃伊胎数减少0.3头(P<0.01);种猪群猪瘟免疫抗体合格率从53.73%提高到83.49%,平均阻断率从43.31%升高到63.46%,与种猪群PCV-2核酸检测阳性率呈现负相关。结果表明,实施免疫、检测、淘汰措施对于种猪群PCVD的净化成效明显,该技术可为规模化猪场开展PCVD的净化提供科学依据,具有推广应用价值。
关键词:猪圆环病毒2型;种猪;免疫;净化;猪瘟抗体
猪圆环病毒病(Porcine circovirus diseases,PCVD)主要是由猪圆环病毒2型(Porcine circovirus type 2,PCV-2)引起的单独或继发混合感染其他致病微生物的猪圆环病毒相关疾病(Porcine circovirus associated disease,PCVAD)的总称,包括断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)、猪皮炎与肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)、猪呼吸道疾病综合征(Porcine respiratory disease complex,PRDC)及怀孕母猪的繁殖障碍(Reproductive disorders)等[1]。目前,PCVD已呈世界性分布,是全球公认的危害养猪业的重要疫病,也是困扰我国养猪业的三大疫病之一[2]。不同年龄、品种、性别的猪均可感染PCV-2,而感染的种猪群可能是猪场中PCV-2最主要的传染源[3]。猪感染PCV-2可引起机体免疫抑制、免疫失败,严重的呼吸系统、消化系统疾病及繁殖障碍,饲料报酬低,病死率上升等,给养猪业造成巨大的经济损失[4]。
我国对PCVD的研究相对较晚,且主要侧重于流行病学和诊断方面,而对其控制和净化研究较少。随着PCV-2灭活疫苗在国内的推广使用,越来越多的研究报告显示,疫苗免疫是控制PCVD最经济有效的手段[5]。本研究拟通过对种猪群的免疫、检测、淘汰,以期探索PCVD区域净化控制的程序和方法,从而为规模化猪场PCVD的有效防控提供科学依据。
1 材料与方法
1.1材料
1.1.1疫苗 PCV-2灭活疫苗(DBN-SX07株)为成都天邦生物制品有限公司产品,批号为201206;猪瘟耐热保护剂活疫苗(细胞源)为成都天邦生物制品有限公司产品,批号分别为201220和201253。
1.1.2主要试剂 2×Taq MasterMix、DNA Marker DL 2000为北京天根生化科技有限公司产品;蛋白酶K、SDS、Tris、TE缓冲液为上海生工生物工程技术服务有限公司产品;韩国金诺PCV-2-ELISA抗体检测试剂盒为上海吉帮生物科技有限公司产品;美国爱德士猪瘟病毒抗体检测试剂盒为北京元亨生物科技有限公司产品;其他试剂均为国产分析纯;PCV-2阳性血清由安徽农业大学动物科技学院动物传染病研究室保存。
1.1.3PCV-2引物设计及合成 参照文献[6]设计引物,序列如下:上游:5′-GGTTACACGGATATTGTAGTCC -3′,下游:5′-CGTTACCGCAGAAGAAGACAC-3′,扩增片段大小为630bp,引物由上海生工生物工程技术服务有限公司合成。
1.2方法
1.2.1试验时间及地点 2012年9月至2013年10月,选取安徽省六安市某规模化猪场开展净化工作,试验前该场未使用PCV-2疫苗,存栏基础母猪(含后备母猪)86头,种公猪14头。
1.2.2消毒程序 每周对猪舍进行带猪消毒1次~2次,每2周对猪场外环境进行喷雾消毒1次,消毒池内消毒液2d~3d彻底更换1次。猪只因出售、死亡、转群等形成的空栏及时进行冲洗。消毒剂选用醛制剂和氯制剂交替使用。
1.2.3疫苗免疫 2012年9月对该场种猪群采用全群普免的方法,进行基础免疫接种PCV-2灭活疫苗,间隔3周后加强免疫1次,以后每隔4个月加强免疫1次,耳根后肌肉注射,2mL/头;仔猪在21日龄进行首免,35日龄进行二免,1mL/头;后备种猪于配种前做基础免疫2次,产前1个月加强免疫1次,2mL/头。
1.2.4免疫监测 基础免疫PCV-2疫苗前对种猪群进行抽样采血,了解种猪群PCV-2带毒情况及猪瘟疫苗免疫水平。种猪群二免后20d、二免后3个月、加强免疫后3个月分别采集前腔静脉血4mL~5mL,分离血清,置-20℃低温保存。种公猪全部采血,经产母猪按≥50%比例、后备仔猪按5%比例抽样采血。PCV-2抗体检测按照PCV-2-ELISA抗体检测试剂盒说明书进行操作。采用PCR方法检测PCV-2核酸,PCR反应体系总体积为25μL,包括2×Taq Master Mix 12.5μL,上下游引物各0.5μL,双蒸水6.5μL,DNA模板5μL。反应条件为:94℃5 min;94℃45s,54℃1 min,72℃1min,共35个循环;72℃10 min。PCR产物经15g/L琼脂糖凝胶电泳鉴定。
1.2.5淘汰制度 对免疫PCV-2疫苗后连续2次检测PCV-2核酸仍为阳性的种猪一律强制淘汰;对新补充的后备种猪逐头采血检测PCV-2核酸,阳性猪只一律淘汰,不做种用,阴性猪只并入种群;繁殖性能低下的老龄母猪按计划实施淘汰;种群中出现发病猪只立即隔离治疗观察,检测PCV-2核酸呈阳性立即淘汰。
1.2.6母猪PCV-2疫苗免疫前后繁殖性能比较
收集试验母猪免疫PCV-2疫苗前(2011年8月至2012年8月,152头)的生产数据,以及试验母猪免疫PCV-2疫苗后(2012年10月至2013年10月,220头)的生产数据,包括窝产仔数、窝产活仔数、窝产死胎数、窝产木乃伊胎数、窝产弱仔数、初生重等。1.2.7 种猪群猪瘟免疫抗体水平监测 该场种猪群猪瘟疫苗每4个月普免1次。所有血清样品采用ELISA方法检测猪瘟免疫抗体,按照猪瘟病毒抗体检测试剂盒说明书进行操作。观察种猪群猪瘟免疫抗体水平的变化,并分析种猪群PCV-2核酸检测阳性率与猪瘟免疫抗体阻断率的相关性。
1.2.8统计分析 采用Excel 2003及SAS 9.0软件进行统计学分析,PCV-2核酸阳性率和猪瘟免疫抗体合格率的比较采用卡方检验,抗体水平比较采用单因素方差分析和DUNCAN多重比较,母猪繁殖性能比较采用t检验,相关性分析采用Pearson简单相关分析。
2 结果
2.1种猪群血清中PCV-2核酸检测
种猪群的PCV-2核酸检测结果见表1。2012 年9月该场未免疫商品化PCV-2疫苗时,自种猪群中采集的67份血清PCV-2抗体检测均为阳性,PCV-2核酸检测阳性血清占20份,阳性率为33.33%(7份血清不足未检测);其中后备猪的PCV-2核酸阳性率为39.02%,种公猪为33.33%,经产母猪为15.38%。种猪群集中免疫2次PCV-2疫苗后,血清中PCV-2核酸阳性检出率不断下降。2012年11月二免后20d,种猪群PCV-2核酸阳性率为27.14%。2013年1月二免后3个月,种猪群PCV-2核酸阳性率为16.44%,显著低于2012年9月(P<0.05)。2013年6月加强免疫后3个月,种猪群PCV-2核酸阳性率为10.09%,显著低于2012 年9月和2012年11月(P<0.05)。2013年9月种猪群中采集的117份血清,检出PCV-2核酸阳性血清4份,PCV-2核酸阳性率下降到3.42%,显著低于其余各组(P<0.05);其中后备猪PCV-2核酸阳性率下降到8.57%,种公猪PCV-2核酸检测全为阴性,经产母猪下降到1.56%,均显著低于2012年9月(P<0.05)。
2.2种猪群血清中PCV-2抗体检测
种猪群的PCV-2抗体平均S/P值变化见表2。结果显示,后备猪、种公猪、经产母猪的PCV-2平均抗体水平均呈先下降后上升的趋势。2012年9月,种猪群的PCV-2抗体水平普遍较高,免疫PCV-2疫苗后,抗体水平逐渐下降。2013年6月PCV-2抗体水平最低,且显著低于2012年9月、2012年11月和2013年1月(P<0.05)。2013年9月种猪群PCV-2抗体检测全为阳性,且抗体水平有所上升。

表1 种猪群血清中PCV-2核酸检测阳性率Table 1 PCV-2nucleic acid positive rate of breeding pig sera

表2 种猪群血清中PCV-2抗体平均S/P值统计表(平均数±标准误差)Table 2 Average value of PCV-2antibody S/P of breeding pig sera(mean±SE)
2.3不同年龄组猪群血清中PCV-2核酸检测
根据被检猪群的年龄分布,将被检猪群分为4个年龄组。不同年龄组猪群的PCV-2核酸检测结果见表3。2012年9月基础免疫PCV-2疫苗前,6~9月龄组PCV-2核酸检测阳性率最高为50%,其余3个年龄组均在20%左右。随着PCV-2疫苗的使用,各年龄段猪群PCV-2核酸阳性率均有所下降。2013年9月检测数据显示,6月~9月龄组未检测出PCV-2核酸阳性猪(P<0.05),≥10月龄成年种猪阳性率显著下降到1.22%(P<0.05),2月龄~3月龄组显著下降到10%(P<0.05),4月龄~5月龄组下降到14.28%(P>0.05)。
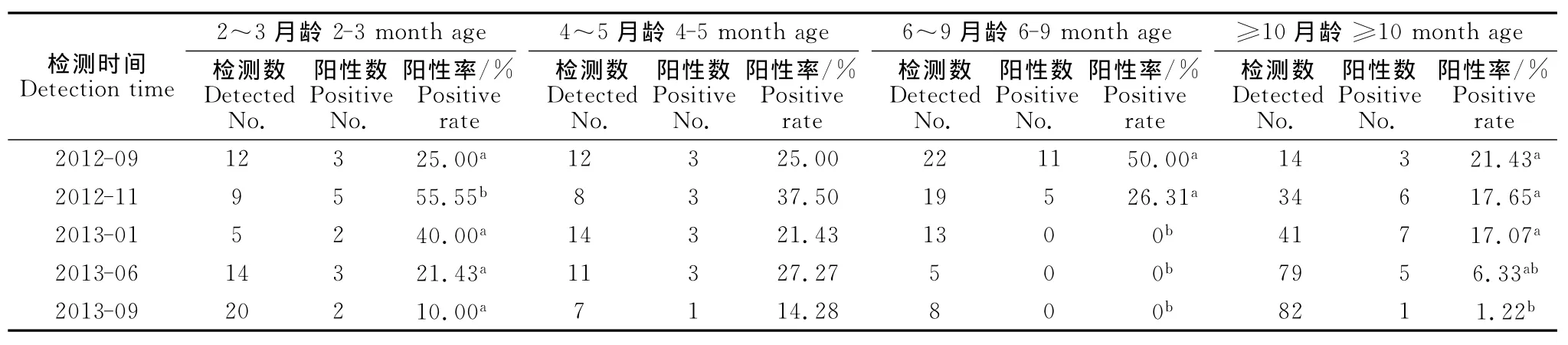
表3 不同年龄组猪群血清中PCV-2核酸检测阳性率Table 3 PCV-2nucleic acid positive rate of breeding pig sera among different ages
2.4种母猪PCV-2疫苗免疫接种前后的繁殖性能比较
对经产母猪PCV-2疫苗免疫前后的繁殖性能进行比较,结果见表4。窝产仔数增加0.52头,差异显著(P<0.05);窝产活仔数增加0.78头,差异极显著(P<0.01),窝产木乃伊胎数减少0.3头,差异极显著(P<0.01);窝产死胎数、窝产弱仔数和仔猪初生重免疫前后无显著差异(P>0.05)。
2.5种猪群血清中猪瘟免疫抗体检测
种猪群的猪瘟免疫抗体检测结果见表5。2012年9月免疫PCV-2疫苗前,种猪群的猪瘟免疫抗体合格率为53.73%,平均阻断率为43.31%,免疫效果较差。种猪群免疫PCV-2疫苗后,猪瘟免疫抗体水平也随之有显著提升。2012年11月猪瘟免疫抗体合格率和平均阻断率较2012年9月显著升高(P<0.05);2013年1月猪瘟免疫抗体合格率升高到93.15%,平均阻断率升高到74.05%,显著高于2012年9月和2012年11月(P<0.05);2013年6月种猪群猪瘟免疫抗体水平有所下降,与2012年9月、2013年1月相比均差异显著(P<0.05)。
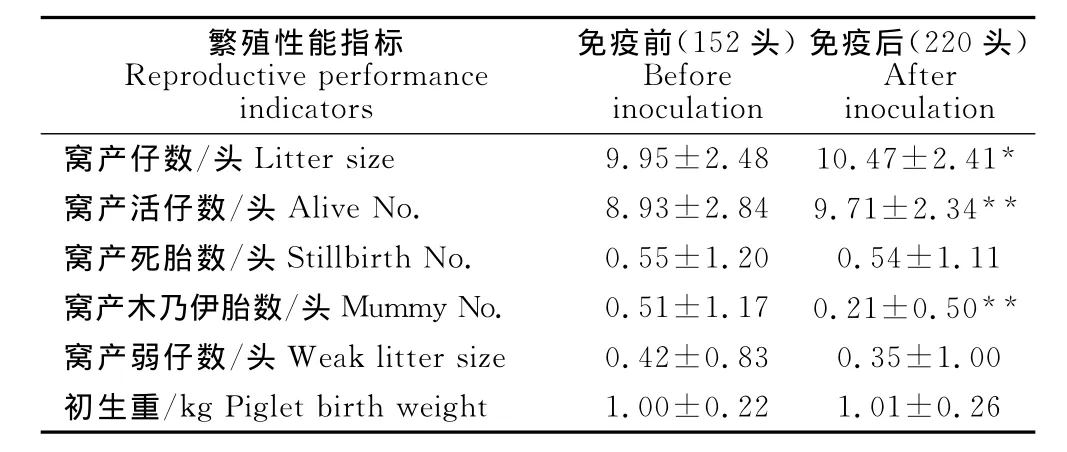
表4 种母猪PCV-2疫苗免疫接种前后的繁殖性能比较Table 4 Reproduction performance comparison of sows before and after inoculation of PCV-2vaccine
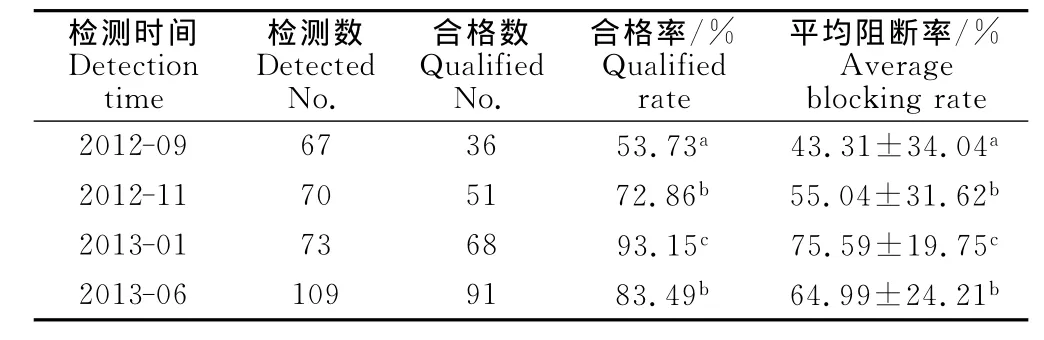
表5 种猪群血清中猪瘟免疫抗体检测结果Table 5 Test results of CSFV antibody in sera of breeding swine
2.6种猪群PCV-2核酸检测阳性率与猪瘟免疫抗体阻断率的相关性
由表6可以看出,血清中PCV-2核酸检测阳性率高的月份,其猪瘟免疫抗体水平较低,PCV-2核酸检测阳性率低的月份,其猪瘟免疫抗体水平则较高。Pearson卡方检验结果显示,种猪群血清中PCV-2核酸检测阳性率与猪瘟免疫抗体阻断率呈负相关(X2=10.022,r=-0.155,P<0.01)。

表6 种猪群PCV-2核酸检测阳性率与猪瘟免疫抗体阻断率的相关性Table 6 Relativity between PCV-2nucleic acid positive rate of breeding swine and the blocking rate of CSFV immune antibody
3 讨论
3.1净化措施对种猪群PCV-2感染的控制效果
近年来PCVD的流行范围已经波及全国各地,成为危害我国养猪生产的重要免疫抑制性疫病之一[7]。种猪群的健康稳定是规模化猪场稳定生产和持续发展的前提,猪场PCVD控制的好坏直接关系到整个种猪群的健康状况[8],实施以净化种猪和后备种猪为主的PCVD防控措施有切实意义。商品化PCV-2疫苗的广泛应用为有效防控PCVD发挥了重要作用。国外大量田间试验证实,猪群免疫PCV-2疫苗可明显降低血清中病毒血症的出现,降低PCV-2感染猪的临床症状,并且能减少血清和各组织器官的病毒载量[9]。本研究中,猪场未免疫PCV-2疫苗时,种猪群的PCV-2抗体阳性率为100%,PCV-2核酸检测阳性率为33.33%,种猪群中PCV-2感染较为严重,病毒血症与抗体共存现象显著。经过为期1年的免疫、检测、淘汰的净化工作,该场核心猪群PCV-2核酸检测阳性率下降89.74%,PCV-2抗体水平良好,表明种猪群中PCV-2感染已得到有效控制,疫苗免疫已使种猪群获得较稳定的免疫保护力。定期的免疫检测可以随时了解种猪群的免疫状态,PCV-2抗体监测结果显示,后备猪、种公猪、经产母猪的PCV-2抗体水平均呈现先下降后上升的趋势,由于PCV-2核酸检测阳性率一直呈下降趋势,推测种猪群血清中PCV-2免疫抗体可能替代了感染抗体。然而,疫苗免疫并不能完全清除体内已感染的病毒[10],因此及时淘汰隐性感染或潜伏感染的种猪,可以从源头上降低PCV-2感染风险。本研究通过淘汰PCV-2核酸阳性种猪和繁殖性能低下的老龄母猪,补充PCV-2核酸阴性后备猪进入种猪群,逐步替代原种猪群。到2013年9月,公猪群PCV-2核酸检测全为阴性,经产母猪群PCV-2核酸检测阳性率已显著下降到1.56%。上述研究结果表明,对种猪群实施PCV-2疫苗免疫、定期进行全群监测、淘汰带毒猪、培育阴性健康种群等净化措施是控制猪场PCV-2感染的有效手段。此外,对种猪群血清样本分不同年龄段分析,发现在净化研究后期,PCV-2核酸检测阳性猪主要存在于2月龄~3月龄组和4月龄~5月龄组的后备猪群,因此后备猪在并入种猪群前应严格按照淘汰制度进行逐头检测,以确保种猪群中没有新的传染源进入。还应加强保育舍和生长舍的消毒卫生工作和饲养管理,以增强幼龄仔猪的抵抗力。
3.2净化措施对母猪繁殖性能的影响
众多研究表明PCV-2在导致母猪繁殖障碍中扮演着重要角色,因此母猪免疫接种PCV-2疫苗对猪场恢复收益率有着重要经济意义[11]。本研究中,与PCV-2疫苗免疫前相比较,免疫后的母猪平均窝产仔数和窝产活仔数分别增加了0.52头和0.78头,窝产木乃伊胎数降低0.3头,表明对母猪群实施免疫、检测、淘汰的净化措施后,猪群生产性能得到明显提高,健康状况也得到极大改善。张毅等[12]研究发现,单纯对母猪接种PCV-2疫苗后,其窝产仔数提高0.36头,窝产活仔数提高0.43头。由此看出,在净化过程中,淘汰措施在提高母猪的窝产仔数和窝产活仔数方面发挥了积极的作用,通过淘汰PCV-2带毒猪和繁殖性能低下的老龄母猪,种猪群的更新换代能够显著提高母猪群的整体繁殖性能,进而提升猪场的养殖效益。
3.3净化措施对猪瘟疫苗免疫效果的影响
PCV-2的长期存在会导致宿主体液免疫反应能力降低,从而造成猪体免疫功能受到抑制或紊乱[13]。司兴奎等[14]通过建立PCV-2人工感染模型证实了PCV-2感染可在一定程度上抑制猪瘟疫苗特异性的抗体产生,可以导致免疫猪的特异性抗体水平低下,血清抗体转阳性率下降。相关研究还证实了PCV-2感染对伪狂犬疫苗的体液免疫应答也有一定程度的抑制作用[15]。PCV-2感染是严重影响猪瘟、伪狂犬等疫苗免疫效果或免疫不确实的重要原因之一。本研究中对猪瘟免疫抗体水平监测的结果显示,PCV-2核酸检测阳性率与猪瘟免疫抗体阻断率呈现负相关,即种猪群PCV-2感染严重时,其猪瘟免疫抗体水平为43.31%,合格率仅达到53.73%,猪瘟疫苗免疫效果较差,未达到70%的保护水平。实施免疫、检测、淘汰的净化措施后,种猪群PCV-2核酸检测阳性率显著降低,其猪瘟免疫抗体水平与合格率也分别显著提高到63.46%和83.49%,猪瘟疫苗免疫效果有大幅度提升,从而进一步佐证PCV-2感染引起机体免疫抑制的危害性。
本研究通过实施PCV-2疫苗免疫、定期进行全群监测、淘汰带毒猪、培育阴性健康种群等措施,有效降低了种猪群中PCV-2的感染率,显著提高了母猪的繁殖性能,大幅度增强了猪瘟疫苗的免疫效果,从而表明该技术可为规模化猪场开展PCVD的净化提供科学依据,具有推广应用价值。
参考文献:
[1] Segales J,Allan G M,Domingo M.Porcine circovirus disease [J].Anim Health Res Rev,2005,6(2):119-142.
[2] Guo L J,Lu Y H,Wei Y W,et al.Porcine circovirus type 2 (PCV2):genetic variation and newly emerging genotypes in China[J].J Virol,2010,7(1):273.
[3] 赵东升,刘有昌,安福生,等.近年来我国猪圆环病毒病的流行状况及分析[J].养猪,2009(1):57-59.
[4] 王宪文,王丽荣,姚四新,等.猪圆环病毒病的流行诊断和控制进展[J].中国兽医杂志,2012,48(4):60-62.
[5] Chae C.Porcine circovirus type 2and its associated diseases in Korea[J].Virus Res,2012,164(1/2):107-113.
[6] 杨世兴,魏建忠,范伟兴,等.应用PCR技术检测猪圆环病毒[J].中国畜牧兽医,2006,33(12):70-71.
[7] 杨汉春.猪免疫抑制性疾病的流行特点与控制对策[J].中国畜牧兽医,2004,31(5):41-43.
[8] 修金生,吴顺意,周伦江,等.不同规模化猪场种猪猪瘟抗体检测与猪瘟净化[J].福建农业学报,2010,25(2):235-238.
[9] Lopez S,Segales S J,陶 莉.由猪圆环病毒引起的病毒血症对生产性能的影响[J].国外畜牧学:猪与禽,2013,33(5):20-22.
[10] 刘建波,张 辉,刘长明.猪圆环病毒病的流行趋势与防控对策[J].动物医学进展,2014,35(1):111-115.
[11] Siebel K.Global experiences from the field around one-shot vaccination[J].Pig Progress,2010,26(1):11-13.
[12] 张 毅,李 郁,魏建忠,等.猪圆环病毒2型疫苗免疫对母猪繁殖性能及仔猪母源抗体水平的影响[J].动物医学进展,2012,33(11):27-30.
[13] Darwich L,Segals J,Domingo M,et al.Changes in CD4+,CD8+,CD4-,CD8-and immunoglobulin M-positive peripheral blood mononuclear cells of post-weaning multisystemic wasting syndrome affected pigs and age-matched uninfected wasted and healthy pigs correlate with lesions and porcine circovirus type 2load in lymphoid tissues[J].Clin Diagn Lab Immunol,2002,9(2):236-242.
[14] 司兴奎,郭 鑫,杨汉春.猪圆环病毒2型对猪瘟疫苗体液免疫应答的影响[J].中国兽医学报,2009,29(7):826-829.
[15] 司兴奎,张济培,陈建红,等.猪圆环病毒2型感染对伪狂犬疫苗免疫应答的影响[J].中国预防兽医学报,2010,32(1):61-64.
Eradication Technology of Porcine Circovirus Diseases in Breeding Swine Herd
GUAN Liang1,HUA Yao1,SHI Lei1,LI Yu1,2,WEI Jian-zhong1,2
(1.College of Animal Science and Technology,Anhui Agricultural University,Hefei,Anhui,230036,China;2.Anhui Industrial Generic Technology Research Institute of Livestock and Poultry,Hefei,Anhui,230036,China)
Abstract:In order to explore the purification control measures of porcine circovirus in swine herd,inactivated vaccine of type 2porcine circovirus was used to immune boar for basic immunization twice and booster immunization 4month after basic immunization.ELISA method was used to detect the antibody of PCV-2,CSFV in time of before basic immunization,2 0days after the second immunization,3months after thebook=62,ebook=403second immunization and 3months after booster immunization.And PCR method was used to detect the DNA of PCV-2.PCV-2DNA positive swine was eliminated after booster immunization.The difference of the reproductive performance of the sow before and after PCV-2vaccine immunized.One year after the purification control measures carried out,the PCV-2 DNA positive rate was reduce from 33.33% to 3.42%.The PCV-2DNA positive rate of backup pig was reduce from 39.02%to 8.75%,the PCV-2DNA positive rate of boar was reduce from 33.33%to 0.00%and the PCV-2DNA positive rate of sows was reduce from 15.38%to 1.56%.The number born of sows increase by 0.52(P<0.05),the number of live born of sows increase by 0.78(P<0.01),and the number mummy born of sows decrease by 0.3 (P<0.01).There is a negative correlation between PCV-2nucleic acid detection rate and CSF immune antibody blocking rate,namely the breeding herd of swine fever antibody in qualified rate increased from 53.73%to 83.49%,and the average blocking rate increased from 43.31%to 63.46%.The results show that the effect of implementation of immunity,detection and elimination measures in the breeding herd for PCVDs purification was obvious.The scheme can laid foundation for large-scale pig farms to carry out PCVDs purification provides,which has value for popularization and application.
Key words:Porcine circovirus type 2;breeding swine;immune;eradication;classical swine fever antibody
作者简介:管 亮(1990-),女,安徽六安人,硕士研究生,主要从事动物传染病学研究。*通讯作者
基金项目:安徽省长三角联合攻关项目(1101c0603065);安徽省猪病检测工程技术研究中心基金项目(201106G01040);安徽省生猪产业体系基金项目
收稿日期:2015-01-05
中图分类号:S851.33
文献标识码:A
文章编号:1007-5038(2015)07-0057-06

