RDP多肽修饰的姜黄素隐形脂质体脑靶向作用的研究
项松涛,赵 明,史现勋,付爱玲
(西南大学药学院,重庆 400716)
RDP多肽修饰的姜黄素隐形脂质体脑靶向作用的研究
项松涛,赵 明,史现勋,付爱玲
(西南大学药学院,重庆 400716)
中国图书分类号:R-332;R282.71;R322.81;R742.05;R977.6
摘要:目的 以源于狂犬病毒糖蛋白的新型衍生肽(RVG-derived peptide,RDP)为靶向载体,研究其修饰的姜黄素隐形纳米脂质体的特征和脑靶向作用。方法 薄膜分散法制备出脂质体。体外释放实验考察释药情况。小鼠经尾静脉注射姜黄素混悬液(CUR)、姜黄素脂质体(CUR-L)、RDP修饰的姜黄素隐形脂质体(RDP-CUR-L),分别在不同时间点取小鼠组织器官,HPLC法检测姜黄素在各组织的分布。结果 制备的隐形纳米脂质体粒径在100 nm左右,分散性良好,包封率大于85%,制备重现性较好。小鼠经尾静脉分别注射CUR、CUR-L和RDP-CUR-L后,CUR组并未在脑中检测到姜黄素,CUR-L组仅在脑中检测到少量姜黄素,而RDP-CUR-L组小鼠脑内检测到了较高浓度的姜黄素。结论RDP能够引导脂质体入脑,这将为治疗脑部疾病提供新的方法。
关键词:姜黄素;RDP;脂质体;体内分布;细胞穿膜肽;脑靶向
网络出版时间:2015-7-22 10:42 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150727.0901.025.html
治疗脑内疾病的必要途径需将药物靶向性输送入脑内。以脑靶向性的蛋白或多肽作为载体,可能会实现药物的脑靶向转运。我们实验室以往的研究表明,狂犬病毒糖蛋白(rabies virus glycoprotein,RVG)的衍生肽RDP(RVG-derived peptide)[1],可携带核酸[2]、蛋白[3]等生物大分子入脑。
脂质体是一种安全有效的药物递送方式。脂溶性化合物可被包裹在脂质体内核中,在体内安全释出以发挥作用。此外,脂质体较易修饰,从而可使其具有靶向性和高效性。本研究将在脂质体表面的PEG链端连接RDP多肽,以具有抗肿瘤效果的天然植物提取物姜黄素为模型药物,研究该RDP修饰脂质体的脑靶向作用,从而可能为向脑内送脂溶性化合物以治疗脑部疾病,提供一种崭新的途径和方法。
1 材料与方法
1.1试剂 姜黄素,纯度>98%,购自美国Sigma公司;大豆卵磷脂、胆固醇,纯度>95%,均购自上海Aladdin公司;DSPE-PEG-NHS(PEG MW 2 000),购自美国Nanocs公司;Cys-RDP,纯度>95%,购自上海吉尔公司;乙酸乙酯、乙腈、冰醋酸均为色谱纯。
1.2仪器 高效液相色谱仪(包含SPD-M20A检测器和LC-20AD泵),购自日本岛津公司;激光粒度及zeta电位分析仪(Nano ZS),购自英国马尔文公司;生物质谱仪autoflex speed MALDI-TOF/TOF,购自德国Bruker Daltonic公司;AB135-S电子分析天平,购自瑞士梅特勒-托利多公司;BF-2000氮气吹干仪,购自上海八方世纪科技有限公司;XHF-D高速分散器,购自宁波新芝生物科技有限公司。
1.3细胞株及培养体系 人脑星形胶质母细胞瘤细胞U-87 MG(实验室冻存),采用含10%胎牛血清的DMEM-H培养基培养,置于37℃、5%CO2、饱和湿度下的培养箱内。隔天换液,待细胞密度长至80%~90%时,按照1∶3的比例传代。传代时,加入消化液一定时间后去除,用培养基吹打成单个细胞悬液,取生长良好、活性大于98%的细胞进行后续实验。
1.4实验动物 昆明小鼠80只,♀♂各半,体质量(20±2)g,购自于重庆滕鑫生物技术有限公司。小鼠饲养于西南大学药学院SPF小鼠饲养室,恒温、恒湿,自由进食、进水。
1.5脂质体的制备和表征
1.5.1导向化合物的合成 按照摩尔比2∶1的比例精密称取DSPE-PEG-NHS和RDP溶于DMF中,然后加入20 μL的N-甲基吗啉,置于4 mL离心管中,在搅拌器中避光搅拌48 h。取出反应液,置于透析袋(MW 3 500)中,放入2 L去离子水中透析48 h后(每6 h换水1次),冷冻干燥,-20℃保存。
1.5.2脂质体的制备 采用薄膜分散法分别制备姜黄素脂质体(CUR-L)和RDP修饰的姜黄素隐形脂质体(RDP-CUR-L)。按照处方量(Tab 1)精密称取各种脂材于10 mL茄形瓶中,加入氯仿3 mL溶解,37℃减压旋转蒸发10 min,使其成均匀的薄膜。然后加入1 mL去离子水,37℃于水浴摇床中水化1 h,形成悬浮液,间歇超声90 s,得到澄清透明呈淡黄色乳光的脂质体溶液,并分别过100 nm的膜使粒径分布均匀,4℃冰箱内保存。
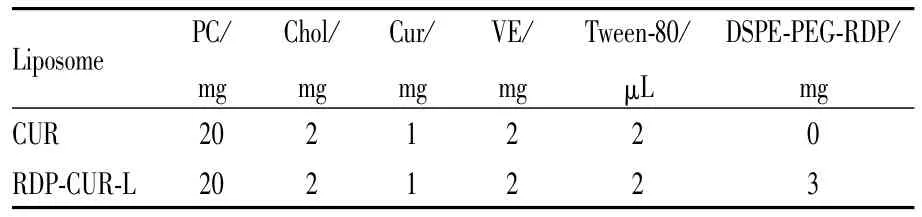
Tab 1 Formulations of CUR-L and RDP-CUR-L
1.5.3DSPE-PEG-RDP比例筛选 按上述脂质体制备方法制备一系列含不同比例DSPE-PEG-RDP的含药靶向脂质体(DSPE-PEG-RDP分别为总摩尔量的0.5%、1.0%、2.0%和5.0%)。采用MTT法考察不同密度下的RDP-CUR-L对U87 MG细胞抑制率的影响。取对数生长期状态良好的细胞,用0.25%胰酶消化液消化后,调整细胞浓度为5×107·L-1,以每孔500 μL(5 000个/孔)接种于96孔板,培养24 h贴壁后加入不同浓度的CUR-L和RDP-CUR-L,浓度依次为150、75、37.5、18.8、9.4、4.7 μmol·L-1,孵育48 h后,弃去培养基,每孔加入浓度为5 g·L-1的MTT(20 μL),37℃培养4 h,弃去培养液,每孔加入100 μL二甲基亚砜(DMSO)溶解蓝紫色甲颗粒,用酶标仪在波长为490 nm下测定光吸收值(OD)。每组实验重复3次,每个样品做3个平行样。全部实验均设DMSO对照组。计算药物抑制率和对肿瘤细胞的半数抑制浓度(IC50)。

1.5.4脂质体粒径、电位、分散度测定 用激光粒度及zeta电位分析仪分别测定CUR-L和RDP-CUR-L的粒径、Zeta电位、分散度(PDI)。
1.5.5脂质体包封率测定 采用透析破乳法,取用均质机处理过的CUR-L和RDP-CUR-L,每组实验分成两份(每份400 μL):一份用透析液透析6 h后,收集脂质体部分,以10%的Triton X-100破乳,经HPLC测定包裹在脂质体内的药物浓度C;另一份直接破乳,经HPLC测定姜黄素得到C0,按照公式计算出包封率(包封率=C/C0×100%)。
1.5.6脂质体稳定性考察 取制得的CUR-L和RDP-CUR-L,分成两个实验组,每组平行3次,分别于3、7、15、30、45、60 d后肉眼观察脂质体溶液变化,HPLC测包封率。
1.5.7体外释放度测定 采用动态透析法(dynam-ic dialysis)[4],按中国药典2010版附录XC第三法(小杯法)测定释放度。精密量取制剂CUR-L、RDP-CUR-L各0.5 mL,经释放介质稀释至3 mL,装于透析袋内(截留分子质量为8 000 u),两端扎牢,放入150 mL释放介质中,释放介质为含有0.2%十二烷基硫酸钠的人工胃液,37℃下姜黄素在此释放介质中的溶解度为80 mg·L-1,满足漏槽条件。37℃恒温水浴搅拌(转速为100 r·min-1)。分别于0.5、1、2、4、6、8、12、24 h各个时间点取样0.3 mL,并及时补充等温的相同体积空白介质。微孔滤膜过滤,按照HPLC方法检测姜黄素含量,并计算累积释药百分率(%)。
1.6姜黄素悬浮液和脂质体的体内分布
1.6.1色谱条件 C18色谱柱(250 mm×4.6 mm,5 μm,大连依利特分析仪器公司);流动相:乙腈∶4%冰醋酸(48∶52),流速:1 mL·min-1,检测波长:430 nm,柱温:25℃。
1.6.2样品预处理 将姜黄素溶解于1%羧甲基纤维素钠中,配制成浓度为1 g·L-1的CUR混悬液,制得的CUR-L和RDP-CUR-L浓度均为1 g· L-1,CUR、CUR-L、RDP-CUR-L均按照姜黄素30 mg ·kg-1的剂量于小鼠尾静脉注射给药。
取昆明小鼠,禁食12 h,尾静脉分别注射CUR、CUR-L、RDP-CUR-L,于0.25、0.5、1、2、4、6、8、12 h各个时间点分别取小鼠心、肝、脾、肺、肾、脑(每个时间点3只),用生理盐水清洗后用滤纸吸干,剪碎,精密称重,加入1mL生理盐水,用组织匀浆器匀浆,加入1 mL乙酸乙酯,涡旋3 min,3 000 r·min-1离心10 min,精密吸取上清液,再加入相同体积的乙酸乙酯,萃取2次,合并上清液,氮气吹干,加入10倍体积的流动相,超声、涡旋使其充分溶解,过膜后进样。
1.6.3方法学考察 专属性:取小鼠心、肝、脾、肺、肾、脑各空白组织匀浆液0.3 mL,样品处理后采用HPLC法分别进样测定空白样品、空白样品加内标及小鼠尾静脉注射给药后的样品。
标准曲线:取小鼠空白组织匀浆液,精密加入姜黄素标准溶液,配制成1.6、3.1、6.2、12.5、25、50 mg·L-1系列浓度的样品溶液,样品处理后,以姜黄素的峰面积与样品中姜黄素的浓度(C)进行线性回归。
回收率与精密度:配制低、中、高浓度(3、12.5、50 mg·L-1)的姜黄素质控样品,各5份,按“样品处理”项下方法处理,进样测定。以姜黄素的峰面积代入标准曲线方程,计算出姜黄素的浓度,与实际加入量比较,计算方法回收率,用以表示准确度;以相应低、中、高浓度的姜黄素对照品溶液直接进样,以质控样品中姜黄素峰面积与对照品溶液中姜黄素峰面积比较,计算提取回收率;1 d内进样测定5次,连续测定5 d,计算日内RSD和日间RSD。
2 结果
2.1脂质体的制备和表征
2.1.1导向化合物的合成 生物质谱分析反应产物DSPE-PEG-RDP的结果如Fig 1所示。RDP相对分子质量为3 671,DSPE-PEG-NHS分子质量为3 094,得到的产物DSPE-PEG-RDP相对分子质量约为6 800,说明导向化合物制备成功。
2.1.2脂质体的粒径、zeta电位、分散度及包封率
CUR-L和RDP-CUR-L粒径、zeta电位、分散度和包封率如Tab 2所示。结果表明,CUR-L粒径为(81.20±5.13)nm,而RDP-CUR-L经RDP修饰过后粒径为(98.56±6.97)nm,分散性良好,包封率均大于85%,制备重现性较好。
Tab 2 Characteristics of liposome formulations(±s,n=3)

Tab 2 Characteristics of liposome formulations(±s,n=3)
Liposome Size/nm Zeta potential/mV PDI Entrapment efficiency/% CUR-L 81.20±5.13 -4.77±0.96 0.21±0.024 87.68±3.71 RDP-CUR-L 98.56±6.97 -3.94±0.47 0.27±0.02186.31±2.83

Fig 1 MALDI-TOF-MS spectrometry of DSPE-PEG-RDP with a peak at the m/z range around 6 800
2.1.3脂质体稳定性 CUR-L和RDP-CUR-L 4℃冰箱放置60 d后,溶液依旧澄清透明,呈淡黄色乳光,与新制备时相比无明显变化。不同时间点测其包封率,可以看出RDP修饰对姜黄素脂质体包封率影响不大,60 d后CUR-L和RDP-CUR-L的包封率仍然在80%左右,可见稳定性良好。见Fig 2。
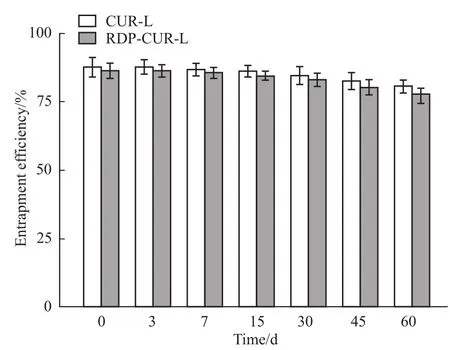
Fig 2 Entrapment efficiency of RDP-CUR-L at different time points(±s,n=3)
2.1.4导向化合物DSPE-PEG-RDP比例筛选 结果如Fig 3所示,当加入的DSPE-PEG-RDP为总摩尔量的1.0%时,RDP-CUR-L对U87细胞的抑制作用明显优于CUR-L(P<0.01)。随着DSPE-PEG-RDP比例的增加,U87细胞的存活率逐渐降低,这表明在脂质体的PEG链端连接RDP能增强对U87细胞的抑制作用,当加入比例达5.0%时,RDP-CUR-L对U87细胞的抑制作用最强,与0.5%时相比差异有显著性(P<0.05)。当比例超过1%时,RDP-CUR-L对U87细胞的抑制变化不明显,表明继续增加DSPE-PEG-RDP的量并不能提高RDP-CUR-L对U87细胞的抑制率。密度筛选实验结果表明,DSPE-PEG-RDP的加入比例能影响脂质体的靶向效率。出于实验效果和经济性考虑,选取加入比例为1.0%进行以下的实验。

Fig 3 Cell inhibition rate of CUR-L and different density of peptide RDP modified liposomes against U87 cells(n=3)
2.1.5体外药物释放 由于姜黄素在水中几乎不溶解,采用加入2%十二烷基硫酸钠(SDS)的人工胃液为释放介质,考察姜黄素制剂的释药情况。结果如Fig 4所示,CUR-L在前6 h内大量释放,累计释放量接近60%,而后进入慢速释放期,12 h释放量约为80%,而RDP-CUR-L释放在该释放介质中较慢,6 h后释放约45%,24 h后累积释放量不到80%,表明RDP-CUR-L有着更好的缓释作用。

Fig 4 In vitro release profiles in 2%SDS artificial gastric juice for CUR-L and DP-CUR-L(n=3)
2.2姜黄素悬浮液和脂质体的体内分布
2.2.1方法学考察 在上述色谱条件下,方法专属性良好,峰形良好,保留时间约为14 min,组织中的内源性物质不干扰样品测定,见Fig 5。样品中的姜黄素在1.562 5~50 mg·L-1线性关系良好(r=0.999 4)。方法回收率为(95.87±4.98)%,高、中、低3个浓度的提取回收率分别为(94.79±1.94)%、(95.26±2.87)%和(95.18±1.78)%(n=5),日内精密度和日间精密度小于15%,均符合生物样品分析方法的要求。

Fig 5 HPLC chromatogram of three tissue samples
2.2.2体内分布和脑靶向作用考察 小鼠尾静脉注射CUR、CUR-L、RDP-CUR-L后不同时间各组织中的姜黄素分布见Fig 6。注射CUR后,随着时间的推移,姜黄素在各个脏器中含量逐渐减少,姜黄素大量分布在肺、肝、肾等脏器中,心、脾中也有少量分布,然而由于血脑屏障的作用,脑部并未检测到姜黄素。注射CUR-L后,由于易被网状内皮系统吞噬,姜黄素主要分布在肝、肾、肺中,在脑、脾中少量分布,而在心脏中没有检测到姜黄素。RDP-CUR-L经尾静脉给药后大致分布与CUR-L类似,但在脑中检测到大量的姜黄素,并且在小鼠体内的滞留时间明显延长,24 h仍然能在脑中检测到姜黄素(Fig 7)。
3 讨论
脂质体作为药物载体具有使药物被动靶向网状内皮系统、延长药物作用时间、减少药物不良反应、提高疗效等优点[5]。表面经柔性高分子PEG修饰,增大了脂质体的空间位阻,同时提高了膜表面亲水性,使得其不易被网状内皮系统(reticular epithelial system,RES)摄取,因而PEG化的脂质体较普通脂质体更长效。
虽然脂质体经PEG修饰后能够延长在体内的循环时间,增加在肿瘤组织中的聚集,但是由于“PEG dilemma”现象的存在[6],阻碍了肿瘤细胞对脂质体的内吞,故在脂质体的PEG链端连接靶向配体如叶酸、转铁蛋白、抗-EGFR抗体等[7-10],使得靶向配体与肿瘤细胞过度表达的受体特异性结合,通过“配体-受体”特异性识别与结合作用,能够促进细胞对载体的吞,增加药物的抗肿瘤效果,并且可以定向地将药物运送到靶部位,实现对肿瘤组织的“主动靶向”。

Fig 6 Tissue concentration of curcumin in mice after iv injection of CUR,CUR-L or RDP-CUR-L at different time points(n=3)
脂质体或者纳米粒子表面修饰特异性配体或受体,主动靶向特定肿瘤组织的文献已有大量报道。一些常见的细胞穿膜肽,如TAT、多聚Arg、转运素,已被证实能够在体外将核酸、蛋白等小分子物质转导入培养的细胞[11]。Khafagy等[12]研究发现,L-型穿膜肽penetratin可以明显增加胰岛素的渗透性,从而使其穿过鼻膜,并不会对鼻吸收黏膜上的细胞完整性造成明显的破坏。据文献报道,另一个从狂犬病毒糖蛋白衍生出的一个小肽与多聚Arg连接后,能够输送siRNA靶向性地进入中枢神经系统,导致相关基因沉默[13]。KaiPharmaceutical公司应用Tat引导蛋白激酶C抑制剂的蛋白调节子,用于脑缺血和急性心肌缺血的治疗,并且已于2007年进入了Ⅱ期临床试验。

Fig 7 Curcumin distribution in brain of mice after iv injected with CUR-L and RDP-CUR-L at different time points(n=3)
然而,用细胞穿膜肽引导脂质体等纳米载体进入特定的组织,特别是脑组织的文献却并不多见。普通CPPs虽然能介导各类分子入胞,但是其缺乏细胞特异性,而本实验中所用的细胞穿膜肽RDP是一种来源于狂犬病毒糖蛋白RVG,并经过结构改造而得到的一种能靶向中枢神经系统、具有很强嗜神经性的衍生肽,同时具有良好的穿膜特性和对神经细胞的高度选择性。实验室前期研究已表明RDP能够引导核酸、多肽等小分子物质入脑,而本实验中通过体内分布实验证明了RDP连接的姜黄素脂质体在体内运输过程中没有发生断裂,确实能够携带包裹了姜黄素的脂质体入脑,不仅仅拥有理论意义,也具有潜在的应用价值。这为脑部疾病的治疗提供了新的思路。
(致谢:本实验是在西南大学药学院智能生物药物课题组全体老师和同学的帮助和支持下完成的。)
参考文献:
[1] Fu A L,Zhao Z Z,Gao F Y,et al.Cellular uptake mechanism and therapeutic utility of a novel peptide in targeted-delivery of proteins into neuronal cells[J].Pharm Res,2013,30(8):2108 -17.
[2] 高飞燕,张苗苗,徐兴然,等.穿膜肽引导核酸靶向性进入神经细胞的研究[J].中国药理学通报,2014,30(3):30-4.
[2] Gao F Y,Zhang M M,Xu X R,et al.On a cell-penetrating peptide mediated targeted-delivery of DNA into neuronal cell[J].Chin Pharm Bull,2014,30(3):30-4.
[3] 张苗苗,张恩齐,高飞燕,等.双功能融合蛋白RDP-BDNF的制备及其对东莨菪碱所致认知功能障碍小鼠的作用[J].中国药理学通报,2014,30(11):1569-74.
[3] Zhang M M,Zhang E Q,Gao F F,et al.Effect of bifunctional RDP-BDNF fusion protein on ability of learning and memory of cognitive dysfunction mice induced by scopolamine[J].Chin Pharmacol Bull,2014,30(11):1569-74.
[4] Chen Y,Lu Y,Chen J,et al.Enhanced bioavailability of the poorly water-soluble drug fenofibrate by using liposomes containing a bile salt[J].Int J Pharm,2009,376(1):153-60.
[5] Shiraishi K,Hamano M,Ma H,et al.Hydrophobic blocks of PEG-conjugates play a significant role in the accelerated blood clearance(ABC)phenomenon[J].J Control Release,2013,165 (3):183-90.
[6] Hatakeyama H,Akita H,Harashima H.A multifunctional enve-lope type nano device(MEND)for gene delivery to tumours based on the EPR effect:a strategy for overcoming the PEG dilemma [J].Adv Drug Deliv Rev,2011,63(3):152-60.
[7] Meisner D,Mezei M.Liposome ocular delivery systems[J].Adv Drug Deliv Rev,1995,16(1):75-93.
[8] 李春霞,周元丽,孟凡胜.靶向制剂研究进展[J].齐鲁药事,2012,31(7):423-5.
[8] Li C X,Zhou Y L,Meng F S.Research progress on targeting drug delivery system[J].Qilu Pharm Aff,2012,31(7):423-5.
[9] Kim I Y,Kang Y S,Lee D S,et al.Antitumor activity of EGFR targeted pH-sensitive immunoliposomes encapsulating gemcitabine in A549 xenograft nude mice[J].J Control Release,2009,140 (1):55-60.
[10]Gao J,Yu Y,Zhang Y,et al.EGFR-specific PEGylated immuno-liposomes for active siRNA delivery in hepatocellular carcinoma [J].Biomaterials,2012,33(1):270-82.
[11]Zhou X,Wang C,Feng S,et al.Transactivating-transduction pro-tein-polyethylene glycol modified liposomes traverse the blood-spi-nal cord and blood-brain barriers[J].Neural Regen Res,2012,7 (35):2784-92.
[12]Khafagy E S,Morishita M,Isowa K,et al.Effect of cell penetrat-ing peptides on the nasal absorption of insulin[J].Control Re-lease,2009,133(2):103-8.
[13]Alvarez-Erviti L,Seow Y,Yin H,et al.Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes[J].Nat Biotechnol,2011,29(4):341-5.
Brain targeting effect of PEGylated liposomes modified with RDP peptide
XIANG Song-tao,ZHAO Ming,SHI Xian-xun,FU Ai-ling
(College of Pharmaceutical Sciences,Southwest University,Chongqing 400716,China)
Abstract:Aim Targeted drug delivery in the brain is the necessary way for the treatment of brain diseases.In our study,a new peptide derived from the rabies vi-rus glycoprotein(RVG-derived peptide,RDP)was used as a targeted carrier to modify the curcumin stealth liposomes,and their characteristics and brain targeting effect were studied.Methods The curcumin liposomes were prepared by thin film dispersion.The release test in vitro was conducted to investigate their drug release.Curcumin distribution in several organs of mice was investigated by caudal vein injection of curcumin suspension liquid(CUR),curcumin lipo-somes(CUR-L),RDP modified curcumin stealth lipo-somes(RDP-CUR-L)via HPLC assay at different time points.Results The prepared stealth nano liposomes had a size of around 100 nm,and also had a good dis-persion and reproducibility.The entrapment efficiency was larger than 85%.After caudal vein injection of CUR,CUR-L and RDP-CUR-L in mice respectively,no curcumin was detected in brain of CUR group,and only a little was detected in CUR-L group.Neverthe-less,high concentration of curcumin was detected in RDP-CUR-L group.Conclusion RDP can deliver li-posome into the brain,which may provide a new meth-od for the treatment of brain diseases.
Key words:curcumin;RDP;liposomes;biodistribu-tion;cell-penetrating peptides;brain targeting
作者简介:项松涛(1988-),男,硕士生,研究方向:神经系统靶向药物输送,E-mail:singsong1988@126.com;付爱玲(1973-),女,博士,教授,研究方向:神经药理学、生物化学和分子生物学,通讯作者,Tel/Fax:023-682-51225,E-mail:fuailing1008@hotmail.com
基金项目:国家自然科学基金资助项目(No 81273416);教育部高校基本科研业务费(No XDJK2013A030);教育部回国人员启动基金[教外司留(2012)940号];教育部新世纪优秀人才支持计划资助
收稿日期:2015-03-30,修回日期:2015-05-06
文献标志码:A
文章编号:1001-1978(2015)08-1136-06
doi:10.3969/j.issn.1001-1978.2015.08.022