11碳-蛋氨酸与18氟-脱氧葡萄糖在脑良性病变及低级别胶质瘤诊断中的比较
王欣璐, 韩立新, 尹吉林, 王 成, 姜丽莎, 谭思婷, 王伟民
(广州军区广州总医院1.核医学科PET/CT中心;2.磁共振室;3.神经医学专科医院,广东广州510010)
11碳-蛋氨酸与18氟-脱氧葡萄糖在脑良性病变及低级别胶质瘤诊断中的比较
王欣璐1, 韩立新2, 尹吉林1, 王 成1, 姜丽莎1, 谭思婷1, 王伟民3
(广州军区广州总医院1.核医学科PET/CT中心;2.磁共振室;3.神经医学专科医院,广东广州510010)
目的:鉴于11碳-蛋氨酸(11C-Methionine,MET)在良性病变和在低级别胶质瘤鉴别诊断价值的研究尚少,本研究目的是筛选出术前用11C-MET和18氟-脱氧葡萄糖(18F-FDG)两种显像剂进行脑正电子断层显像(PET/CT)成像对良性和低级别胶质瘤(共22例)进行回顾性研究,评价两种显像剂分别对上述两种病变的显示能力,病变边界勾画情况以及鉴别诊断价值,为11C-蛋氨酸在脑内良恶性病变的诊断提供依据.方法:本研究包括脑内占位病变22例(其中良性病变5例,新发低级别胶质瘤WHO I级和II级共17例).每例外科手术或活检前均行18F-FDG和11C-MET PET扫描(两次扫描间隔时间在1周以内),根据病灶及正常对照区(大脑对侧相应正常区域)勾画出的感兴趣区(region of interest,ROI)进行标准摄取值(Standard uptake value,SUV)平均值测量,计算良性及低级别胶质瘤的肿瘤/非瘤比(tumor/normal brain uptake ratio,T/NT比值)的平均值及标准差.对比两种显像剂在上述两组病变中T/N比值的差别并进行统计学分析.结果:(1)11C-MET在良性病变和低级别胶质瘤中的T/NT比值分别是1.59±0.28和1.52±0.48,组间差别无统计学意义(P>0.05);18F-FDG在良性病变和低级别胶质瘤中的T/NT比值分别是0.91±0.48和0.77±0.65,组间差别无统计学意义(P>0.05).(2)在本组所有22例病变中,11C-MET显示病变呈高代谢者19例,18F-FDG显示病变呈低代谢者17例.(3)11C-MET所示病灶边界清晰者17例,18F-FDG对病灶边界显示清晰者仅2例.(4)17例病灶显示清晰的患者11C-MET显示病变范围均大于18F-FDG.结论:虽然11CMET和18F-FDG两种显像剂均无法将良性病变与低级别胶质瘤区分开,但11C-MET对病灶侵犯范围及边界的显示均明显优于18F-FDG FDG,11C-MET还可检测和随访低级别胶质瘤(即惰性肿瘤)的生长情况,可为临床提供更多诊断、预后及治疗信息,因此,11C-MET可常规应用于脑内占位病变的显示,且其效果优于18F-FDG.
脑肿瘤;11碳-蛋氨酸;18氟-脱氧葡萄糖; 正电子断层显像
胶质瘤术前准确诊断和分级对其治疗策略的选择至关重要.近年来对18F-FDG正电子断层显像(Positron Emission Tomography,PET)在原发脑胶质瘤诊断和分级中的作用进行了多项研究[1-2],认为18F-FDG在高级别胶质瘤比低级别胶质瘤有更高的放射性摄取,对低级别胶质瘤来说,18F-FDG在正常大脑皮层的高摄取大大影响了病变的显示和肿瘤边界的勾画.而11碳-蛋氨酸(11C-MET)克服了18氟-脱氧葡萄糖(18F-FDG)脑显像高背景的缺点,其具有在正常大脑皮层低摄取的优势,因此,近年来11C-MET在脑胶质瘤诊断和分级的研究日益增多.至今大多数的研究仅局限于低级和高级别胶质瘤(High Grade Glioma,HGG)两者间的对比研究中,而对良性病变与低级别胶质瘤(Low Grade Glioma,LGG)在11C-MET和18F-FDG中的对比较少见到报道.本研究收集了从2009年8月至2013年10月期间208例曾行11C-MET检查的颅内占位病变(术前和术后)患者中,筛选出经本院手术病理证实的22例患者(5例良性病变和17例LGG)且进行了11CMET和18F-FDG显像的资料,旨在对两种显像剂分别对良性病变及低级别胶质瘤病变显示能力进行评估,分析图像中病变边界勾画情况,总结两种显像剂对良性及LGG的鉴别诊断能力,为11C-蛋氨酸在脑内良、恶性病变的临床诊断中的应用提供依据.
1 材料和方法
1.1 临床资料
本组研究对象均为新发的脑内占位病变,MR显示病变不清晰,或者边界模糊,导致临床医生难于决定是手术切除、活检还是采取长期随访观察,临床医生希望通过PET检查,获得更多有关病变的信息以帮助临床进行决策.本组研究对象共22例,其中男16例,女6例;年龄介于5~58岁之间,中位年龄34.5岁.所有病例均经手术治疗,术后病例结果分别为:炎性细胞3例,脱髓鞘假瘤2例,低级别胶质瘤17例(其中胚胎发育不良性神经上皮肿瘤3例,少突胶质细胞瘤WHO I级1例,星形细胞瘤WHO I级2例,节细胞瘤WHO I级1例,弥漫星形细胞瘤WHO I级1例,星形细胞瘤WHO II级2例,少突胶质细胞瘤WHO II级1例,胶质细胞瘤WHO II级6例).
1.2 18F-FDG PET/CT显像方法
(1)扫描仪 采用Siemens公司(德国)生产的Biograph 16 HR PET-CT扫描仪,其中CT部分为16排螺旋CT.
(2)显像剂18F-FDG由Siemens CTI RDSeclips公司(德国)的回旋加速器生产并通过自动合成模块自动合成,放化纯度大于95%.11C-MET由北京派特生物技术有限公司生产的11C-碘代甲烷和11C-蛋氨酸合成模块进行合成,放化纯度大于95%.
(3)显像方法18F-FDG扫描方法 患者空腹6 h以上,注射显像剂前平静休息10~15 min,平静状态下通过静脉注射显像剂18F-FDG 7.4 MBq/kg之后在暗室静息状态下平卧50~60 min后行数据采集.一周内安排11C-MET检查,扫描方法 患者空腹4 h以上,静脉注射显像剂11C-MET 14.8 MBq/kg,10~15 min后行数据采集.显像包括C T扫描和PET发射扫描,扫描范围为头部(一个床位6 min).CT扫描条件为管电压120 kv.所有图像重建采用有序子集最大期望值迭代法(OSM法).图像融合通过将PET和CT图像传送到工作站进行图像对位融合.所有图像由PET/CT中心的3名或3名以上的医师(具有3年以上PET/CT诊断经验同时具有8至10年的CT诊断经验)共同阅片.
1.3 数据测量和分析
数据测量使用Siemens公司提供的软件包,测量病灶最大及最小直径,勾画病灶边缘作为感兴趣区(ROI),测量ROI内病灶的标准摄取值(SUV)平均值,并取病灶对称相应部位测定SUV平均值,并计算良性及低级别胶质瘤/非瘤的比值(T/NT)比值的平均值及标准差.对比两种显像剂在良性和低级别胶质瘤中T/N比值的差别并进行统计学分析.
2 结果
(1)11C-MET在良性病变和低级别胶质瘤中的T/N比值 分别是1.59±0.28和1.52±0.48,组间差别无统计学意义(P>0.05);18F-FDG在良性病变和低级别胶质瘤中的T/N比值分别是0.91±0.48和0.77±0.65,组间差别无统计学意义(P>0.05).
(2)代谢情况 本组所有22例病变中,11CMET显示病变绝大多数(19/22例)呈高摄取灶(其中15例显示边界清晰),等代谢者2/22例(少突胶质细胞瘤WHOI级和星形细胞瘤WHOII级),低代谢者1/22例(胚胎发育不良性神经上皮性肿瘤WHOI级).18F-FDG在上述两组病变中绝大多数(19/22例)呈低代谢病灶;18F-FDG还有2/22例呈高代谢病灶(炎症和少突胶质细胞瘤WHO II级);1/22例显示为等代谢(炎症).
(3)显示病灶边界11C-MET所示病灶边界清晰者17/20例,18F-FDG对病灶边界显示清晰者仅2/21例.
(4)显示病灶范围大小 如上所述,18F-FDG仅两例病灶显示清晰,而11C-MET所示病灶17例均显示病变边界清晰,而且11C-MET显示病变范围均大于18F-FDG所显示病变范围.
3 讨论
常规影像学检查中MRI在中枢神经系统中的应用最广泛,也是效果最满意的影像学检查手段,它已成为在临床上不可或缺的检查方法.但是MRI对LGG却显示不佳,多数情况下即使进行MRIGd增强扫描也无法清晰显示病变强化区域,更无法勾勒出病变的边界;在与炎症等良性病变的鉴别诊断中也难于做出诊断.18F-FDG是当今临床上最广泛地用于恶性肿瘤诊断的正电子放射性药物,同时它也是最早且最广泛地应用在脑胶质瘤PET诊断中的.大量的研究表明[2],根据脑胶质瘤对18F-FDG摄取的高低有助于对肿瘤恶性程度和对预后进行评估.而且,FDG-PET还可以对肿瘤分级、化疗后反应以及术后复发情况提供有用的信息.但是FDG在脑显像中有一个最大的缺点,即正常大脑皮层对FDG高摄取会不同程度地影响或掩盖同样也是高代谢的脑胶质瘤.这个缺点在氨基酸类代谢显像剂中得到了改善,以11C-MET显像为代表的氨基酸类正电子示踪剂,在显像时正常大脑呈低摄取的背景,可以很好地衬托出11C-MET高摄取的脑胶质瘤等肿瘤病变,使其边界得到更好地显示.MET在组织中的浓聚程度反映出细胞内蛋白质合成的需求水平,MET-PET成像中脑肿瘤组织内的蛋白质代谢程度远远高于周围正常的脑组织.因此,在检测脑肿瘤及其边界方面,它具有高敏感性和高特异性.迄今为止,在11CMET能否根据其代谢程度对高、低级别胶质瘤进行鉴别诊断的结论仍不统一.虽然有个别学者[3]的研究结果显示,高、低级别胶质瘤对11C-MET的摄取没有差异,但是大部分学者[4-7]均认为11C-MET在高级别胶质瘤中的摄取明显高于低级别胶质瘤.最近10年,11C-MET PET的临床研究大多数集中于LGG和HGG之间的对比研究,表明高级别胶质瘤对MET的摄取较高,成像效果比较好,但是对良性和LGG病变是否也有好的显示呢?能否将良性病变与LGG有效地区别开呢?
本研究收集了6例颅内良性病变和17例LGG进行图像对比研究发现,虽然11C-MET和18F-FDG在良性和LGG的鉴别诊断方面均无法提供帮助.但是在病变显示上,两种显像剂还是有很大差异的,11C-MET在上述两组病变中绝大多数呈(19/22)高摄取灶(其中15例显示边界清晰).同时,18F-FDG在上述两组病变中绝大多数(17/22)呈低代谢病灶,其中除了1例边界清晰之外,其余16例均边界模糊不清.综上所述,本组研究表明无论是良性还是LGG病灶,从代谢程度和病灶能否被清晰显示方面来看,11C-MET远优于18F-FDG.另外,本组还根据两组病变在不同显像剂下所显示病灶的范围进行了对比研究,所有15例11C-MET显示病变边界清晰者,其所示的病灶范围均大于18F-FDG所示的病变范围,这个结论与文献报道相一致.1998 Sasaki[8]对23例脑胶质瘤患者行201TISPECT、11C-MET和18F-FDG显像并对比分析表明,11C-MET显示的肿瘤范围最大.众所周知MRI和CT检查对肿瘤侵犯的边缘和脑水肿的边界较难区分.一些研究证实[9-10],CT或MRI显示为水肿的部分而11C-MET却呈高摄取的区域,最后经病理证实为肿瘤侵润.因此,11C-MET被认为是对肿瘤范围显示最准确的方法.
本研究中18F-FDG所显示的病灶范围大多数情况下都小于11C-MET所示的病灶范围,主要原因有:(1)本组病例的病理类型为良性和LGG,因此大多数病灶代谢均低于正常大脑皮层,对于那些肿瘤代谢仅仅轻度增高的病灶,肉眼更难于察觉到,而且由于容积效应使周边正常高代谢的大脑皮层对低代谢的病灶边缘有一定程度地掩盖,使得其边界模糊,且范围小于实际肿瘤浸润的范围(见图1).(2)由于胶质瘤生长的异质性,在胶质瘤内部恶性程度高的那一部分瘤组织(往往位于瘤中央)18F-FDG呈高摄取,而恶性程度较低的大部分(瘤周边)18F-FDG摄取较低而不显示,因此,如果根据18F-FDG所示高代谢部分作为肿瘤边界进行勾画,大部分瘤体会位于勾画范围之外(见图2).
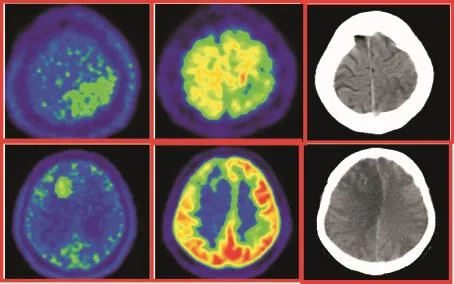
图1 左顶叶炎症(上行),右额叶星形细胞瘤WHOⅡ级(下行).Fig.1 The inflammation of left parietal lobe(upper row)and the glioma(gradeⅡ)in right frontal lobe(below row).
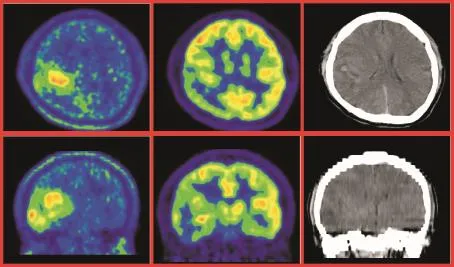
图2 右侧颞叶脑胶质瘤(Ⅱ~Ⅲ级)Fig.2 Glioma(gradeⅡ~Ⅲ)in right temple lobe
临床上对生长缓慢的胶质瘤(如WHOI级)往往采取定期观察的方法,避免手术等治疗手段对大脑功能区产生不必要的损害,以往定期观察的方法是MRI随访,本组病例对1例LGG用MET-PET进行了为期7个月的随访观察,MET-PET明确显示出肿瘤体积较前明显增大,而且瘤内不同部位对MET摄取出现异质性,有的部位较前明显增高(如图3).经手术证实,经过7个月后肿瘤级别增高到WHOⅡ级.本研究提示,可将MET-PET用于对一些进展缓慢的病例定期随访观察,通过观察和对比病灶内11C-MET代谢的变化情况,较早地预期病灶可能的进展,以便及早作出治疗决策上的调整.
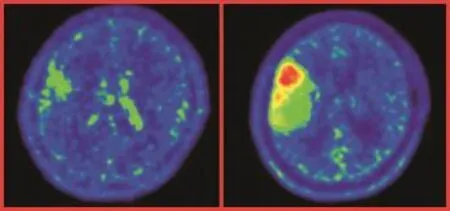
图3 右颞叶脑胶质瘤(Ⅱ级)生长随访观察.左图为第一次11C-MET PET检查,右图为7个月后复查.Fig.3 The second11C-MET PET scan of glioma(gradeⅡ)in right temple lobe
本研究有一定的局限性:(1)11C-MET在临床应用上局限性主要是由于11C的半衰期时间较短(大约20 min),因此,对患者的显像也受到加速器地理位置的限制.而且在硬件上需要购买11C正电子合成模块,技术人员要熟练掌握相应的11C示踪剂合成技术,以满足临床需要.这也是近年来,虽然有大量的国内外文献报道11C-MET在脑胶质瘤中成像效果满意,但是大部分医院却无法将其广泛应用于临床的根本原因.(2)本研究仅仅观察和对比了两种正电子显像剂(11C-MET和18F-FDG)的PET成像情况,但是因为技术能力的原因,无法同期将同一位患者的MRI解剖图像与PET图像进行融合研究是比较遗憾的.本研究小组将会在影像学融合软件的支持下,将PET功能成像与MRI解剖成像相融合,并应用数字影像学技术进行三维显示,以期在术前为临床提供更多的肿瘤形态、分级、边界和预后等方面的信息.
[1] PADMA M V,SAID S,JACOBS M,et al.Prediction of pathology and survival by FDG PET in gliomas.J Neurooncol,2003,64(3):227-237.
[2] GLAUDEMANSAW,ENTING R H,HEESTERSM A,et al.Value of 11C-methionine PET in imaging brain tumours and metastases[J].Eur JNucl Med Mol Imaging,2013,40(4):615-635.
[3] GALLDIKS N,KRACHT L W,BERTHOLD F,et al.[11C]-L-methionine positron emission tomography in the management of children and young adults with brain tumors[J].J Neurooncol,2010,96(2):231-239.
[4] SHINOZAKI N,UCHINO Y,YOSHIKAWA K,et al.Discrimination between low-grade oligodendrogliomas and diffuse astrocytoma with the aid of 11C-methionine positron emission tomography[J].J Neurosurg,2011,114(6):1640-1647.
[5] NARIAIT,TANAKA Y,WAKIMOTO H,et al.Usefulness of L-[methyl-11C]methionine-positron emission tomography as a biological monitoring tool in the treatment of glioma[J].J Neurosurg,2005,103(3):498-507.
[6] SADEGHIN,SALMON I,DECAESTECKER C,et al.Stereotactic comparison among cerebral blood volume,methionine uptake,and histopathology in brain glioma[J].AJNR Am J Neuroradiol,2007,28(3):455-461.
[7] SINGHAL T,NARAYANAN T K,JACOBSM P,et al.11C-methionine PET for grading and prognostication in gliomas:a comparison study with 18F-FDGPET and contrast enhancement on MRI[J].JNucl Med,2012,53(11):1709-1715.
[8] SASAKIM,KUWABARA Y,YOSHIDA T,et al.A comparative study of thallium-201 SPET,carbon-11 methionine PET and fluorine-18 fluorodeoxyglucose PET for the differentiation of astrocytic tumours[J].Eur JNucl Med,1998,25(9):1261-1269.
[9] MOSSKIN M,ERICSON K,HINDMARSH T,et al.Positron emission tomography compared with magnetic resonance imaging and computed tomography in supratentorial gliomas using multiple stereotactic biopsies as reference[J].Acta Radiol,1989,30(3):225-232.
[10]TYLER JL,DIKSIC M,VILLEMURE JG,et al.Metabolic and hemodynamic evaluation of gliomas using positron emission tomography[J].J Nucl Med,1987,28(7):1123-1133.
[责任编辑:陈咏梅]
A comparative study of carbon-11 methionine PET and Fluorine-18 fluorodeoxyglucose PET for the differentiation of benign lesion and low grade glioma
WANG Xinlu1, HAN Lixin2, YIN Jilin1, WANG Cheng1, JIANG Lisha1,TAN Siting1, WANG Weimin3
(1.Department of Nuclear PET/CT Center,2.Department of MRI,3.Department of Neurology and Neurosurgery,Genenral Hospital of PLA Guangzhou Military Command Guangzhou 510010,China)
Aim:As the study of Carbon-11 methionine(MET)and fluorine-18 fluorodeoxyglucose(FDG)in differentiating brain benign and low grade glioma was seldom.The aim of this study was to determine the effect of these two tracers for distinguishing two groups of patients and evaluating the extent of lesions.M ethods:Both carbon-11 MET and fluorine-18 FDG have been used to evaluate brain benign and low grade glioma(LGG).MET positron emission tomography(PET)and FDG PET were all performed in 22 patients(5 brain benign lesions,17 low grade glioma WHO grade Iand II)within one week for a single patient,Both MET and FDG uptake of the lesions were evaluated by a semiquantitative analysis using the standardized uptake value.The Tumor/normal brain uptake ratio(T/N ratio)were calculated in two groups of patients.Results:MET uptake was not significantly different among these two groups(benign:1.59±0.28 and LGG:1.52±0.48).Similarily,FDG uptake was not significantly different among the two groups(benign:0.91±0.48 and 0.77±0.65)also.No significantly correlation was observed between MET uptake and FDG uptake.19/22 hypermetabolization of patients were found in MET PET and 17/22 hypometabolization of patients were found in FDG PET.The extents of increased MET uptake in 17 cases were larger than that of the increased FDG uptake.Conclusion:It is found that both MET and FDG are not useful for distinguishing with benign and LGG.MET was found to be highly useful for detecting benign and LGG,and for evaluating the extent of these lesions which were blurred in FDG PET.MET was also useful for monitoring the growth of LGG.In a word,MET was considered as routine examination for brain lesions.
brain tumours; carbon-11 methionine; fluorine-18 fluorodeoxyglucose; positron emission tomography
R739.42
A
1000-9965(2015)03-0261-05
10.11778/j.jdxb.2015.03.013
2014-11-03
国家自然科学基金项目(30973414);广东省自然科学基金项目(1015100100200016)
王欣璐(1971-),副主任医师、博士,研究方向:肿瘤的PET/CT诊断
王伟民,男,主任医师.Mobile:13889900978;E-mail:13889900978@163.com

