秋水仙素处理对根茎型清水紫花苜蓿抗旱性的影响
李 悦,师尚礼
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
秋水仙素处理对根茎型清水紫花苜蓿抗旱性的影响
李 悦,师尚礼
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
采用0.05%,0.1%和0.2% 3个浓度秋水仙素对根茎型清水紫花苜蓿种子进行4 h处理,在幼苗3~4叶期进行干旱胁迫,通过测定胁迫0、3、6、9及12 d复水后叶片相对含水量(RWC)、丙二醛(MDA)、游离脯氨酸(Pro)及叶绿素含量,研究不同浓度处理下清水紫花苜蓿对干旱胁迫的适应能力。结果表明:随着干旱胁迫时间的延长,清水紫花苜蓿叶片RWC及叶绿素含量呈现降低趋势,且均在0.2%处理下降低最小;而MDA及Pro含量呈不同程度增加,但MDA含量在0.1%处理下积累最少,而Pro含量在0.2%处理下积累最多。同时,对各处理植株的叶片RWC、Pro含量、MDA含量及叶绿素含量4个生理生化指标进行综合分析,得出不同浓度秋水仙素处理的根茎型清水紫花苜蓿植株抗旱性强弱顺序为:0.1%>0.05%>0.2%>CK。
根茎型清水紫花苜蓿;秋水仙素;抗旱性
紫花苜蓿(Medicagosativa)是重要的豆科牧草,因具有叶量大、叶茎比高、粗蛋白含量高、品质好、抗性强等优点,是一种全球性栽培、适应性广泛、营养价值高、适口性优良的饲料作物。根茎型紫花苜蓿是紫花苜蓿的一个变型,其根颈部较长,形成根茎混杂区,根颈距地表相对较深,并从其根颈区发育出类似根状的茎,萌发新芽与幼根,出土形成新的植株,是培育放牧型苜蓿的良好材料,具有许多栽培苜蓿所不具有的植物学和生物学特征[1,2]。在我国,苜蓿也是许多农牧区的首选草种[3]。苜蓿产业化进程不断推进,对农民增加收入和生态环境建设发挥着至关重要的作用[4,5]。但苜蓿是一种相对需水的作物,优质、高产、稳产的获得与水资源供应和品种抗旱能力强弱存在直接关系[6]。据统计,我国干旱及半干旱地区面积占全国总耕地面积的48%,干旱已成为影响作物产量和品质的主要限制因子[7],近年来由于环境恶化、气温转暖、水资源缺乏导致各地旱情频发,抗旱性强的苜蓿品种在生产实践中得到广泛应用。因此,系统开展优质抗旱苜蓿品种的筛选及其抗旱性鉴定与评价的研究,对指导我国干旱、半干旱地区苜蓿产业化稳步发展尤为必要,并具有现实意义。
参照植物抗旱性鉴定方法与指标,通过温室盆栽控水的方式模拟土壤干旱胁迫条件下,测定不同浓度(0.05%,0.1%和0.2%)秋水仙素处理后的根茎型清水紫花苜蓿植株叶片的相对含水量(RWC)、丙二醛(MDA)含量、游离脯氨酸(PRO)及叶绿素含量,并对4个生理生化指标进行综合分析,客观评价各处理根茎型清水紫花苜蓿的抗旱性,旨在为通过秋水仙素诱变获得的苜蓿新品种的高产栽培提供一定的理论依据与技术支持。
1 材料和方法
1.1 材料与设计
1.1.1 试验材料 供试品种为甘肃农业大学草业学院育成的国审品种根茎型清水紫花苜蓿,种子由草业生态系统教育部重点实验室提供。
1.1.2 试验设计 挑选大小均匀,饱满的种子用蒸馏水浸泡一段时间,选择吸胀的种子整齐地摆放在铺有滤纸的培养皿中(直径9 cm,80粒/皿),加入适量蒸馏水,以不能流动为宜,在25 ℃恒温培养箱进行培养并及时补给水分。待种子露白,分别用浓度为0.05%(T1处理)、0.1%(T2处理)、0.2%(T3处理)的秋水仙素溶液浸泡4 h后放入恒温培养箱25 ℃继续培养,以蒸馏水处理作为对照(CK),每个处理9次重复,待80%的种子发芽后于花盆中进行盆栽(外口径为30 cm;内口径为26 cm,高20 cm,每盆50粒,共36盆),每盆分装沙土8 kg,每天观察并每隔两天浇灌霍格兰氏(Hoagland’s)营养液,以确保苜蓿苗生长过程所需的氮、磷、钾等元素。待幼苗长至三到四叶期时开始干旱胁迫,分别于停水当天(0 d)和干旱胁迫第3、6、9 d及第12 d复水后的上午9∶00采样(同部位的叶片),并测定其生理生化指标。
1.3 测定项目与方法
1)叶片相对含水量(RWC) 采用称重法[8];2)游离脯氨酸(Pro)含量的测定参考邹琦[8]的方法;3)丙二醛(MDA)含量的测定参考王学奎[9]的方法;4)叶绿素含量的测定采用吸光光度法(根据修正的Arnon公式进行计算)[10]。
1.4 数据分析
ST采用SPSS 17.0对数据进行差异显著性分析。
2 结果与分析
2.1 不同浓度秋水仙素处理后叶片相对含水量变化
逆境条件下植物叶片相对含水量可反映植物的保水能力,是标志植物水分状况的重要指标[11]。随着干旱胁迫时间的延长,各浓度秋水仙素处理的叶片相对含水量均呈降低趋势,且均较对照高。非干旱胁迫下,T3与CK及T1处理的叶片相对含水量均差异显著(P<0.05),而其他各处理间差异不显著。胁迫3 d时,T2与T3处理的叶片相对含水量与对照有显著差异(P<0.05),其他处理之间差异不显著;胁迫6 d时,叶片RWC含量在CK及T1处理下与T2与T3处理有显著差异(P<0.05),而其他处理间无显著差异;胁迫9 d时,各诱变处理的叶片RWC含量均与对照之间差异显著,与非胁迫条件下相比,RWC含量分别降低了28.08%、26.16%、25.46%、18.96%(表1)。复水后叶片RWC含量恢复,但仍比未胁迫时有较小降幅。结果表明,经不同浓度秋水仙素诱变处理的苜蓿叶片保水力强于对照,且T3处理下叶片相对含水量下降最少。

表1 不同浓度秋水仙素诱变后叶片相对含水量Table1 The RWC contents of leafs induced by different concentrations of colchicine %
注:同列不同小写字母表示差异显著(P<0.05),下同
2.2 不同浓度秋水仙素处理对叶片丙二醛含量的影响
随着胁迫时间的延长,各处理下叶片的MDA含量都出现不同程度积累。其中,3 d与9 d胁迫下,T2、T3处理的叶片MDA含量与CK、T1处理之间均有显著差异(P<0.05),但T2、T3差异不显著,CK、T1差异显著(P<0.05);6 d胁迫下,不同处理之间叶片MDA含量均差异显著,且均较非胁迫条件下有不同积累;且T2处理的叶片MDA含量增幅均最小,为0.80%(3 d)、4.59%(6 d)7.31%(9 d);复水后T3处理的叶片MDA含量与对照差异显著(P<0.05),并且各处理MDA含量较对照有小幅度增加。说明干旱胁迫对T2处理的植株伤害程度较小(表2)。
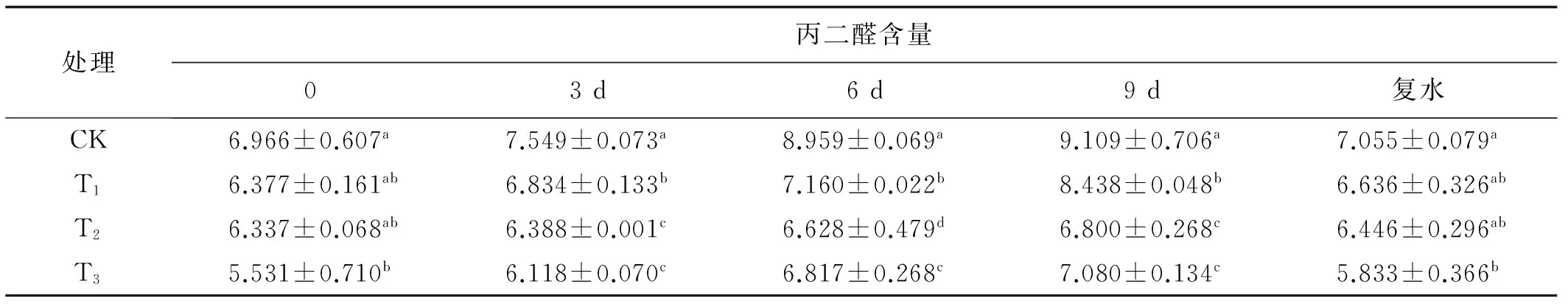
表2 不同浓度秋水仙素处理后的叶片丙二醛含量Table2 The MDA contents of leafs induced by different concentrations of colchicine μg/g EW
2.3 不同浓度秋水仙素处理对叶片游离脯氨酸含量的影响
随着胁迫时间的增加,不同浓度秋水仙素处理下叶片Pro出现不同程度积累,叶片Pro含量在不同浓度不同胁迫时间之间均差异显著(P<0.05)。干旱胁迫3,6和9 d时,T3处理叶片Pro含量均较非胁迫条件增加幅度最大,分别为52.24%,92.26%和118.61%;复水后各处理叶片Pro含量小于胁迫时的水平,但仍有小幅度积累,且在T3处理增幅最大,为21.55%(图1)。由此可知,T3处理下的苜蓿叶片内Pro含量积累最多,适应干旱胁迫能力更强。
吉非替尼(gefitinib)是首个选择性表皮生长因子受体酪氨酸激酶抑制剂,自2002年首先在日本上市,现已广泛用于既往接受过化疗或不适于化疗的局部晚期或转移性非小细胞肺癌的一线治疗药物。间质性肺病(interstitial lung disease,ILD)是其严重的不良反应,致死率较高[1]。目前,吉非替尼致ILD死亡的危险因素尚未见报道,现以国内外吉非替尼致ILD个案报道的文献为基础,探讨该药致ILD死亡的危险因素,以便于临床更加安全使用提供参考。

图1 不同浓度秋水仙素处理后的叶片Pro含量Fig.1 The Pro contents of leafs induced by different concentrations of colchicine
2.4 不同浓度秋水仙素诱变后苜蓿叶片叶绿素含量
不同处理之间叶片叶绿素含量均差异显著(P<0.05),且随胁迫时间的延长,各处理叶片叶绿素含量呈现不同程度降低趋势(图2)。其中胁迫9 d时下降程度最大,CK、T1、T2及T3处理叶片叶绿素含量均较非干旱胁迫下降低了25.75%、22.01%、17.47%、17.33%。由此可知,T3处理的叶绿素含量下降最为缓慢,干旱胁迫对其伤害程度也最小。
2.5 秋水仙素各处理下清水苜蓿抗旱性的综合评价
牧草对干旱环境的适应具有多样性和复杂性,其抗旱能力强弱也难以用某一通用指标来评价,因此,研究中需要多种指标相结合,综合分析干旱胁迫对苜蓿抗旱性的影响。以叶片RWC、MDA含量、Pro含量和叶绿素含量4个指标为依据,应用Fuzzy数学中隶属度函数法[8,12]进行综合评判,与抗旱性呈正相关的指标RWC、叶绿素、Pro采用以下公式计算。

图2 不同浓度秋水仙素处理后的叶片叶绿素含量Fig.2 The Chlorophy II contents of leafs induced by different concentrations of colchicine
Fij=(Xij-Xjmin)/(Xjmax-Xjmin)
对与抗旱性呈负相关的MDA采用公式计算。
Fij=1-(Xij-Xjmin)/(Xjmax-Xjmin)

3 讨论与结论
近年来,国内外学者通过研究报道,牧草在干旱的环境下各生理生化指标如RWC,Pro和MDA含量、叶绿素含量等都会产生相应的变化以适应干旱胁迫。

表3 秋水仙素不同浓度处理的苜蓿各指标隶属函数值及综合评价值Table3 The subordinate function values and comprehensive evaluaticm values of different colchicines concentration treatment to alfalfa
RWC是反映植物抗旱性强弱的一项重要指标,可以有效地保持叶绿体的结构和PsⅡ功能,使植物进行有效的光合作用[13]。RWC越大,下降速率越小,则抗旱性越强。李崇巍等[14]研究表明,能维持较高相对含水量的植物,其抗旱能力亦较强。蒲光兰等[15]试验得知,杏(Prunusarmeniaca)在水分胁迫初期,RWC下降较缓;胁迫至末期,下降速率开始加快,随胁迫增加,净光合速率出现负值,不再积累光合产物,反而呈消耗代谢,生长停滞。试验结果表明:随着胁迫时间的延长,各处理叶片RWC呈下降趋势,其中T3处理下的RWC降低最小。
MDA作为膜脂过氧化的最终分解产物对细胞膜起伤害作用[16],其含量可以反映植物遭受逆境伤害的程度,即膜脂过氧化程度随品种抗旱性下降而加剧[17],因此,MDA积累量的高低能够在一定程度上反应出植物体受干旱胁迫后自身的受损害程度,即对干旱胁迫的承受能力。试验表明:随着干旱胁迫程度的加剧,各处理叶片MDA产生不同程度积累。其中以T2处理下MDA含量增加最少,说明干旱胁迫对植株伤害程度较小。
Pro是植物体内重要的渗透调节物质之一,其含量的变化是植物对逆境条件的一种适应性变化[18]。当植物受到逆境胁迫时,尤其是干旱时造成体内脯氨酸积累。抗旱性强的植物Pro积累时间长,积累量也较大[17-19]。试验结果表明,随着胁迫时间的增加不同浓度秋水仙素处理的叶片Pro含量出现不同程度积累,其中以T3处理下叶片内Pro含量积累最多,说明处理植株适应干旱胁迫能力较强。
干旱胁迫下叶片叶绿素含量随着胁迫强度的增大而降低,缺水不仅影响叶绿素的生物合成,而且促进已形成的叶绿素的加速分解,导致叶片发黄,在一定范围内叶绿素含量高低则直接影响叶片的光合作用能力,从而影响作物产量[20]。试验显示,随着胁迫时间的延长,不同浓度秋水仙素处理使叶片叶绿素含量出现不同程度降低,其中,胁迫9 d时下降程度最大,T3处理的植株叶片叶绿素含量下降最为缓慢,说明干旱胁迫对其伤害程度也最小。
植物抗旱性是一个受多种因素影响的复杂数量性状,不同植物对某一具体指标的抗旱性反应不一定相同,其评价方法很多,其中,隶属函数分析提供了1条在多指标测定基础上对苜蓿抗旱性进行综合评价的途径,避免了单一指标的片面性。因此,试验运用Fuzzy数学隶属函数综合评判法[6,10],对各诱变处理苜蓿的叶片RWC、Pro、MDA含量及叶绿素含量4个生理生化指标进行综合分析,得出不同浓度秋水仙素处理的清水紫花苜蓿植株抗旱性强弱顺序为:T2>T1>T3>CK。说明,经过不同浓度秋水仙素处理的植株抗旱性整体较对照植株有所增强,为今后利用秋水仙素为化学诱变剂对清水紫花苜蓿品种进行诱变加倍育种,获得抗性更强的新品种奠定了一定的基础。
[1] 张雪婷,师尚礼.陇东野生紫花苜蓿的遗传特异性分析[J].草地学报,2009,17(3):333-348.
[2] 程鹏舞,黎明,魏武,等.一年生苜蓿种质资源形态变异及其形态特征[J].草原与草坪,2008(2):35-40.
[3] 杨青川.苜蓿生产与管理指南[M].北京:中国林业出版社,2003:8-68.
[4] 林清,何茂秦,王照兰,等.多叶型苜蓿材料的稳定性及其农艺性状[J].中国草地,1998(3):6-8.
[5] 胡跃高,韩建国,曾昭海.当前我国苜蓿产业形势与建设任务[J].北京农业,2000(增刊):2-5.
[6] 孙启忠,王晓力,玉柱,等.新形势下的我国苜蓿产业发展对策[C]∥成都:中国草学会饲料生产专业委员会第十六次学术研讨会,2011:22-28.
[7] 李造哲.10种苜蓿品种幼苗抗旱性的研究[J].中国草地,1991(3):1-3.
[8] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[9] 王学奎.植物生理生化实验原理和技术(第二版)[M].北京:高等教育出版,2006:280-281.
[10] Friden J L,Varco J J.Dependency of cotton leaf nitrogen,chlorophy11,and reflectance on nitrogen and potassium availability[A].Agronomy Journal,2004,96:63-69.
[11] 霍红,张勇,陈年来,等.干旱胁迫下五种荒漠灌木苗期的生理响应和抗旱评价[J].干旱区资源与环境,20l0,25(1):185-189.
[12] 魏永胜,梁宗锁,山仑.草地退化的水分因素[J].草业科学,2004,21(10):13-18.
[13] 李吉跃.植物耐旱性及其机理[J].北京林业大学学报,199l,13(3):92-97.
[14] 李崇巍,贾志宽,林玲.几种苜蓿新品种抗旱性的初步研究[J].干旱地区农业研究,2002,20(4):21-25.
[15] 蒲光兰,袁大刚,胡学华,等.杏树抗旱性研究[J].西北林学院学报,2005,20(3):40-43.
[16] 沙伟,刘焕婷,谭大海,等.低温胁迫对扎龙芦苇SOD、POD 活性和可溶性蛋白含量的影响[J].齐齐哈尔大学学报,2008,24(2):1-4.
[17] 周瑞莲,张承烈,金巨合.水分胁迫下紫花苜蓿叶片含水量、质膜透性、SOD、CAT活性变化与抗旱性关系研究[J].中国草地,1991(2):20-24.
[18] 田丰,张永成,张凤军,等.不同品种马铃薯叶片游离脯氨酸含量、水势与抗旱性的研究[J].作物杂志,2009(2):73-76.
[19] 王宗仁,陈宝书.甘肃地方苜蓿品种脯氨酸积累能力与抗旱性的研究[J].甘肃农业大学学报,1992,27(2):131-137.
[20] 杨鑫光,傅华,牛得草.干旱胁迫下幼苗期霸王的生理响应[J].草业学报,2007,16(5):107-112.
The preliminary research of different colchicine concentration treatments on the drought resistance of RhizomatousMedicagosativacv.Qingshui
LI Yue,SHI Shang-li
(CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainabilityLanzhou730070)
This paper used four treatments of different concentrations of colchicine(0.05%、0.1%、0.2%) to treat seeds of Medicago sativa cv.Qingshui for 4 hours and conducted drought stress when the seedlings was in 3~4 leaf stage.The contents of RWC,MDA,PRO and Chlorophyll in leaves under drought stress were measured on 0 d、3 d、6 d、9 d and rewater after 12 d.The results showed that the contents of RWC,and Chlorophyll of plant leaves were decreasing,and the lowest values were in the colchicine with 0.2%;MDA and Pro were increasing.However,MDA had a least accumulation under the treatment with 0.1%,and Pro had a most accumulation under the treatment with 0.2%.Meanwhile,based on the comphensive analyse of RWC,MDA,PRO and Chlorophyll,the rank of colchicine concentrations on the drought resistance of Qingshui alfalfa was: 0.1%>0.05%>0.2%>CK.
RhizomatousMedicagosativacv.Qingshui;Colchicine;drought resistance
2014-12-22;
2015-04-10
农业部牧草种质资源保种项目(NB2130135)资助
李悦(1989-),女,甘肃会宁人,在读硕士研究生。 E-mail:807653824@qq.com 师尚礼为通讯作者。
S 541
A
1009-5500(2015)04-0070-05

