海洋红酵母的发酵条件
郭 馨 泽,刘 彤,黄 忠 刚,叶 淑 红,肖 珊,王 晗,王 际 辉
(1.大连工业大学 食品学院,辽宁 大连 116034;2.大连市水产技术推广总站,辽宁 大连 116023;3.大连博仕奥生物科技有限公司,辽宁 大连 116085)
0 引 言
海洋红酵母菌体中富含蛋白质、糖类、维生素、消化酶及生长因子等多种生理活性物质,因此能有效地促进水产动物个体生长,并能提高水产动物的存活率、增强繁殖能力。赵昌会等[1]的研究结果表明,海洋红酵母菌体中含有大量的蛋白质和促进生长因子,在水产养殖业中,通常作为水产动物育苗的开口饵料,用于促进水产动物生长[2-4]。海洋红酵母菌体中含有的虾青素在抗氧化、消除自由基方面的功能很强,可以促进抗体的产生并增强动物的免疫功能[5]。海洋红酵母可以抑制海洋中的病原微生物[6],还可以用作水质调节剂[7-10]。作者对海洋红酵母摇瓶培养条件进行了优化,旨在提高海洋红酵母的发酵产量,为大规模发酵提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 菌 种
海洋红酵母菌株,由大连工业大学食品学院发酵工程实验室从海泥中分离、鉴定并保存,命名为003。
1.1.2 培养基
各种培养基经过121 ℃、20 min 高压灭菌,冷却至常温备用。
斜面活化培养基:葡萄糖1.0%,蛋白胨0.5%,酵母膏0.5%,氯化钠1.0%,琼脂2.0%,蒸馏水100mL,自然pH。
液体种子培养基:葡萄糖2%,蛋白胨1.0%,酵母膏0.5%,氯化钠1.0%,硫酸镁0.01%,磷酸二氢钾0.15%,蒸馏水100mL,自然pH。
摇瓶发酵培养基:葡萄糖1.0%,蛋白胨1.0%,酵母膏0.5%,氯化钠1.0%,硫酸镁0.01%,磷酸二氢钾0.15%,蒸馏水100 mL,自然pH。
1.2 方 法
1.2.1 菌株扩大培养
斜面活化:将冰箱内保存的菌种接种到斜面培养基上活化,22 ℃恒温培养24h。
种子培养:斜面培养基22 ℃培养24h后,从斜面接种1环到装液量250mL瓶装50mL的培养基中,于22 ℃、200r/min条件下培养24h。
发酵培养:以5%的接种量将种子液接入发酵培养基中,装液量为250mL瓶装50mL,摇床转速200r/min,于22 ℃培养24h。
1.2.2 单因素试验
分别比较时间、温度、无机盐、pH 等不同培养条件下海洋红酵母菌产量,确定最佳单因素条件。
1.2.3 正交试验
采用四因素三水平L9(34)正交试验,共设9个处理,每个处理3 个重复,各因素水平如表1所示。
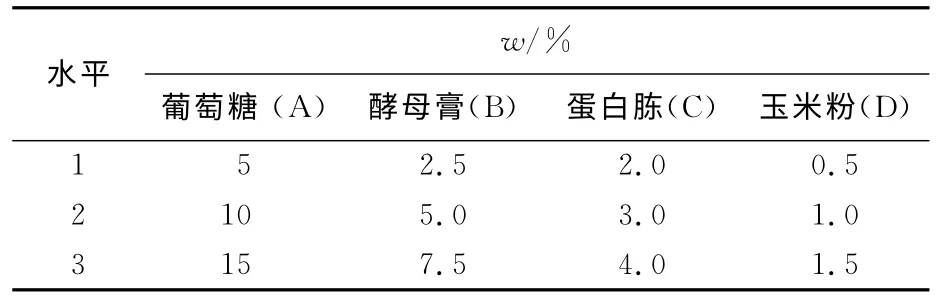
表1 正交试验因素水平Tab.1 Factors and levels of orthogonal test
1.2.4 发酵罐扩大培养
在发酵培养基及培养条件优化的基础上,进行海洋红酵母菌株5L发酵罐扩大培养试验。试验装料系数为70%,优化培养基灭菌后,以8%的接种量接入海洋红酵母菌株,培养温度22 ℃,初始pH 4.8,搅拌速度280~350r/min,通气量6L/min。每隔3h无菌采样测定菌量。
1.2.5 酵母细胞数测定方法
血球计数板法[11]。
2 结果与分析
2.1 培养基的优化
2.1.1 酵母菌的生长曲线
发酵培养后,从3h开始,每隔3h取样,进行菌量的测定。依据菌量数据绘制该菌株的生长曲线,如图1所示。

图1 海洋红酵母生长曲线Fig.1 Marine red yeast growth curve
发酵过程菌的生长:在9~24h菌呈对数生长;24~42h产量基本不变,为生长稳定期,产量最高达9.72×108cfu/mL;42h后进入衰亡期,所以在后续摇瓶试验中,发酵时间可采用24h。
2.1.2 碳源对海洋红酵母菌量的影响
2.1.2.1 碳源种类对海洋红酵母产量的影响
选取质量分数为1%的葡萄糖、蔗糖、乳糖、淀粉来研究不同碳源对海洋红酵母产量的影响,结果如图2所示。从图中可以得出,以葡萄糖作为碳源效果最好,蔗糖次之。葡萄糖来源广泛,价格低廉,综合考虑,选择葡萄糖作为海洋红酵母的最佳碳源。
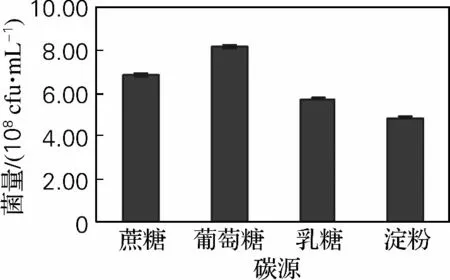
图2 碳源种类对海洋红酵母菌量的影响Fig.2 Effect of carbon sources on biomassof marine red yeast
2.1.2.2 碳源浓度对海洋红酵母产量的影响
以葡萄糖作为碳源,考察不同浓度对海洋红酵母发酵产量的影响,结果如图3 所示。在0~1%,随着葡萄糖质量分数的增大,菌量增多;在1%~2%菌量较高;当质量分数大于2%时,菌量逐渐下降。通过试验得知,1%时酵母菌产量相对较高,与2%时的产量差别不大。综合考虑,选葡萄糖的质量分数为1%,此时海洋红酵母产量为7.92×108cfu/mL。

图3 葡萄糖质量分数对海洋红酵母菌量的影响Fig.3 Effect of glucose concentration on biomass of marine red yeast
2.1.3 氮源对海洋红酵母酵母产量的影响
选择蛋白胨、玉米粉、硫酸铵及其组合作为不同的氮源,同时用酵母膏作为辅助氮源来考察氮源对海洋红酵母产量的影响。结果如图4所示,海洋红酵母利用不同氮源发酵的菌体生物量依次为:蛋白胨+玉米粉+酵母膏>蛋白胨+硫酸铵+酵母膏>蛋白胨+酵母膏>硫酸铵+酵母膏>玉米粉+硫酸铵+酵母膏>玉米粉+酵母膏。由于蛋白胨+玉米粉+酵母膏组合氮源的海洋红酵母产量最高,而且玉米粉的成本较低,因此选择玉米粉、蛋白胨和酵母膏作为氮源。
2.1.4 无机盐对海洋红酵母产量的影响
2.1.4.1 无机盐种类对海洋红酵母产量的影响
选取0.5%的磷酸二氢钾、硫酸镁、氯化钙和氯化钠这几种无机盐来研究不同无机盐对海洋红酵母产量的影响,结果如图5所示。从图中可以看出,相同浓度下以氯化钠为无机盐效果最好,硫酸镁次之。氯化钠来源广泛、价格低廉,综合考虑,选择氯化钠作为海洋红酵母的最佳无机盐。
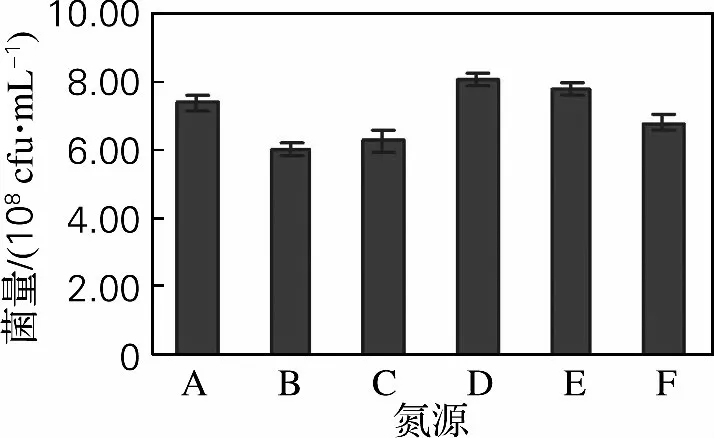
图4 氮源对海洋红酵母菌量的影响Fig.4 Effect of nitrogen sources on biomass of marine red yeast

图5 无机盐对海洋红酵母产量的影响Fig.5 Effect of inorganic salts on biomass of marine red yeast
2.1.4.2 无机盐浓度对海洋红酵母菌量的影响
以氯化钠作无机盐,考察不同的无机盐浓度对海洋红酵母发酵产量的影响,结果如图6所示。随着无机盐浓度的增加,酵母菌产量有起伏。当盐质量分数在0~1%增加时,菌量随之增加,说明在此盐浓度范围内,盐浓度增加促进了海洋红酵母的生长速度;当盐质量分数在1%~3%时,随盐浓度的增加其生长速度随之减慢,说明高盐浓度抑制了细胞生长。当氯化钠质量分数为1%时产量最高,产量为8.06×108cfu/mL。
2.1.5 正交试验
通过单因素试验确定了培养基的最佳参数,通过考察葡萄糖、酵母膏、蛋白胨以及玉米粉质量分数这4个因素的相互影响,以海洋红酵母产量为考察指标,得到的正交试验结果如表2 所示。由表2可知,各种因素对海洋红酵母影响程度为:葡萄糖>酵母膏>蛋白胨>玉米粉。葡萄糖对菌量的增加作用最显著,其次是酵母膏,再次是蛋白胨,最后是玉米粉。通过正交试验优化,得到海洋红酵母最优培养基为:葡萄糖1.0%、酵母膏0.5%、蛋白胨0.4%、玉米粉0.1%。

图6 NaCl质量分数对海洋红酵母产量的影响Fig.6 Effect of NaCl on biomass of marine red yeast
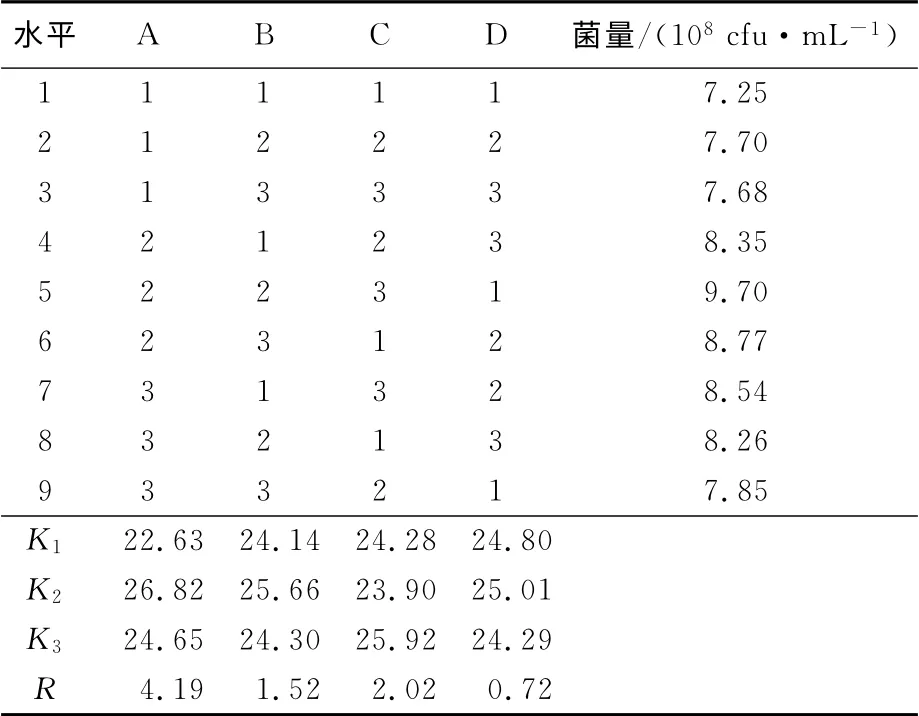
表2 正交试验结果分析Tab.2 Results of analysis of orthogonal test
2.2 培养条件的影响
2.2.1 pH 对海洋红酵母产量的影响
选择优化后的发酵培养基(pH 4.8~6.0),以确定最适的pH,结果如表3所示。pH 为4.8,即自然值时酵母菌达到最大产量。这可能由于低pH 可抑制杂菌,减少污染,所以实际生产中,要将海洋红酵母的发酵培养基的pH 控制在4.8,这样既可提高菌量,又在一定程度上控制污染。
2.2.2 温度对海洋红酵母产量的影响
选择18、22、26、30 ℃进行试验,结果如表4所示。在18~22℃,随着温度的升高,菌量增多;其中,在22和26 ℃时,菌量较高,且菌数比较接近,但从节能角度考虑,选择22 ℃进行培养。

表3 pH 对海洋红酵母产量的影响Tab.3 Effect of pH on biomass of marine red yeast

表4 温度对海洋红酵母菌量的影响Tab.4 Effect of temperature on biomass of marine red yeast
2.2.3 摇床转速对海洋红酵母产量的影响
选择摇床转速为160、180、200、220r/min进行试验,结果如表5 所示。实验结果表明,在180~200r/min 随着摇床转速升高,溶氧量增多,在一定程度上更有利于菌株的生长;但当转速达到220r/min后,酵母菌产量反而降低。其中,摇床转速200r/min时的菌数最高,因此选择摇床转速200r/min进行培养。

表5 摇床转速对海洋红酵母产量的影响Tab.5 Effect of shaking speed on biomass of marine red yeast
2.2.4 装液量对海洋红酵母产量的影响
为了考察摇瓶装液量对菌体产量的影响,选择250mL 瓶装10~70mL 的菌液进行试验,结果如表6所示。结果表明,当装液量为10mL 时菌数最高,但不适用于实际发酵;当装液量达到70mL 时,酵母菌生长受到显著抑制。综合考虑选择相对较优的装液量50mL。

表6 装液量对海洋红酵母产量的影响Tab.6 Effect of volume on biomass of Marine red yeast
2.2.5 接种量对海洋红酵母产量的影响
考察接种量对于海洋红酵母产量的影响,结果如表7所示。当接种量为8%时,海洋红酵母产量最大。这是由于较小接种量可能使培养基营养物质不能被充分利用;而接种量过大可能会带入过多的代谢废物而不利于菌体生长。

表7 接种量对海洋红酵母菌量的影响Tab.7 Effect of inoculation quantity on biomass of marine red yeast
通过对海洋红酵母003发酵条件的单因素试验,得到其最优培养条件为接种量8%,初始pH 4.8,摇瓶装液量50mL/250mL,培养温度22 ℃,摇床转速为200r/min。菌株在此条件下经24h的培养,菌数可达到1.02×109cfu/mL。
2.3 发酵罐扩大试验
采用优化的培养基,以8%的接种量接入5L全自动发酵罐,初始pH 控制在4.8,搅拌速率为280~350r/min,通气量为6 L/min,温度为22℃,罐压为0.05 MPa。每隔3h进行采样,并对菌量进行测定,结果如图7所示。
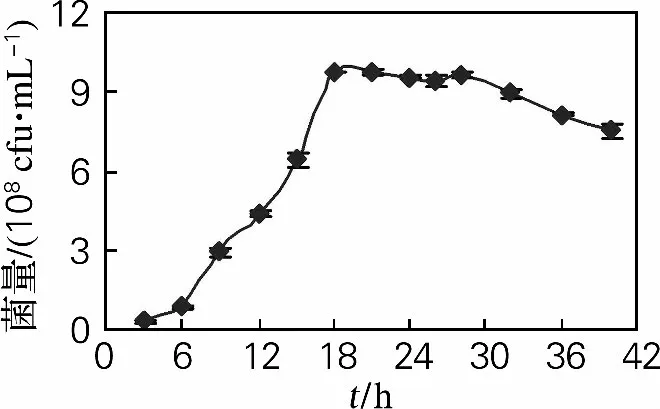
图7 5L发酵罐发酵生长曲线Fig.7 5Lfermentor growth curve
在发酵过程中,酵母菌在8~18h呈对数生长;18~28h产量基本不变,为生长稳定期,产量最高达1.05×109个/mL;28h后进入衰退期(图7)。根据试验结果,在后续发酵罐试验中可选取18h作为发酵时间,以节省生产成本。
3 结 论
对一株来自海洋泥土中的红酵母003进行了培养条件的优化。发酵培养基的确定:葡萄糖是更适于酵母菌生长的碳源,葡萄糖最佳质量分数为1.0%;以蛋白胨、玉米粉和酵母膏混合氮源对海洋红酵母的生长最有利;NaCl是海洋红酵母生长的最佳无机盐,当其质量分数为1.0%时海洋红酵母产量最高。以葡萄糖、蛋白胨、玉米粉、酵母膏为主要因素,进行正交试验,最优结果为葡萄糖1.0%,蛋白胨0.4%,玉米粉0.1%,酵母膏0.5%。发酵条件的优化:通过对海洋红酵母003生长条件的研究,确定了其在pH 为自然值、发酵温度22 ℃、接种量8%、装液量为250 mL 瓶装50mL发酵液、转速200r/min时,酵母产量最高可达1.02×109cfu/mL,在此条件下海洋红酵母003生长最好。
[1]赵昌会,罗静瑶.海洋酵母菌的研究进展[J].湖南科技学报,2008,29(8):59-60.
[2]张超,刘军.SCP 生产菌海洋红酵母摇瓶培养研究[J].四川轻化工学院学报,2000,13(3):71-74.
[3]周鲜娇.不同培养条件对海洋红酵母类胡萝卜素累积的影响[J].安徽农业科学,2011,39(15):8845-8847.
[4]吴清洋,许国焕.水产微生物制剂应用现状与思考[J].广东饲料,2012,21(增刊1):62-65.
[5]巩玉辉,陈翠翠.微生态制剂在海参养殖中的应用[J].中国饲料,2012(8):37-39.
[6]王亚敏,王印庚.微生态制剂在水产养殖中的作用机理及应用研究进展[J].动物医学进展,2008,29(6):72-75.
[7]李君丰,吴垠.不同种类微生态制剂在水产养殖中使用的有效性[J].中国微生态学杂志,2010,22(12):1147-1149.
[8]王刚.微生态制剂在水产养殖上的应用[J].水产科学,2002,21(3):34-36.
[9]许金花,肖克宇.微生态制剂在水产养殖中的应用及前景[J].河北渔业,2006(2):1-5.
[10]YANG Shi-ping,WU Zao-he,JIAN Ji-chang,et al.Effect of marine red yeastRhodosporidiumpaludigenumon growth and antioxidant competence ofLitopenaeusvannamei[J].Aquaculture,2010,309(1/2/3/4):62-65.
[11]周德庆.微生物学实验手册[M].北京:高等教育出版社,2006:78-82.

