胃癌3号染色体短臂抑癌基因CpG岛甲基化表型研究
胃癌3号染色体短臂抑癌基因CpG岛甲基化表型研究
韩梅1史冬涛2曹健2田文妍2张洪涛3陈卫昌2#
苏州大学附属第一医院特需病房1(215006)消化科2苏州大学癌症分子遗传学实验室3

*基金项目:2012年苏州市科技计划项目(SYS201226)、2014年度江苏省高校自然科学研究面上项目(14KJB320014)
背景:3号染色体短臂(3p)抑癌基因CpG岛甲基化表型(CIMP)涉及的甲基化异常见于多种类型的癌症中,但与胃癌的关系迄今仍未阐明。目的:研究胃癌中3p抑癌基因启动子区CIMP的临床意义。方法:采用甲基化特异性PCR(MSP)法检测100例胃癌组织及其对应癌旁组织中hOGG1、VHL、RAR-B、hMLH1、SEMA3B、RASSF1A、BLU和FHIT共8个抑癌基因启动子区CpG岛甲基化状态。以每份样本中含有4个及以上甲基化基因定义为高CIMP水平(CIMP-H)。分析CIMP-H与胃癌临床病理特征的关系。结果:胃癌组织中VHL(P=0.030)、hMLH1(P<0.001)、SEMA3B(P=0.003)、RASSF1A(P<0.001)和FHIT(P<0.001)基因甲基化阳性率显著高于癌旁组织。胃癌组织和对应癌旁组织中CIMP-H发生率分别为44.0%和4.0%,差异有统计学意义(P<0.001)。胃癌组织CIMP-H与肿瘤分化程度呈显著负相关(P=0.004),与淋巴结转移呈显著正相关(P=0.005),而与性别、年龄、肿瘤部位、肿瘤直径、浸润深度和TNM分期均无关(P>0.05)。结论:3p CIMP异常状态可能在胃癌形成早期已发生,并影响肿瘤分化,导致淋巴结转移。
关键词胃肿瘤;3号染色体短臂;基因,肿瘤抑制;CpG岛甲基化表型
CpG Island Methylator Phenotype
胃癌形成不仅涉及多个遗传基因缺陷,还与基因表观遗传改变有关。DNA甲基化是最重要的表观遗传调控机制,抑癌基因DNA高甲基化可使抑癌基因表达失活,其结果类同于基因缺失或突变而造成的基因功能丧失,导致肿瘤发生[1]。已往研究多以单一基因为检测对象,往往很难发现敏感性和特异性俱佳的生物学标记。CpG岛甲基化表型(CpG island methylator phenotype, CIMP)可引起多个抑癌基因失活[2-3],故检测CIMP对肿瘤的诊断、化疗疗效预测和预后评估的价值优于单一基因检测。3号染色体短臂(3p)上存在大量肿瘤抑制基因,其启动子区CIMP在肺癌、食管癌、宫颈癌等中的作用已有报道[4-6]。但DNA甲基化具有肿瘤特异性,即不同肿瘤中抑癌基因甲基化图谱和频率不完全相同[7],3p抑癌基因CIMP涉及的甲基化异常与胃癌发生、发展的关系迄今仍未被阐明。本研究通过检测胃癌组织和对应癌旁组织中3p hOGG1(3p26)、VHL(3p25)、RAR-B(3p24)、hMLH1(3p21.3)、SEMA3B(3p21.3)、RASSF1A(3p21.3)、BLU(3p21.3)和FHIT(3p14.2)8个抑癌基因启动子区CpG岛甲基化状况及其与胃癌临床病理特征的关系,旨在探讨3p CIMP与胃癌发生、发展的关系。
对象与方法
一、资料来源
收集2008年1月-2008年12月苏州大学附属第一医院普外科接受手术治疗的100例胃癌患者的组织标本,所有患者均无胃癌家族史,术前均未行放、化疗。其中男64例,女36例;年龄27~80岁,中位年龄62岁;按2002年国际抗癌联盟(UICC)胃癌TNM分期标准分为:Ⅰ期19例,Ⅱ期35例,Ⅲ期19例,Ⅳ期27例;按分化程度分为高分化腺癌10例、中分化腺癌31例、低分化腺癌59例;伴淋巴结转移72例,无淋巴结转移28例;浸润深度不超过黏膜下层的早期癌10例,浸润深度达肌层及以下的进展期癌90例。对应癌旁胃黏膜组织取自距肿瘤边缘≥5 cm处的正常组织,均经病理检查证实。所有组织样本于离体0.5 h内放入液氮内冻存。
二、方法
按照CpG基因快速DNA改良提取试剂盒(S7824)说明书提取组织样本DNA,然后行甲基化特异性PCR(MSP)检测,PCR产物经聚丙烯酰胺凝胶电泳分离,经溴化乙锭染色置紫外灯下观察。将SssⅠ甲基化酶处理的基因组DNA作为阳性对照,双蒸水处理的基因组DNA作为阴性对照。
三、CIMP定义
将≥50%的基因发生甲基化判为高CIMP水平(CIMP-H),<50%判为低CIMP水平(CIMP-L)[8]。本实验共检测8个基因,即hOGG1(3p26)、VHL(3p25)、RAR-B(3p24)、hMLH1(3p21.3)、SEMA3B(3p21.3)、RASSF1A(3p21.3)、BLU(3p21.3)和FHIT(3p14.2),以每份样本中含有4个及以上甲基化基因为CIMP-H,低于4个甲基化基因为CIMP-L。
四、统计学分析
采用SPSS 19.0统计软件,分类变量采用样本数和百分比表示,组间比较采用χ2检验或Fisher精确概率法。P<0.05为差异有统计学意义。
结果
一、3p抑癌基因甲基化阳性率
8个基因甲基化典型示例见图1。100例胃癌样本中,99例(99.0%)至少1个基因发生了启动子区甲基化,其中1个基因甲基化2例,2个基因同时甲基化27例,3个基因26例,4个基因35例,5个基因7例,6个基因1例,7个基因1例。对应癌旁组织中分别有47例发生1个基因甲基化, 2个基因同时甲基化32例,3个基因6例,4个基因4例,无一例发生5个或以上基因同时甲基化。胃癌与癌旁组织中VHL(P=0.030)、hMLH1(P<0.001)、SEMA3B(P=0.003)、RASSF1A(P<0.001)和FHIT(P<0.001)基因甲基化阳性率差异有统计学意义(表1)。胃癌组织中hOGG1与RASSF1A、FHIT与BLU、FHIT与RAR-B甲基化显著相关(P=0.049、P=0.015和P=0.025)。
二、3p CIMP-H发生率
胃癌和癌旁组织CIMP-H发生率分别为44.0%(44/100)和4.0%(4/100),CIMP-L发生率分别为56.0%(56/100)和96.0%(96/100),差异有统计学意义(P<0.001)。
三、胃癌组织CIMP状态与临床病理特征的关系
胃癌组织CIMP-H与肿瘤分化程度密切相关,分化程度越差,CIMP-H发生率越高(P=0.004);与淋巴结转移亦显著相关,伴淋巴结转移者的CIMP-H发生率较无淋巴结转移者显著增高(P=0.005);而与性别、年龄、肿瘤部位、肿瘤直径、浸润深度和TNM分期均无关(P>0.05)(表2)。原发肿瘤中3p基因失活会导致广泛的生物学进程异常,早期关于胃癌等位基因丢失的研究结果显示,3p杂合性丢失(LOH)的发生率为21.7%~38.3%,但无法解释那些未发生LOH者的发病机制[9-10],因而推测,除已发现的LOH机制外,还应包括基因甲基化异常。

T:胃癌组织;N:对应癌旁组织;pos:阳性对照;water:阴性对照;M:甲基化;U:未甲基化
表1胃癌和对应癌旁组织中3p上各基因启动子甲基化频率n(%)
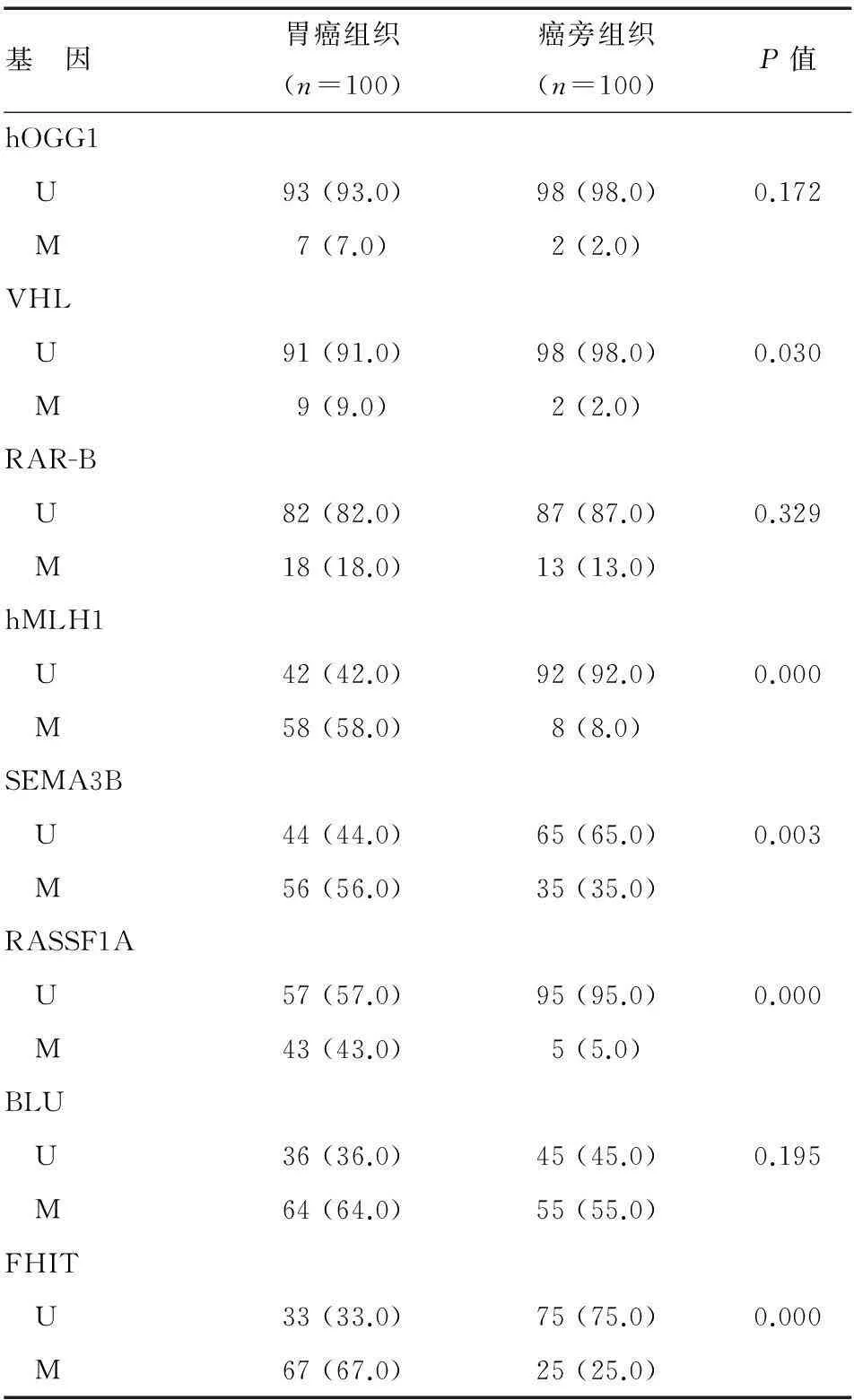
基 因胃癌组织(n=100)癌旁组织(n=100)P值hOGG1 U93(93.0)98(98.0)0.172 M7(7.0)2(2.0)VHL U91(91.0)98(98.0)0.030 M9(9.0)2(2.0)RAR-B U82(82.0)87(87.0)0.329 M18(18.0)13(13.0)hMLH1 U42(42.0)92(92.0)0.000 M58(58.0)8(8.0)SEMA3B U44(44.0)65(65.0)0.003 M56(56.0)35(35.0)RASSF1A U57(57.0)95(95.0)0.000 M43(43.0)5(5.0)BLU U36(36.0)45(45.0)0.195 M64(64.0)55(55.0)FHIT U33(33.0)75(75.0)0.000 M67(67.0)25(25.0)
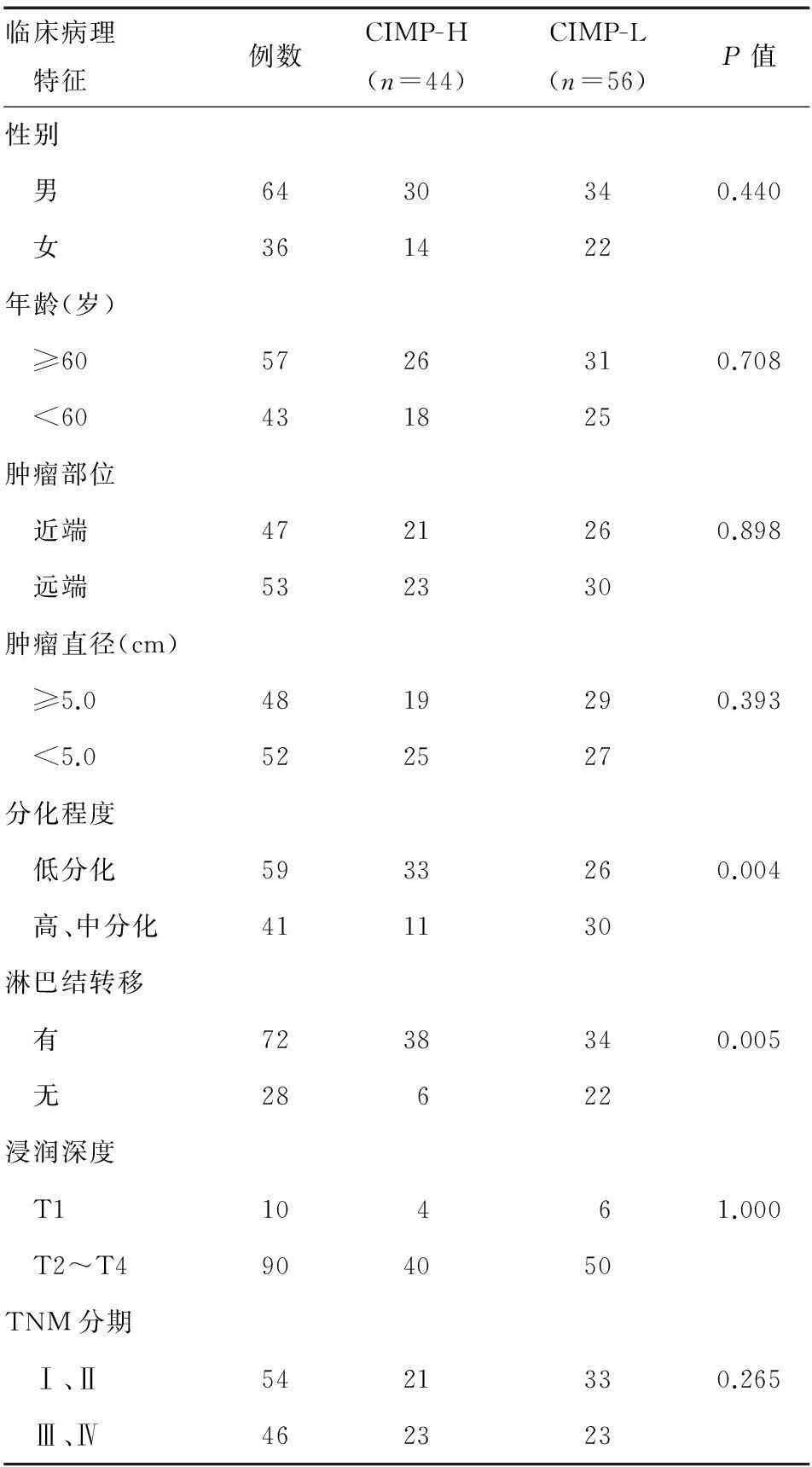
表2 CIMP与胃癌临床病理特征的关系(n)
讨论
本研究检测了100例组织胃癌及其对应癌旁组织中3p上8个抑癌基因的启动子区甲基化状态,胃癌组织中甲基化阳性率分别为hOGG1 7.0%、VHL 9.0%、RAR-B 18.0%、hMLH1 58.0%、SEMA3B 56.0%、RASSF1A 43.0%、BLU 64.0%、FHIT 67.0%;癌旁组织中甲基化阳性率分别为hOGG1 2.0%、VHL 2.0%、RAR-B 13.0%、hMLH1 8.0%、SEMA3B 35.0%、RASSF1A 5.0%、BLU 55.0%、FHIT 25.0%。胃癌和癌旁组织中VHL、hMLH1、SEMA3B、RASSF1A和FHIT基因甲基化阳性率差异有统计学意义。hMLH1、SEMA3B、RASSF1A和BLU的结果与既往研究相类似[11-14]。hOGG1和RAR-B基因甲基化与胃癌的关系既往未见报道,本研究结果显示,这两个基因甲基化阳性率在胃癌和癌旁组织间差异无统计学意义,故尚不能认为hOGG1和RAR-B基因启动子区甲基化与胃癌的发生有关。既往仅有2篇文献[15-16]显示在胃癌组织中未发现VHL基因甲基化,与本研究结果不符合。分析其原因,可能与受试者所处的环境不同有关,目前认为饮食、药物等外界环境是影响DNA甲基化的主要因素。研究发现,与一碳代谢相关的饮食因素可直接影响甲基供给,从而影响DNA甲基化过程。这些营养因素包括维生素B12、维生素B6、叶酸、蛋氨酸和维生素复合物[17-18]。今后的研究中如能去除环境因素的影响,则可更真实地反映受试者的DNA甲基化状态。
本研究中,99.0%的胃癌至少有1个基因发生启动子区甲基化。统计分析胃癌组织中2个基因甲基化之间的相关性发现,hOGG1与RASSF1A、FHIT与BLU、FHIT与RAR-B甲基化显著相关(P=0.049、P=0.015和P=0.025),这些相关性表明胃癌3p位点上有些抑癌基因启动子区甲基化是同步的。胃癌组织样本和癌旁组织样本中的CIMP-H发生率分别为44.0%和4.0%,组间差异有统计学意义(P<0.001),提示3p CIMP可能在胃癌发生中起有重要作用。
目前普遍认为,DNA甲基化异常是肿瘤发生中的早期事件,多项研究发现,在胃癌前期病变中存在的肿瘤抑制基因甲基化是其基因表达沉默的主要原因,并随肿瘤病程的演进,甲基化阳性率逐步升高[19-20]。本研究发现,3p CIMP-H与胃癌浸润深度和TNM分期均无关(P>0.05),而与肿瘤分化程度和淋巴结转移显著相关(P<0.05)。因此,3p CIMP-H可能反映了胃癌分化、转移潜能,而是否在胃癌形成早期就已发生还有待进一步研究。
参考文献
1Lay FD, Liu Y, Kelly TK, et al. The role of DNA methylation in directing the functional organization of the cancer epigenome[J]. Genome Res, 2015, 25 (4): 466-477.
2Kim JG, Takeshima H, Niwa T, et al. Comprehensive DNA methylation and extensive mutation analyses reveal an association between the CpG island methylator phenotype and oncogenic mutations in gastric cancers[J]. Cancer Lett, 2013, 330 (1): 33-40.
3 Suzuki H, Yamamoto E, Maruyama R, et al. Biological significance of the CpG island methylator phenotype[J]. Biochemical Biophys Rescommun, 2014, 455 (1-2): 35-42.
4 Liu Z, Li W, Lei Z, et al. CpG island methylator phenotype involving chromosome 3p confers an increased risk of non-small cell lung cancer[J]. J Thorac Oncol, 2010, 5 (6): 790-797.
5 Kuroki T, Trapasso F, Yendamuri S, et al. Allele loss and promoter hypermethylation of VHL, RAR-β, RASSF1A, and FHIT tumor suppressor genes on chromosome 3p in esophageal squamous cell carcinoma[J]. Cancer Res, 2003, 63 (13): 3724-3728.
6 Choi CH, Lee KM, Choi JJ, et al. Hypermethylation and loss of heterozygosity of tumor suppressor genes on chromosome 3p in cervical cancer[J]. Cancer Lett, 2007, 255 (1): 26-33.
7 Costello JF, Frühwald MC, Smiraglia DJ, et al. Aberrant CpG-island methylation has non-random and tumour-type specific patterns[J]. Nat Genet, 2000, 24 (2): 132-138.
8 Issa JP. CpG island methylator phenotype in cancer[J]. Nat Rev Cancer, 2004, 4 (12): 988-993.
9 Schneider BG, Pulitzer DR, Brown RD, et al. Allelic imbalance in gastric cancer: an affected site on chromosome arm 3p[J]. Genes Chromosomes Cancer, 1995, 13 (4): 263-271.
10Chetty R, Naidoo R, Tarin M, et al. Chromosome 2p, 3p, 5q and 18q status in sporadic gastric cancer[J]. Pathology, 2002, 34 (3): 275-281.
11Moghbeli M, Moaven O, Memar B, et al. Role of hMLH1 and E-cadherin promoter methylation in gastric cancer progression[J]. J Gastrointest Cancer, 2014, 45 (1): 40-47.
12Chen R, Zhuge X, Huang Z, et al. Analysis of SEMA3B methylation and expression patterns in gastric cancer tissue and cell lines[J]. Oncol Rep, 2014, 31 (3): 1211-1218.
13Shi DT, Han M, Gao N, et al. Association of RASSF1A promoter methylation with gastric cancer risk: a meta-analysis[J]. Tumor Biol, 2014, 35 (2): 943-948.
14Shao Y, Zhang W, Zhang C, et al. High-resolution melting analysis of BLU methylation levels in gastric, colorectal, and pancreatic cancers[J]. Cancer Invest, 2010, 28 (6): 642-648.
15Cao Z, Song JH, Kim CJ, et al. Genetic and epigenetic analysis of the VHL gene in gastric cancers[J]. Acta Oncol, 2008, 47 (8): 1551-1556.
16Leung WK, Yu J, Ng EK, et al. Concurrent hypermethy-lation of multiple tumor-related genes in gastric carcinoma and adjacent normal tissues[J]. Cancer, 2001, 91 (12): 2294-2301.
17Harnack L, Jacobs DR, Nicodemus K, et al. Relationship of folate, vitamin B-6, vitamin B-12, and methionine intake to incidence of colorectal cancers[J]. Nutrition and cancer, 2002, 43 (2): 152-158.
18Davis CD, Uthus EO. DNA methylation, cancer susceptibility, and nutrient interactions[J]. Exp biol Med, 2004, 229 (10): 988-995.
19Zou XP, Zhang B, Zhang XQ, et al. Promoter hyperme-thylation of multiple genes in early gastric adenocarcinoma and precancerous lesions[J]. Hum Pathol, 2009, 40 (11): 1534-1542.
20Kaneda A, Matsusaka K, Sakai E, et al. DNA methylation accumulation and its predetermination of future cancer phenotypes[J]. J Biochem, 2014, 156 (2): 63-72.
(2015-02-23收稿;2015-04-05修回)
·简讯·
《胃肠病学》征订启事
《胃肠病学》创刊于1996年,1999年起正式对国内外公开发行,中国标准连续出版物号:ISSN 1008-7125/CN 31-1797/R,邮发代号:4-624。
《胃肠病学》为消化专业综合性刊物,办刊宗旨是为消化病学领域内的研究成果、临床经验、新观点和各种假说的交流与沟通提供园地,特邀一批国内外著名胃肠病学专家担任编委和顾问,具有较高的学术水准。
《胃肠病学》常设栏目有述评、特约文稿、论著、短篇论著、综述、病例分析与个案报道,并不定期开设共识与指南、国外文献阅读、讲座和学术争鸣等栏目。
《胃肠病学》为月刊,大16开,64页,每期定价为10.00元,全年120.00元,由上海市报刊发行局统一发行。欲订阅本刊的单位或个人,请直接到当地邮局办理订阅手续。
编辑部地址:上海市山东中路145号,邮编: 200001;联系电话: 021-63286942,021-53882318;传真: 021-63286942; Email: gastroenterology88@126.com
网上投稿中心: www.cjge-manuscriptcentral.com
欢迎投稿 欢迎订阅
A Study on CpG Island Methylator Phenotype involving Tumor Suppressor Genes on Chromosome 3p in Gastric CancerHANMei1,SHIDongtao2,CAOJian2,TIANWenyan2,ZHANGHongtao3,CHENWeichang2.1SpecialRequirementWard,2DepartmentofGastroenterology,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou,JiangsuProvince(215006);3LaboratoryofMedicalGenetics,SchoolofBasicMedicine&BiologicalSciences,SoochowUniversity,Suzhou,JiangsuProvince
Correspondence to: CHEN Weichang, Email: 992841662@qq.com
Background: CpG island methylator phenotype (CIMP) involving tumor suppressor gene (TSG) on short arm of chromosome 3 (chromosome 3p) has been found in various types of cancers. However, its correlation with gastric cancer has not been clarified. Aims: To study the clinical significance of CIMP involving TSG on chromosome 3p in gastric cancer. Methods: Methylation specific PCR (MSP) was used to examine methylation profiles for hOGG1, VHL, RAR-B, hMLH1, SEMA3B, RASSF1A, BLU and FHIT harbored in chromosome 3p in 100 gastric cancer and paired paracancerous tissues. High CIMP (CIMP-H) was referred for those samples having four or more synchronously methylated genes. Relationship between CIMP-H and clinicopathological characteristics in gastric cancer was analyzed. Results: Positive methylation rates of VHL (P=0.030), hMLH1 (P<0.001), SEMA3B (P=0.003), RASSF1A (P<0.001) and FHIT (P<0.001) were significantly higher in gastric cancer tissue than in paracancerous tissue. Incidence of CIMP-H rate in gastric cancer tissue was significantly higher than that in paracancerous tissue (44.0%vs. 4.0%,P<0.001). CIMP-H was negatively correlated with degree of tumor differentiation (P=0.004), and positively correlated with lymph node metastasis (P=0.005), but not correlated with gender, age, tumor location, tumor size, depth of infiltration and TNM staging (P>0.05). Conclusions: CIMP on chromosome 3p may occur in early stage of oncogenesis of gastric cancer, and influencing tumor differentiation and lymph node metastasis.
Key wordsStomach Neoplasms;Short Arm of Chromosome 3p;Genes,Tumor Suppressor;
通信作者#本文,Email: 992841662@qq.com
DOI:10.3969/j.issn.1008-7125.2015.10.003

