CLIF-C OFs在非乙型肝炎相关慢性肝病急性失代偿患者中鉴别慢加急性肝功能衰竭的临床研究
CLIF-C OFs在非乙型肝炎相关慢性肝病急性失代偿患者中鉴别慢加急性肝功能衰竭的临床研究
丁茹曾菠陈柳莹李淑婷张楠楠李海*
上海交通大学医学院附属仁济医院消化科上海市消化疾病研究所(200001)

背景:近期欧洲一项针对酒精和丙型肝炎肝硬化急性失代偿(AD)患者的前瞻性研究表明,慢性肝功能衰竭联盟-器官功能衰竭评分(CLIF-C OFs)是区分慢加急性肝功能衰竭(ACLF)的有效诊断标准。目的:探讨CLIF-C OFs在非乙型肝炎相关慢性肝病并发AD患者中鉴别ACLF的有效性。方法:筛选并纳入2005年1月-2010年12月上海仁济医院非乙型肝炎相关慢性肝病AD患者274例,按CLIF-C OFs标准分为入院时ACLF组、入院28 d-ACLF组和非ACLF组。分析ACLF组和非ACLF组的临床和实验室指标、病情严重程度和短期死亡率。结果:入院时ACLF患者40例,27例为入院28 d-ACLF组,非ACLF组207例。ACLF组TB、Cr、INR、ALT、AST、ALB、WBC、Child-Pugh、CTP、MELD、MELD-Na评分均显著高于非ACLF患者(P<0.05),且年龄更轻(P<0.01)。ACLF组肝、肾、脑、凝血、循环、肺衰竭的发生率均显著高于非ACLF组(P<0.01),28 d和90 d死亡率均显著升高(P<0.001)。入院28 d-ACLF组上述指标与入院时ACLF组相比差异均无统计学意义(P>0.05)。入院时TB水平、28 d内合并感染为进展为ACLF的危险因素(P<0.05)。结论:非乙型肝炎相关慢性肝病并发AD患者中确实存在一群疾病程度更严重的ACLF群体,CLIF-C OFs标准可将ACLF患者从非乙型肝炎相关慢性肝病并发AD患者中区分出来。
关键词肝病;急性失代偿;多器官功能衰竭;慢加急性肝功能衰竭
慢加急性肝功能衰竭(acute-on-chronic liver failure, ACLF)概念最初于1995年由日本学者提出[1],由于其病因、病理生理机制和临床表现复杂[2-7],国际上尚未形成统一认识。2010年美国肝病学会和欧洲肝病协会共同提出以多脏器功能衰竭和短期高死亡率为特征的ACLF诊断意见[8]。在此框架下,欧洲肝病协会-慢性肝功能衰竭联盟制定了在肝硬化并发急性失代偿(acute decompensation, AD)患者中诊断ACLF的标准,即慢性肝功能衰竭-序贯性器官衰竭评分(CLIF-SOFA)[9],并于1年后提出了简化标准,即慢性肝功能衰竭联盟-器官功能衰竭评分(CLIF-C OFs)[10]。上述研究对象主要是以酒精和丙型肝炎为病因的肝硬化合并AD的欧洲患者,而我国非乙型肝炎相关慢性肝病的病因尚有相当一部分自身免疫性肝病、血吸虫性肝病等,且亚太地区慢性肝病基础还包括慢性肝炎[6],因此,CLIF-C OFs标准在我国非乙型肝炎相关慢性肝病AD患者中诊断ACLF的有效性尚不明确。本研究拟对此进行探讨分析。
对象与方法
一、临床资料
收集2005年1月-2010年12月上海仁济医院住院治疗的非乙型肝炎相关慢性肝病并发AD患者1 164例。纳入标准:年龄18~80岁;明确有非乙型肝炎相关慢性肝病病史>6个月;明确此次有AD表现,即临床诊断腹水、食管胃底静脉曲张破裂出血、肝性脑病(HE)、感染[11-17]。排除标准:年龄>80岁或<18岁;合并HBV感染:既往有乙型肝炎病史或HBsAg阳性超过6个月,且现在HBsAg和(或)HBV DNA仍为阳性者;合并肿瘤;合并其他明显影响预后的疾病,包括严重的心、肺、肾、结缔组织病、代谢性疾病等;长期使用免疫抑制剂(自身免疫性肝病患者除外)。
二、实验室指标和肝功能评分
实验室指标包括:①血常规:WBC、PLT;②凝血指标:国际标准化比率(INR);③生化指标:ALT、AST、γ-GT、总胆红素(TB)、白蛋白(ALB)、血清钠(Na)、血清肌酐(SCr);④病毒学指标:HBV-DNA、HCV-RNA(采用荧光定量PCR法,试剂盒由中山大学达安基因股份有限公司提供)、乙肝5项标记、HCV-Ab(采用ELISA法检测,试剂盒由上海科华生物工程股份有限公司提供)。依据生化和临床病史体征计算Child-Pugh、Child-Turcotte-Pugh (CTP)、终末期肝病模型(MELD)、MELD-Na和CLIF-C OFs评分(表1)。ACLF 1级符合以下1条:①单独肾衰竭,即肌酐(Cr)≥176.8 μmol/L或已使用肾替代疗法。②单独的肝或凝血或循环或呼吸衰竭,且Cr为132.6~168.0 μmol/L或HE为Ⅰ~Ⅱ级。③HE为Ⅲ~Ⅳ级且Cr为132.6~168.0 μmol/L。ACLF 2级有2个器官衰竭;ACLF 3级有3个或以上器官衰竭。
三、随访
以入院为起始,发生肝病原因死亡或行肝移植(LT)为终点,随访终点时间为2014年7月31日,通过电话随访终点指标,记录患者行LT时间、确诊肝细胞肝癌时间、末次门诊随访时间、失访或研究结束时未死亡时间为截尾时间,此数据为截尾数据。

表1 CLIF-C OFs评分[10]
四、统计学分析
结果
一、一般情况
最终共纳入274例患者,男148例,女126例;平均年龄(59.6±10.6)岁;未明确病因89例,明确病因185例,其中酒精性肝病68例,血吸虫性肝病53例,自身免疫性肝病47例,丙型肝炎16例,代谢性肝病3例,酒精加丙型肝炎2例。Child-Pugh评分8(7,11)分,CTP评分4(2,6)分,MELD评分8(3,14)分,MELD-Na评分 9(4,17)分。
依据入院前病史、组织学、入院时CT/MRI影像学、实验室检查有肝细胞合成功能障碍和门静脉高压症证据,272例患者临床诊断为肝硬化,其中以肝硬化为疾病基础行LT手术者27例,1例行肝穿刺活检;2例无肝硬化诊断依据。
入院的主要原因依次为消化道出血133例、腹水89例、HE 22例、感染18例;204例患者有诱因,其中2个或以上诱因者23例,其余70例未找到明确诱因。
28 d、90 d、180 d和1年的失随访率分别为2.2%(6/274)、12.0%(33/274)、12.8%(35/274)和18.2%(50/274)。由于LT对疾病预后影响较大,因此本研究中所有死亡率比较均为LT-free死亡率,28 d和90 d总体的LT-free死亡率分别为 12.0%(33/274)和19.0%(52/274)。
二、ACLF组与非ACLF组的比较
274例患者中,40例入院达到ACLF诊断标准,234例未达到ACLF,其中27例于入院28 d内发展为ACLF(28 d-ACLF组),因此,最终将入选者分为ACLF组67例和非ACLF组207例。ACLF组的年龄低于非ACLF组(P=0.003)。
ACLF组的主要病因为酒精和自身免疫性肝病,其比例显著高于非ACLF组(P<0.05),非ACLF组主要为未明确病因和血吸虫性肝病,其比例显著高于ACLF组(P<0.05)。
ACLF组和非ACLF组诱因均以消化道出血最常见,分别占29.9%和54.6%,组间差异有统计学意义(P<0.001)。ACLF组诱因为感染的比例显著高于非ACLF组(P<0.05),而两组活动性饮酒比例和无诱因者比例均无明显差异(P>0.05)。
ACLF组以肝功能衰竭最常见(53.7%),各器官衰竭的发生率均显著高于非ACLF组(P<0.01)。与非ACLF组相比,ACLF组WBC计数、TB、SCr、INR、ALT、AST均显著升高(P<0.05),ALB降低;Child-Pugh、CTP、MELD、MELD-Na评分均显著升高(P<0.001);28 d和90 d的LT-Free死亡率均显著升高(P<0.001)(表2)。
三、ACLF整个群体的特征
ACLF患者中,1级25例(37.3%),2级28例(41.8%),3级14例(20.9%)。对发展为ACLF时的数据进行分析显示,三组肝功能衰竭和肾衰竭所占比例差异无统计学意义,而脑、凝血、呼吸、循环衰竭的比例均随ACLF分级的增加而升高(P<0.05),Child-Pugh、CLIF-C OFs、MELD评分以及28 d 和90 d的LT-free死亡率亦随ACLF分级的增加而升高(P<0.05)(表3)。
四、入院时ACLF与28 d-ACLF患者间的比较
28 d-ACLF组的ACLF分级与入院时ACLF组相比差异有统计学意义(P<0.05),而患者性别、年龄、诱因、器官衰竭情况、实验室指标以及LT-free死亡率均无明显差异(P>0.05)(表4)。
五、28 d内重症化为ACLF的危险因素分析
对28 d-ACLF组和28 d-非ACLF组基线资料的分析结果显示,两组病因为酒精、血吸虫的比例、诱因为消化道出血、活动性饮酒、其他(含药物、劳累、手术)的比例、肝功能衰竭、TB、INR、ALB、ALT、AST、Na水平和28 d内合并感染的比例相比差异有统计学意义(P<0.05)(表5)。Logistic回归分析显示,患者入院时TB水平、28 d内合并感染为进展为ACLF的危险因素(表6)。
讨论
由于ACLF的异质性和复杂性,全球对其定义尚未统一[4-7]。西方学者主要认为ACLF是在肝硬化基础上,通常由急性事件诱发的肝功能AD,发展至器官衰竭,短期死亡率较高[9]。病理生理机制方面提出“PIRO”概念[7]。以此为框架,2011年欧洲肝病协会-慢性肝功能衰竭联盟开展了世界上第1个通过循证依据建立ACLF诊断标准的临床研究[9],并于1年后提出了简化诊断标准CLIF-C OFs[10]。由于欧洲肝硬化病因构成的特点,该研究针对的人群病因以酒精和丙型肝炎为主,几乎无乙型肝炎相关肝病患者。我国慢性肝病的病因虽以乙型肝炎为主,但仍有一部分非乙型肝炎相关慢性肝病患者, 包括酒精、丙型肝炎、自身免疫性肝病、血吸虫性肝病、代谢性肝病等。因此,我国非乙型肝炎相关慢性肝病的病因构成更为复杂, 同时由于东西方人群本身存在差异性,以酒精和丙型肝炎为研究对象得出的CLIF-C OFs是否适用于我国非乙型肝炎相关ACLF患者尚待进一步明确。

表2 ACLF组与非ACLF组患者基线资料比较

表4 入院时ACLF组与28 d-ACLF组资料比较
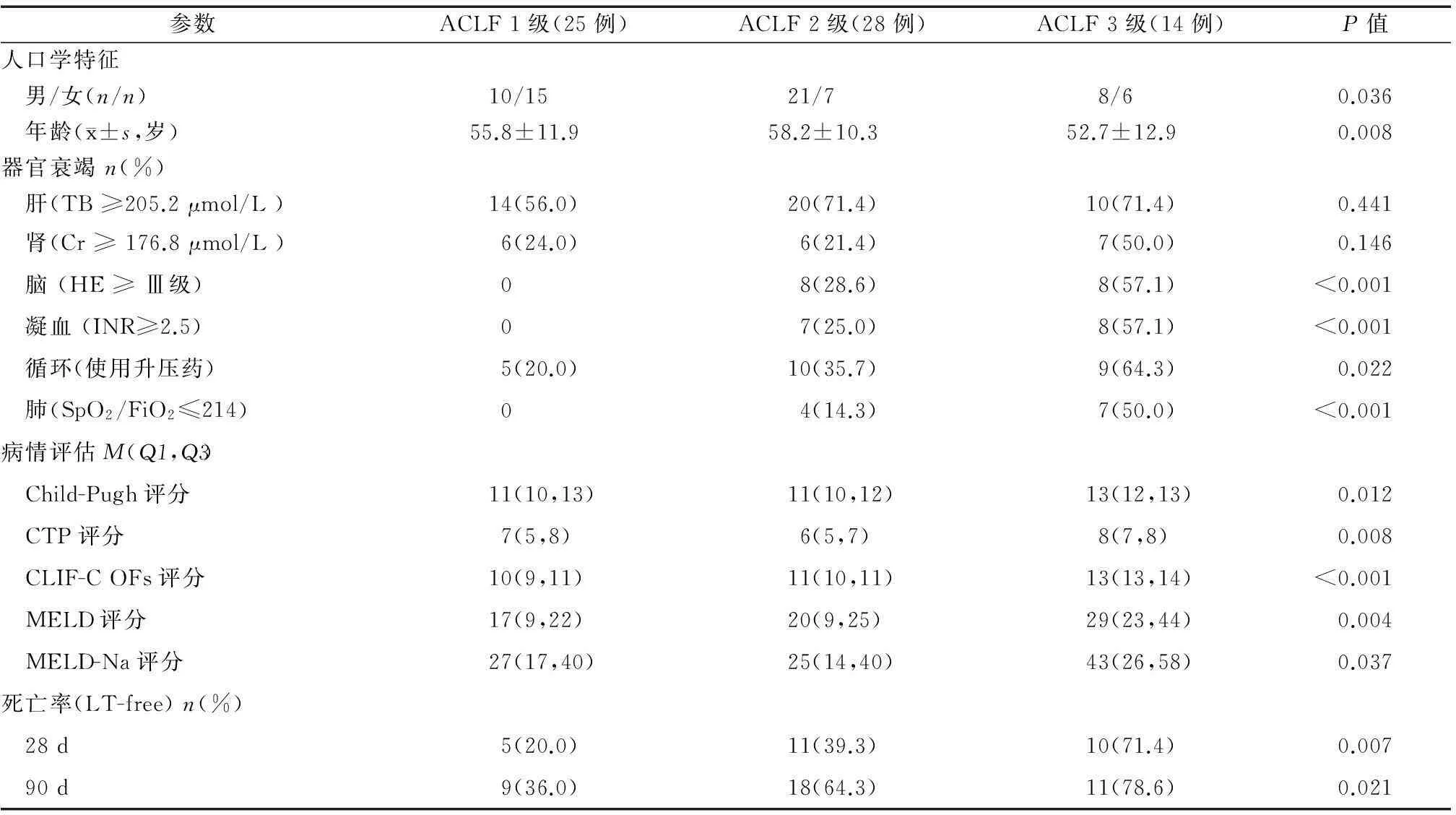
表3 ACLF患者不同分级间的比较

表6 ACLF危险因素的Logistic回归分析
本研究274例患者入院时诊断为ACLF 40例,27例在入院28 d内发展为ACLF,最终未发展至ACLF者207例,相应的28 d和90 d死亡率分别为40.0%、37.0%、3.4%和55.0%、59.3%、6.8%。Moreau等[9]的研究中,入院时ACLF 303例,112例在入组28 d内进展为ACLF,928例非ACLF患者,28 d和90 d死亡率分别为33.9%、29.6%、1.9%和51.2%、51.7%、9.7%。由此可见,本研究入院时诊断ACLF患者的比例(14.6%)明显低于欧洲研究的22.6%。究其原因,一是与欧洲相比,本研究为上海仁济医院开展的单中心回顾性研究,虽严格按照纳入和排除标准入组病例,仍存在遗漏可能;二是欧洲研究人群中70%为酒精肝病,其肾衰竭的比例明显高于其他病因患者[9],而本研究酒精性肝病的比例仅24.8%,这可进一步解释本研究入院诊断为ACLF患者的比例较低,也可解释我国ACLF患者肾衰竭比例低于欧洲。此外,本研究入院时ACLF组和28 d-ACLF组的短期死亡率均高于欧洲研究,其原因可能为欧洲研究中ACLF 1级患者的比例明显高于本研究(48.8%对37.3%)[9],这种差异可对预后造成影响。
按CLIF-C OFs标准,ACLF 1、2和3级的28 d和90 d的LT-free死亡率分别为20.0%、39.3%、71.4%和36.0%、64.3%、78.6%;与欧洲研究中ACLF患者短期死亡率随分级升高而升高的结果类似[9]。对28 d内发展为ACLF的危险因素分析显示,入院时TB水平和28 d内合并感染为危险因素,但由于28 d内发展为ACLF的例数较少,今后可进一步扩大样本量或开展前瞻性研究对ACLF的危险因素进行深入探讨。
综上所述,本研究显示尽管我国非乙型肝炎肝硬化患者的病因构成与欧洲患者有明显差异,但来自欧洲的CLIF-C OFs标准可从我国非乙型肝炎相关慢性肝病AD患者中区分出一群疾病严重程度更重的独立的ACLF群体。ACLF患者从年龄、肝脏疾病病情的严重程度、诱因、器官衰竭、短期死亡率等方面均可与非ACLF相区分。

表5 28 d-ACLF与28 d-非ACLF基线资料的比较
参考文献
1Ohnishi H, Sugihara J, Moriwaki H, et al. Acute-on-chronic liver failure [Article in Japanese] [J]. Ryoikibetsu Shokogun Shirizu, 1995 (7): 217-219.
2 Jalan R, Williams R. Acute-on-chronic liver failure: pathophysiological basis of therapeutic options[J]. Blood Purif, 2002, 20 (3): 252-261.
3 Sen S, Williams R, Jalan R. The pathophysiological basis of acute-on-chronic liver failure[J]. Liver, 2002, 22 (Suppl 2): 5-13.
4 Graziadei IW. The clinical challenges of acute on chronic liver failure[J]. Liver Int, 2011, 31 (Suppl 3): 24-26.
5 Aithal GP. Defining ‘acute on chronic liver failure’: an identity crisis! [J]. Indian J Gastroenterol, 2010, 29 (5): 177-180.
6 Sarin SK, Kumar A, Almeida JA, et al. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific Association for the study of the liver[J]. Hepatol Int, 2009, 3 (1): 269-282.
7 Jalan R, Gines P, Olson JC, et al. Acute-on chronic liver failure[J]. J Hepatol, 2012, 57 (6): 1336-1348.
8 Olson JC, Wendon JA,Kramer DJ, et al. Intensive care of the patient with cirrhosis[J]. Hepatology, 2011, 54 (5): 1864-1872.
9 Moreau R, Jalan R, Gines P, et al. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis[J]. Gastroenterology, 2013, 144 (7): 1426-1437.
10Jalan R, Saliba F, Pavesi M, et al. Development and validation of a prognostic score to predict mortality in patients with acute on chronic liver failure[J]. J Hepatol, 2014, 61 (5): 1038-1047.
11Moore KP, Wong F, Gines P, et al. The management of ascites in cirrhosis: report on the consensus conference of the International Ascites Club[J]. Hepatology, 2003, 38 (1): 258-266.
12Butt AK, Khan AA, Alam A, et al. Predicting hospital mortality in cirrhotic patients: comparison of child-pugh and acute physiology, age and chronic health evaluation (APACHE Ⅲ) scoring systems[J]. Am J Gastroenterol, 1998, 93 (12): 2469-2475.
13Garcia-Tsao G, Bosch J. Management of varices and variceal hemorrhage in cirrhosis[J]. N Engl J Med, 2010, 362 (9): 823-832.
14Blei AT, Cordoba J; Practice Parameters Committee of the American College of Gastroenterology. Hepatic encephalopathy[J].Am J Gastroenterol, 2001, 96 (7): 1968-1976.
15肝性脑病诊断治疗专家委员会. 肝性脑病诊断治疗专家共识[J]. 中华实验和临床感染病杂志(电子版), 2009, 3 (4): 449-473.
16Fattovich G, Bortolotti F, Donato F, et al. Natural history of chronic hepatitis B: special emphasis on disease progression and prognostic factor [J]. J Hepatol, 2008, 48 (2): 335-352.
17Fernández J, Gustot T. Management of bacterial infections in cirrhosis[J]. J Hepatol, 2012, 56 (Suppl 1): S1-S12.
(2015-02-02收稿;2015-08-10修回)
Clinical Study on CLIF-C OFs for Distinguishing Acute-on-chronic Liver Failure in Non-HBV-related Chronic Liver Disease with Acute DecompensationDINGRu,ZENGBo,CHENLiuying,LIShuting,ZHANGNannan,LIHai.DivisionofGastroenterologyandHepatology,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity;ShanghaiInstituteofDigestiveDisease,Shanghai(200001)
Correspondence to: LI Hai, Email: haili_17@126.com
Background: A recent perspective European study has shown that Chronic Liver Failure-Consortium Organ Failure score (CLIF-C OFs) is an effective diagnostic criteria for acute-on-chronic liver failure (ACLF) in alcoholic or hepatitis C virus patients with acute decompensation (AD). Aims: To assess the efficacy of CLIF-C OFs for distinguishing ACLF in non-hepatitis B virus (HBV)-related chronic liver disease patients with AD. Methods: A total of 274 consecutive non-HBV-related chronic liver disease patients with AD from Jan. 2005 to Dec. 2010 at Shanghai Ren Ji Hospital were enrolled. Patients were divided into three groups: ACLF at admission, ACLF developed within 28-day and non-ACLF according to CLIF-C OFs criteria. Clinical and biochemistry characteristics, severity of the disease and 28-day and 90-day mortality data between ACLF and non-ACLF groups were analyzed. Results: Of the patients assessed, 40 had ACLF at admission, 27 had ACLF developed within 28-day, 207 remained not having ACLF. Patients in ACLF group had higher TB, Cr, INR, ALT, AST, ALB, WBC, score of Child-Pugh, CTP, MELD, MELD-Na than non-ACLF patients (P<0.05), and were younger in age (P<0.01). Incidences of hepatic, renal, cerebral, coagulation, circulation and lung failure, 28-day mortality, 90-day mortality were significantly higher in ACLF group than in non-ACLF patients (P<0.01). However, no significant differences were seen in the characteristics mentioned above between ACLF at admission group and ACLF developed at 28-day group (P>0.05). TB level at admission and infection occurred within 28-day were the risk factors for developing ACLF (P<0.05). Conclusions: ACLF constitutes a more severe subgroup in non-HBV-related chronic liver disease patients with AD, and CLIF-C OFs could help to distinguish ACLF patients out from non-HBV-related chronic liver disease patients with AD.
Key wordsLiver Diseases;Acute Decompensation;Multiple Organ Failure;Acute-On-Chronic Liver Failure
通信作者*本文,Email: haili17@126.com
DOI:10.3969/j.issn.1008-7125.2015.10.002
- 胃肠病学的其它文章
- 胃癌3号染色体短臂抑癌基因CpG岛甲基化表型研究

