氟西汀对早期应激大鼠行为及海马S100B表达的影响
杨 坤,于 雪,王敬兰,胡义秋
(1.天津市安定医院,天津 300222; 2.天津市南开医院,天津 300100; 3.湖南农业大学科学技术师范学院,长沙 410128)
实验研究
氟西汀对早期应激大鼠行为及海马S100B表达的影响
杨 坤1,于 雪1,王敬兰2,胡义秋3
(1.天津市安定医院,天津 300222; 2.天津市南开医院,天津 300100; 3.湖南农业大学科学技术师范学院,长沙 410128)
目的:研究氟西汀对早期应激模型大鼠行为及海马星形胶质源性蛋白(S100B)的影响。 方法:将孕17 d 的14只大鼠所生的雄性乳鼠60只,随机分为3组:正常对照组(对照组)、慢性早期应激抑郁模型组(抑郁模型组)及早期慢性应激氟西汀干预组(氟西汀组),每组20只。抑郁模型组和氟西汀组大鼠经历28 d早期生活应激,对照组不予任何处理。后各组灌胃(氟西汀组给予氟西汀10 mg/kg,抑郁模型组和对照组给予同体积蒸馏水)28 d。采用旷场实验、糖水偏爱实验于出生后第29日和第57日天检测大鼠的行为。采用Western blot检测第57日各组海马S100B的表达。结果:①旷场实验:于出生后第29日,抑郁模型组和氟西汀组的水平得分和垂直得分低于对照组,而潜伏期均显著长于对照组(P<0.05);各组灌胃28 d后(出生后第57日),氟西汀组的水平得分与垂直得分均显著上升,而潜伏期显著下降,与抑郁模型组相比,差异具有统计学意义(P<0.05)。②糖水偏爱实验:末次灌胃后(第57日)抑郁模型组糖水消耗率(45±8.5)% 显著低于氟西汀组(67±3.6)%和对照组(62±8.1)% (P<0.05)。③氟西汀组和对照组的海马S100B表达显著高于抑郁模型组(P<0.05)。结论: 氟西汀能够改善早期应激抑郁模型大鼠的行为能力和激活海马星形胶质细胞活性。
氟西汀,早期应激,抑郁,海马,S100B
迄今为止,抑郁症的病因及发病机制尚不清楚。近年来的研究表明,S100B(星形胶质源性蛋白)能够调节神经元可塑性及神经元的存活,可能在抑郁症病理生理机制和抗抑郁剂疗效方面起重要作用[1-5]。氟西汀属于一种选择性5-羟色胺再摄取双重抑制剂(SSRIs),是目前应用较广泛的一种抗抑郁剂,然而,氟西汀对早期应激大鼠海马的S100B表达是否有影响尚未见报道。因此本研究通过对早期应激模型大鼠应用抗抑郁剂氟西汀治疗,探讨氟西汀对抑郁模型大鼠行为及海马S100B表达水平的影响。
1 材料
1.1 试剂与仪器 氟西汀原料药(南京德宝生化器材有限公司),大鼠S100B第一抗体(美国Abcom公司),二抗及GAPDH(甘油醛-3-磷酸脱氢酶)(联科生物公司),BCA蛋白浓度试剂盒及ECL化学发光剂(美国Thermo公司)。高速低温离心机(德国Eppendorf公司),蛋白质电泳仪、酶标仪及蛋白质电泳转膜仪(Bio-Rad公司),纯水系统及PVDF膜(美国Millipore公司)。
1.2 实验动物 健康孕17 d的SD大鼠14只,清洁级,购自中国医学科学院放射所实验动物中心(实验动物机构许可证号:SCXK津2005-0001),标记后以混合配方饲料喂养,在明暗周期为12 h/12 h(光照时间7:00-19:00)的条件下饲养于铁笼中,环境温度控制在22~24 ℃。自由获得饲料和饮水。其所生雄性乳鼠作为实验对象。雄性乳鼠第21日断奶,第29日与母鼠分笼饲养,自由获得饲料和饮水。
2 方法
2.1 旷场实验方法 采用的敞箱为立方体,高为60 cm,长宽均为100 cm,将其放入灯光暗淡的房间中,底面由体积相等的100个方格组成,以动物穿越底面格子数为水平运动得分,每一格计1分。直立次数为垂直运动得分,只要动物双足离开底面并放下双足计1分。每次旷场试验每只动物测定一次,每次5 min。
2.2 糖水偏爱实验方法 从实验前日晚上8点到第2日糖水偏爱实验前,大鼠被剥夺饮水。从第2日起对大鼠进行糖水偏爱实验(下午2点到5点),1次/d,连续4 d。实验中,大鼠笼子里放置两个瓶子,一个瓶子装有饮用水,另一个瓶子装有1%糖精钠溶液,每次糖水偏爱实验结束后自由进食水,两个瓶子的位置每日发生变化。慢性轻度应激大鼠糖精溶液摄入比率降低为兴趣缺乏的标志。
2.3 动物分组及处理措施 将60只刚出生的雄性大鼠随机分为3组各20只:①正常对照组(对照组),与母鼠同笼正常饲养,出生后21 d断奶,第29日与母鼠分笼饲养;②慢性应激抑郁模型组(抑郁模型组)和③氟西汀干预组(氟西汀组),从出生第2日起大鼠经历28日慢性早期生活应激,出生后21日断奶,第29日与母鼠分笼饲养。从第29日起,氟西汀组进行氟西汀灌胃4周,1次/d,氟西汀给药剂量为10 mg/kg,溶于蒸馏水中,对照组和抑郁模型组以等体积的蒸馏水灌胃4周。
2.4 大鼠早期生活应激模型建立及抑郁模型验证 慢性早期生活应激方案根据Avishai-Eliner等的方法[6,7]。该应激方法是将抑郁模型组和氟西汀组出生后的新生大鼠在生后第2 d至第29日,每天上午9:00开始将幼鼠与母鼠一起被置于限制垫料的笼中(垫料由一薄层卫生纸组成,母鼠只能用之构筑不完整的巢),3 h后将幼鼠和母鼠再归到原来的未限制垫料的鼠笼(含有足够木屑垫料),连续28 d。对照组和母鼠位于正常笼内,含有足够木屑垫料,不予任何处理。
对三组大鼠分别在第29日和第57日进行旷场实验。另外三组大鼠每组各取10只,分别于第29日和第57日(末次灌胃)进行糖水偏爱实验。第29日起进行的糖水偏爱实验结果表明,抑郁模型组和氟西汀组糖水摄入率较对照组显著降低(P<0.05),表明慢性早期生活应激抑郁模型造模成功。
2.5 各组海马标本制备 每组大鼠各取10只,于末次灌胃后30 min迅速断头处死及取出脑组织,迅速游离海马,-80 ℃冰箱中保存备用。从-80 ℃冰箱中取出各组大鼠的海马组织进行称重,根据组织重量、比例算出各个组织所需加入裂解液的体积。各组大鼠的海马组织置于2 ml容积玻璃匀浆器球部中,按照1∶10体积加入裂解液,在预冷的蛋白质抽提缓冲液中匀浆,冰上裂解30 min,将裂解液移至1.5 ml容积离心管中,12 000 r/min、4 ℃离心15 min去除细胞碎片,吸取上清液,即为细胞总蛋白质。用BCA蛋白浓度测定试剂盒测定蛋白质浓度,根据蛋白浓度计算上样量,每个上样孔上样20 μg,调整每个样品体积,加入5×聚丙烯酰胺凝胶上样缓冲液,隔水煮沸5 min使蛋白变性,立即用于western blotting检测。
2.6 Western blot检测大鼠海马S100B蛋白的表达 ①用20 μg蛋白质在10%或14%SDS-聚丙烯酰胺凝胶中电泳分离,一般情况聚丙烯酰胺凝胶电泳时间为2 h,电压为120 V。②样品蛋白经分离后,电转移至PVDF膜,一般情况转移时间为2 h,电流为380 mA。③转膜完成后,印迹膜在含5%脱脂奶粉或1%BSA的TBS缓冲液中阻断 ,一般封闭1 h。④从封闭液中取出PVDF膜,用滤纸吸去残留液体后,加入phospho-ERK-1/2、 ERK-1/2、phospho-NFkB、NFkB一抗溶液(抗体用含5%的脱脂奶粉或10% BSA的TBS缓冲液1∶1 000~1∶2 000稀释)中,4 ℃孵育12 h。⑤从一抗液中取出PVDF膜,TBS缓冲液漂洗膜3次,每次15 min。⑥然后在HRP标记的羊抗兔和羊抗鼠二抗溶液(抗体用含5%脱脂奶粉的TBS缓冲液1∶5 000稀释)中室温孵育1 h。⑦从二抗液中取出PVDF膜,TBS缓冲液漂洗膜3次,每次15 min。⑧加等量的发光试剂A、B液,ECL检测试剂盒显带,暗室内于曝光夹中曝光,根据信号强弱调整曝光时间,曝光、显影和定影。⑨X光片上的信号用图象分析仪(Molecular Dynamics)进行光密度扫描分析。
2.7 统计学分析 采用SPSS 17.0统计软件进行处理。计量资料均以均数±标准差表示。Western blot结果以各处理组(抑郁模型组和氟西汀干预组)比对照组的相对灰度值进行统计分析,多组比较采用方差分析,两两比较采用LSD法。显著性检验水准P<0.05。
3 结果
3.1 各组大鼠干预前后旷场实验结果比较 旷场实验主要研究大鼠的空间探索能力。水平得分表示大鼠穿越的格子数量,垂直得分表示大鼠站立的次数,潜伏期表示大鼠在中央格停留的时间。第29日,抑郁模型组和氟西汀组的水平得分和垂直得分低于对照组,而潜伏期均显著长于对照组(P<0.05),这表明抑郁模型组和氟西汀组造模成功。各组灌胃28 d后,氟西汀组的水平得分与垂直得分均显著上升,而潜伏期显著下降,与抑郁模型组相比,差异具有统计学意义(P<0.05),与对照组相比差异无统计学意义 (P>0.05),见表1。

表1 灌胃前(第29日)和灌胃28 d时(第57日)各组大鼠旷场实验结果比较±SE)
注:与对照组比较,*P<0.05;与抑郁模型组相比,△P<0.05
3.2 各组大鼠糖水偏爱实验结果比较 糖水偏爱实验主要检测大鼠的快感缺失情况。表2结果显示,经单因素方差分析,各组糖水消耗率间差异具有统计学意义(F=26.137,P<0.05),多重比较结果显示,对照组和抑郁模型组糖水消耗率差异具有统计学意义,抑郁模型组和氟西汀组糖水消耗率差异具有统计学意义,而对照组和氟西汀组糖水消耗率无差异。三组大鼠糖水摄入及总液体摄入比较:抑郁模型组的糖水摄入量较对照组和氟西汀组少(F=26.009,P<0.05),而三组液体总摄入量无显著性差异。
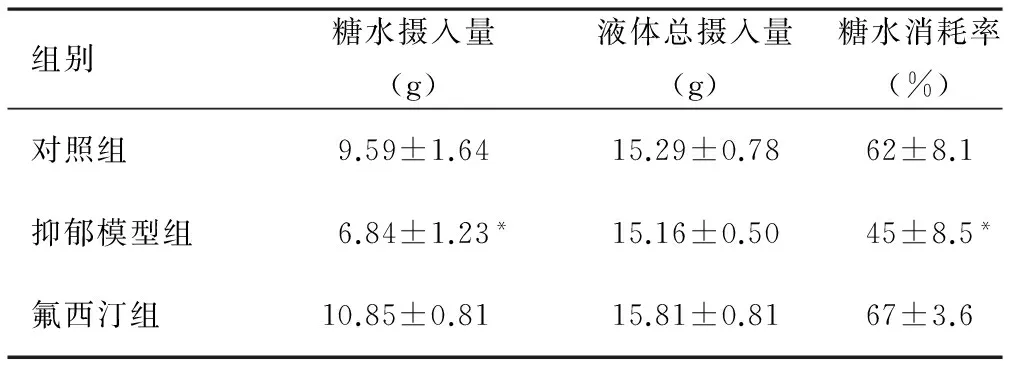
表2 各组灌胃后(第57日)糖水摄入量、液体总摄入量及糖水消耗率比较
注:与对照组比较,*P<0.05
3.3 各组大鼠海马S100B表达的影响 从图1可见,经单因素方差分析,三组之间前额皮层S100B表达水平显著差异(F=519.877,P<0.05)。抑郁模型组大鼠海马S100B表达水平明显低于对照组和氟西汀组(P<0.05), 对照组大鼠海马S100B表达水平与氟西汀组的差异无统计学意义(P>0.05)。

对照组 抑郁模型组 氟西汀组
GAPDH(甘油醛-3-磷酸脱氢酶)是内参抗体
图1 各组大鼠海马S100B的表达
4 讨论
早期应激能够较好的诱导大鼠抑郁模型,其诱导的抑郁模型具有抑郁病人的临床症状。许多研究表明,应激可以影响突触可塑性及海马功能,导致学习与记忆缺陷以及情感障碍,用抗抑郁剂可以治疗。应激对成年大鼠的影响通常是短暂的,而早期应激对青年期海马功能的损害则比较持久。动物模型以及临床研究显示,早期应激增加了青少年或者成年抑郁的易感性[8]。本实验采用28 d养育在比较差的筑巢材料里来构建实验用抑郁症模型,从第29日旷场实验中得出抑郁模型组和氟西汀组的水平得分和垂直得分低于对照组,而潜伏期均显著长于对照组(P<0.05)。糖水偏爱实验中可以看出模型大鼠经历28 d早期应激后其糖水消耗率较对照组显著下降,糖水消耗作为快乐改变的一种指标,糖水消耗率下降代表兴趣缺乏、快感缺失。表明了抑郁模型组和氟西汀组造模成功,并且能够较好的模拟抑郁症病人的临床症状。
氟西汀是一种应用广泛的SSRI类抗抑郁剂,其能够通过选择性抑制5-HT的重摄取,提高中枢5-HT的功能,从而改善抑郁症患者的临床症状。并且,临床上氟西汀既能够应用于成人抑郁症,也能应用在儿童抑郁症患者群体中,氟西汀是少数几个能应用于儿童患者的抗抑郁剂。本研究中,早期应激大鼠糖水摄入能力受损, 4周的氟西汀治疗能够增加早期应激模型大鼠糖水消耗率,并且旷场实验中氟西汀组与模型组比较,其水平得分与垂直得分均显著上升,而潜伏期显著下降,差异具有统计学意义,表明氟西汀对抑郁模型鼠的空间探索能力有改善作用; 对照组与氟西汀组比较,差异无统计学意义, 表明4周的氟西汀治疗对大鼠的情绪情况及空间探索能力改善到正常水平。
抑郁症是一种严重的精神障碍,具有高复发率、高致残率、高病死率,终生患病率约15%。目前抗抑郁剂被广泛地应用于抑郁症的治疗,但至少50%患者药物反应较差,需要数周抗抑郁剂治疗70%的患者才显疗效,这种反应延迟与单胺能系统水平增加不一致。推测单胺神经递质系统的适应可能是海马神经再生过程所致。而S100B是一种星形胶质蛋白,主要由中枢神经系统星形胶质细胞所产生,参与细胞增殖的调节、细胞间联系、神经元分化和存活、突触可塑性和传导胞内信号等生理功能,但若其在人体中含量过高则具有神经毒性[9],影响海马的神经再生和神经可塑性。本研究中早期应激大鼠海马S100B表达下降,表明早期应激影响大鼠海马神经再生及神经可塑性过程。研究表明,S100B转基因(S100B过表达)青年期小鼠在稳定的社会环境中焦虑相关行为减少,而在不稳定的社会环境中,S100B过表达的小鼠在成年期海马显示更多的新生神经细胞,影响成年期小鼠的行为和神经再生能力[10]。各组干预后大脑海马S100B表达进行检测后发现,模型组的S100B表达较对照组和氟西汀组显著降低,对照组和氟西汀组S100B表达无显著差异,说明慢性抗抑郁剂氟西汀治疗能够使早期应激所致的海马下降的S100B表达增加,氟西汀能激活星形胶质细胞的活性。Rong等[11]研究发现慢性轻度应激降低海马S100B蛋白水平,抗抑郁剂氟西汀能够增加慢性轻度应激大鼠模型海马S100B水平。虽然所采取的动物应激模型不同,但研究结果与之相似,这更加证实氟西汀能够使应激诱导的海马下降的S100B水平恢复至正常。另有研究表明,S100B是神经胶质营养因子,S100B可能影响5-HT能神经纤维,反之亦然,5-HT能够影响S100B的表达[12]。因此,推测氟西汀对早期应激S100B的影响可能经由5-HT发挥作用,激活星形胶质细胞活性。未来有待进一步探讨抑郁症中氟西汀对S100B的作用机制。
综上所述,氟西汀能够改善早期应激诱导的抑郁大鼠的行为能力,激活海马星形胶质细胞活性。
1 Schroeter M L, Steiner J, Schönknecht P,etal.Further evidence for a role of S100B in mood disorders: a human gene expression mega-analysis[J]. J Psychiatr Res, 2014 ,53:84-86
2 Schroeter M L, Steiner J, Mueller K. Glial pathology is modified by age in mood disorders-a systematic meta-analysis of serum S100B in vivo studies [J]. J Affect Disord, 2011, 134:32-38
3 Schroeter M L, Sacher J, Steiner J,etal. Serum S100B represents a new biomarker for mood disorders [J]. Curr Drug Targets, 2013,14(11):1237-1248
4 Yang K, Xie G R, Hu Y Q,etal. The effects of gender and numbers of depressive episodes on serum S100B levels in major depression [J]. J Neural Transm, 2008,115:1687-1694
5 Yang K, Xie G R, Hu Y Q,etal. Association study of astrocyte-derived protein S100B gene polymorphisms with major depressive disorder in Chinese individuals [J]. The Canadian Journal of Psychiatry,2009,54(5):312-319
6 Avishai-Eliner S, Eghbal-Ahmadi M, Tabachnik E,etal.Down-regulation of hypothalamic corticotropin-releasing hormone messenger ribonucleic acid (mRNA) precedes early-life experience-induced changes in hippocampal glucocorticoid receptor mRNA[J].Endocrinology,2001,142(1):89-97
7 Avishai-Eliner S, Gilles E E, Eghbal-Ahmadi M,etal.Altered regulation of gene and protein expression of hypothalamic-pituitary-adrenal axis components in an immature rat model of chronic stress[J]. J Neuroendocrinol,2001,13(9):799-807
8 Sánchez M M, Ladd C O, Plotsky P M. Early adverse experience as a developmental risk factor for later psychopathology: evidence from rodent and primate models [J].Dev Psychopathol,2001,13(3):419-449
9 Donato R, Cannon B R, Sorci G,etal. Functions of S100 proteins [J]. Curr Mol Med,2013,13(1):24-27
10 Buschert J, Hohoff C, Touma C,etal. S100B overexpression increases behavioral and neural plasticity in response to the social environment during adolescence [J]. J Psychiatr Res, 2013,47(11):1791-1799
11 Rong H, Wang G, Liu T,etal.Chronic mild stress induces fluoxetine-reversible decreases in hippocampal and cerebrospinal fluid levels of the neurotrophic factor S100B and its specific receptor[J].Int J Mol Sci, 2010,11(12):5310-5322
12 Tramontina A C, Tramontina F, Bobermin L D,etal. Secretion of S100B, an astrocyte-derived neurotrophic protein, is stimulated by fluoxetine via a mechanism independent of serotonin [J]. Prog Neuropsychopharmacol Biol Psychiatry,2008,32(6):1580-1583
Effects of fluoxetine on depression behavior induced by early-life stress and S100B expression in hippocampus in rats
Yang Kun1,Yu Xue1,Wang Jinglan2,Hu Yiqiu3
(1.Tianjin Anding Hospital, Tianjin 300222; 2. Tianjin Nankai Hospital,Tianjin 300100; 3.Science and Technical Teachers Training College of Hunan Agriculture University, Changsha 410128)
Objective:To investigate the effect of fluoxetine on depression behavior induced by early-life stress and S100B expression in hippocampus in rats. Methods:Sixty newly-born rats from fourteen pregnant SD rats for seventeen dsys were randomly divided into three groups (twenty rats in each group):normal control;non-intervention group in which rats only experienced chronic early-life stress for twenty-eight days;fluoxetine group jin which rats were treated with fluoxetine by intragastric administration (10 ml/kg) for 28 d after experiencing 28 d chronic early-life stress. Behavior tests including open field test and the saccharine preference test were performed to find the behavioral changes of the rats on the 29th day and 57th day. Western blot was used to detect S100B expression in hippocampus. Results:① In the open field test, the level and vertical scores in fluoxetine group and non-intervention group were significantly lower than those in control group on day 29 (P<0.05);the level and vertical scores in fluoxetine group were significantly higher than those in non-intervention group on day 10 (P<0.05). ② In the saccharine preference test,rats in both fluoxetine and control groups exhibited increased saccharin preference compared to those in non-intervention group (P<0.05). ③ The rats in fluoxetine group and control group exhibited increased S100B expression in hippocampus compared to those in non-intervention group (P<0.05). Conclusion:Fluoxetine will improve the capability in the depressive rats and activate astrocytes in hippocampus.
fluoxetine,early-stress,depression,hippocampus,S100B
2014-12-22
国家自然科学基金项目(No.30900484),天津市卫生局重点课题(No.2010KR10)
R965
A
1006-5687(2015)02-0001-04

