营养不良与血管炎症及水溶性细胞间黏附分子1的关系
洪忠新,葛智文
·膳食与营养·
营养不良与血管炎症及水溶性细胞间黏附分子1的关系
洪忠新,葛智文
营养不良通常包括营养不足和营养过剩,二者均可引起机体的炎症活动,也可以根据机体是否存在炎症对营养不良进行分类。清蛋白、超敏C反应蛋白等是评价机体炎性反应的常用指标,而水溶性细胞间黏附分子1(sICAM-1)作为一种可流动循环的膜结合型细胞间黏附分子1(ICAM-1),也是目前机体炎症相关研究的热点。本文分别对营养不良、血管炎症以及sICAM-1之间的关系进行阐述,以期为临床提供参考。
营养不良;炎症;水溶性细胞间黏附分子1
洪忠新,葛智文.营养不良与血管炎症及水溶性细胞间黏附分子1的关系[J].中国全科医学,2015,18(26):3230-3234.[www.chinagp.net]
Hong ZX,Ge ZW.Malnutrition,vascular inflammation and soluble intercellular adhesion molecule-1[J].Chinese General Practice,2015,18(26):3230-3234.
内皮功能紊乱是心血管疾病的关键危险因素,而血管炎症(通常是慢性炎症)能引起动脉粥样硬化,是内皮功能紊乱的病理基础[1-2]。细胞间黏附分子1(ICAM-1)是血管炎症程度的重要评价指标之一,而水溶性ICAM-1(sICAM-1)作为一种可流动循环的膜结合型ICAM-1,也常用于评价内皮功能[3]。
营养不良(包括营养过剩和营养不足)是引起炎症的重要因素之一。肥胖,特别是向心性肥胖可升高ICAM-1水平,增加血管炎症的危险因素。食物中的脂肪、维生素、矿物质等营养素及不良的生活方式(吸烟、饮酒)同样可以影响ICAM-1水平[3]。本文分别对营养不良、血管炎症以及sICAM-1之间的关系进行阐述,旨在为临床提供参考。
1 血管炎症与sICAM-1
sICAM-1具有与免疫球蛋白相似的结构,由453个氨基酸残基组成的糖蛋白,属于黏附分子分类中的免疫球蛋白超家族,而且是整合素作用于内皮细胞等效应细胞的配体,负责血液中白细胞与内皮细胞之间的黏附等。机体很多细胞能够形成sICAM-1,如内皮细胞、血小板、白细胞及平滑肌细胞等。这些细胞形成的ICAM-1存在于细胞膜上,按一定比例脱落后,即为sICAM-1。正常人sICAM-1浓度较低,血浆生理浓度为200~300 pg/L,在血管炎症过程中浓度升高。与此同时,当机体存在某些疾病时,如心脑血管疾病、糖尿病及脂代谢紊乱[1-3]也可加剧其升高,某些危重患者(如维持血液透析患者[4]、脓毒血症患者[5])亦如此。
sICAM-1参与动脉斑块的形成进而引起血管炎症,过程如下:炎性细胞积聚,伴随氧化型低密度脂蛋白形成,从而降低一氧化氮的形成和内皮细胞的激活。当内皮细胞被激活时,黏附分子表达,如sICAM-1浓度增加。从而进一步刺激单核细胞黏附和选择素的水平增加,刺激单核细胞迁移至内皮表面,高数量炎性细胞的存在,使斑块变脆,易破裂,最终导致病理性心肌梗死和急性冠脉综合征[1]。sICAM-1形成过程及内皮功能紊乱的细胞内机制见图1。
对不同心血管疾病的研究发现:有活动性心血管疾病者,血浆sICAM-1浓度显著升高(见表1)。
sICAM-1的特点[3]:(1)是评价血管炎症适宜的标准;(2)循环中的sICAM-1能反映内皮细胞的活化水平;(3)血浆中sICAM-1的水平能反映人体动脉粥样硬化的程度;(4)血浆中sICAM-1的水平可用放射免疫或ELISA等方法测定。
表1 sICAM-1在不同种类心血管疾病中的病例对照研究[1]
Table 1 Case-control study of sICAM-1 in different kinds of cardiovascular diseases
注:sICAM-1=水溶性细胞间黏附分子1
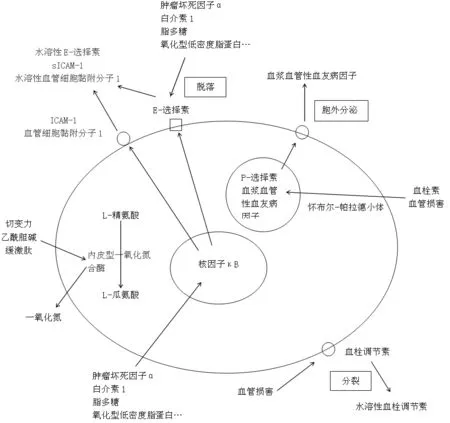
注:sICAM-1=水溶性细胞间黏附分子1,ICAM-1=细胞间黏附分子1
图1 sICAM-1形成过程及内皮功能紊乱的细胞内机制
Figure 1 Intracellular mechanism of sICAM-1 formation and endothelial dysfunction
2 营养不良与血管炎症
营养不良通常包括营养不足和营养过剩,二者均可引起机体的炎症活动,常用的评价指标有清蛋白、超敏C反应蛋白等[6](见图2)。维持血液透析患者存在的营养不良-炎症-动脉粥样硬化综合征就是很好的例证[7]。多数学者认为营养不良与炎症密不可分,营养不良应根据是否存在炎症进行分类[6,8-10](见图3)。
炎症是诊断营养不良四个组分之一。Soeters等[6]将营养不良定义为亚急性或慢性营养状态,由营养过剩或营养不足及炎症活动共同决定,从而引起身体构成的变化及身体功能的下降。基于可操作性,有4个要素组成,即(1)营养素平衡测定:膳食史、排泄物丢失、能量消耗、间接能量测定仪、活动器械、氮平衡。(2)身体构成测定:身高、体质量、体质指数(BMI)、上臂中点肌围(MAMC)、三头肌皮褶厚度(TSF)、生物电阻抗分析法/生物电阻抗波谱分析法(BIA/BIS)。(3)炎症活动测定:清蛋白、血红蛋白、超敏C反应蛋白及细胞因子等。(4)肌肉、免疫及认知功能测定:肌肉功能(握力);免疫功能;认知功能(多种筛查量表)。
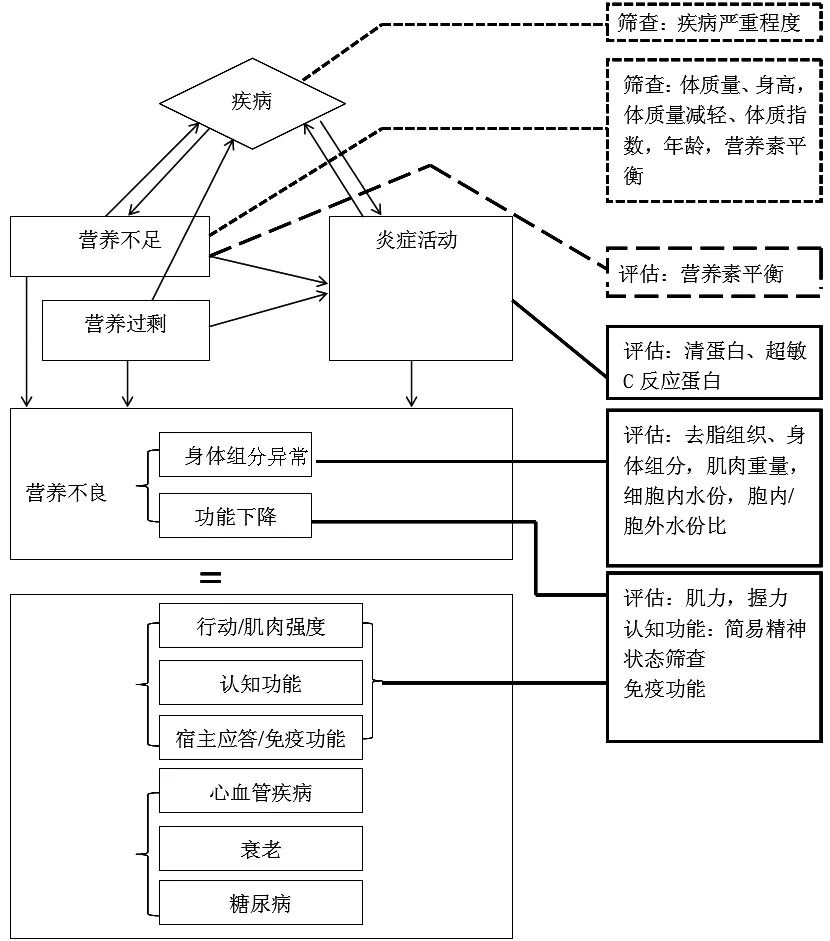
注:右侧虚线框表示营养风险筛查指标,实线框和半实线框表示营养状况评估指标
图2 营养不良导致炎性反应示意图
Figure 2 Diagram of inflammatory reaction induced by malnutrition
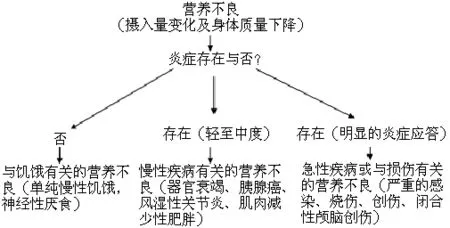
图3 根据是否存在炎症进行营养不良分类示意图
Figure 3 Diagram of malnutrition classification according to the presence of inflammation
3 营养不良与sICAM-1
营养不合理及吸烟、饮酒等不良生活方式同样可以影响血浆sICAM-1浓度[3]。体质量和脂肪摄入量是生活方式中可改变的能够影响炎症指标的因素[2]。
肥胖患者血浆sICAM-1浓度相对较高,当限制能量摄入时,sICAM-1浓度下降[3]。Witkowska[3]对22例肥胖绝经后的妇女研究发现,当采取标准能量(平均2 238 kcal/d)的低脂高碳水化合物的饮食摄入时,体质量没有发生变化,但对炎症指标却有不利的影响,如脂联素下降和三酰甘油升高等;当采取限制能量(平均1 200 kcal/d)的低脂高碳水化合物的饮食摄入时,体质量降低6 kg,超敏C反应蛋白下降、三酰甘油下降及脂联素升高。说明对肥胖者采取限制能量的低脂高碳水化合物饮食时,随着体质量降低,机体炎症水平亦下降。
Forsythe等[11]比较了限制能量摄入的低脂高碳水化合物饮食(LED;能量摄入:1 478 kcal;碳水化合物:脂肪:蛋白质=56%:24%:20%)与限制能量摄入的极低碳水化合物饮食(VLCKD;能量摄入:1 504 kcal;碳水化合物:脂肪:蛋白质=12%:59%:28%)对代谢综合征患者为期3个月的效果,结果发现VLCKD虽增加血浆花生四烯酸的水平,但血浆炎症指标的变化反而更好,sICAM-1浓度下降更明显。
另Ballard等[12]对限制能量摄入的VLCKD对口服他汀类患者的研究发现,VLCKD有类似于他汀类的作用,可改善脂质代谢、炎症及血管内皮功能等。第3周开始,sICAM-1浓度便明显下降。可能原因为:VLCKD增加酮体的生成,抑制机体的氧化应激,降低sICAM-1浓度,进而改善血管的内皮功能。但Van Baal等[13]研究表明,他汀类药物在降低血脂的同时,对sICAM-1的浓度没有任何有意义的影响。Chou等[14]对雌激素补充的研究也有类似的结果。大剂量糖皮质激素治疗时(相当于泼尼松龙60 mg/d),促炎作用大于抗炎作用,应慎重使用[15]。
经口脂肪负载(OFL)影响健康个体的炎症指标和内皮功能。Derosa等[16]设计受试者于8:00~9:00经口摄入加入2勺巧克力风味糖浆、1匙白砂糖和1匙速溶去脂奶干的350 ml稀奶油,能量相当于1 147 kcal,碳水化合物∶脂肪∶蛋白质=20%∶68%∶12%,于0、3、6、9和12 h抽血测定sICAM-1等指标的变化,结果发现:sICAM-1浓度于3、6、9和12 h分别增加20.58%、34.10%、25.94%和19.14%。同时,收缩压、舒张压、三酰甘油及血糖等指标均有不同程度的升高。各指标升高的主要机制是餐后三酰甘油升高[17]。哥本哈根一项历经26年的心血管疾病队列研究发现:餐后三酰甘油每升高1 mmol/L,缺血性心脏病及全因死亡率的风险增加1.5倍[18]。事实上,血脂正常的冠心病患者,餐后血脂的清除率明显变慢[19]。轻度脂代谢紊乱者,餐后高脂血症与内皮功能紧密相连[20]。负载后,三酰甘油清除越慢,动脉粥样硬化的进展越快[21]。另有Witkowska[3]研究证明,高脂肪餐(50 g/餐脂肪摄入)可引起非肥胖者sICAM-1浓度显著升高。限制脂肪摄入及增加膳食纤维摄入,还有增加活动量均可降低有冠心病风险者的sICAM-1浓度[3]。
饱和脂肪酸较单不饱和脂肪酸更易于储存,进而增加体脂含量,引起肥胖症和心脑血管疾病。与循环中炎症指标浓度的增加有关。采用单不饱和脂肪酸替代部分饱和脂肪酸则有利于降低机体的炎症程度。Moreira Alves等[22]对肥胖者补充富含单不饱和脂肪酸的坚果56 g/d进行研究发现,坚果能减轻机体炎症,表现为白介素10(IL-10)明显升高,此时体质量仅有轻度下降(平均1.8 kg)。通常体质量下降5%~10%时,炎症指标才有明显改变。另Kasim-Karakas等[2]和Witkowska[3]研究表明,膳食饱和脂肪、反式脂肪酸及胆固醇等摄入量越高对机体炎症指标不利影响越大。机制为饱和脂肪激活白细胞膜上的Toll样受体,从而活化核因子κB,影响100个基因转录,其中多数基因与炎症有关,包括sICAM-1[12]。
另还有研究表明,鱼油能抑制核因子κB活化,从而降低sICAM-1浓度,最终抑制中性粒细胞与内皮细胞之间的黏附[23-24]。但Witkowska[3]研究认为,鱼油对sICAM-1没有影响。牛奶中的脂肪对sICAM-1浓度有益,尤其对2型糖尿病患者[25]。富含硒的食物及富含天然色素的食物对血浆sICAM-1浓度有有益的影响[3]。对高胆固醇血症患者采用地中海饮食治疗,血浆sICAM-1浓度未能显示出有益变化[3]。高糖生成指数食物及甜饮料能升高健康人群的炎症水平[26]。快速摄取碳水化合物明显引起反应性氧族增加和促炎通路的活化,并且高碳水化合物饮食也与炎症指标的增加有关[2,11,27-28]。Mohanty等[29]首先报告,输注葡萄糖刺激单核细胞及中性粒细胞内辅酶Ⅱ氧化酶的活性,使反应性氧族产生增加,产生炎性反应。Esposito等[30]也有类似研究结果。可能机制为膳食碳水化合物刺激三酰甘油的形成及引起肝脏脂肪新生[31-32]。对非酒精性肝病患者的研究发现,碳水化合物的摄入量恶化血浆中炎症指标[2]。多项研究表明,限制碳水化合物摄入能降低机体的炎性反应[2,12-13]。
抗氧化维生素如维生素C(VC)和维生素E(VE)补充对sICAM-1浓度的影响不一(见表2)。
表2 抗氧化剂的补充剂量对sICAM-1浓度的影响
Table 2 Effects of antioxidant supplements dose on the concentrations of sICAM-1
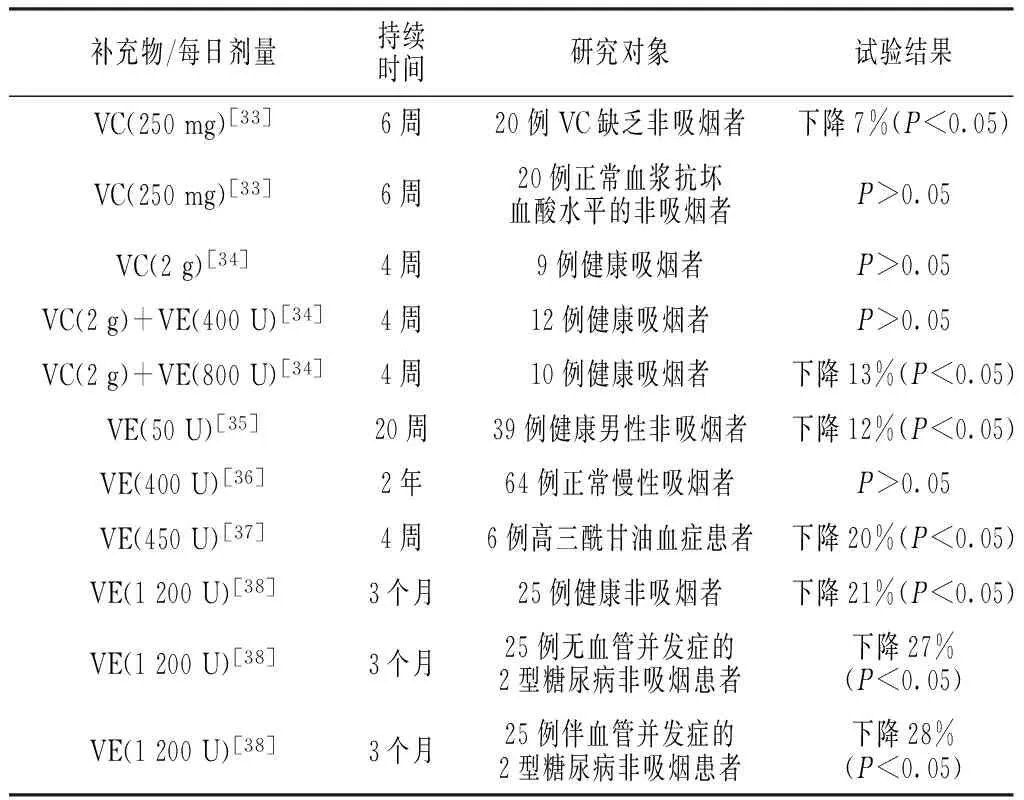
补充物/每日剂量持续时间研究对象试验结果VC(250mg)[33]6周20例VC缺乏非吸烟者下降7%(P<0.05)VC(250mg)[33]6周20例正常血浆抗坏血酸水平的非吸烟者P>0.05VC(2g)[34]4周9例健康吸烟者P>0.05VC(2g)+VE(400U)[34]4周12例健康吸烟者P>0.05VC(2g)+VE(800U)[34]4周10例健康吸烟者下降13%(P<0.05)VE(50U)[35]20周39例健康男性非吸烟者下降12%(P<0.05)VE(400U)[36]2年64例正常慢性吸烟者P>0.05VE(450U)[37]4周6例高三酰甘油血症患者下降20%(P<0.05)VE(1200U)[38]3个月25例健康非吸烟者下降21%(P<0.05)VE(1200U)[38]3个月25例无血管并发症的2型糖尿病非吸烟患者下降27%(P<0.05)VE(1200U)[38]3个月25例伴血管并发症的2型糖尿病非吸烟患者下降28%(P<0.05)
注:VC=维生素C,VE=维生素E
Yilmaz等[39]对224例原发性高血压病患者研究发现,食盐摄入能增强炎症及靶器官的损害〔低盐组:尿钠为(111.7±29.1)mmol/24 h;高盐组:尿钠为(263.6±68.3)mmol/24 h〕。Azak等[40]对86例慢性心力衰竭患者的研究发现,高盐摄入明显增加患者的炎症水平。Witkowska[3]对1 000例健康中年男性的研究发现,血浆sICAM-1的浓度与酒精摄入呈正相关,但尚缺乏对红酒的研究证据。
综上所述,营养不良、血管炎症与sICAM-1三者之间密切相关,对于三者间关系的研究将为今后临床营养治疗动脉粥样硬化等心血管疾病提供更为可靠的依据。未来将进一步引入更多炎症评价及营养评估方面的常用指标进行更综合深入的探讨。
[1]Constans J,Conri C.Circulating markers of endothelial function in cardiovascular disease[J].Clin Chim Acta,2006,368(1/2):33-47.
[2]Kasim-Karakas SE,Tsodikov A,Singh U,et al.Responses of inflammatory markers to a low-fat,high-carbohydrate diet:effects of energy intake[J].Am J Clin Nutr,2006,83(4):774-779.
[3]Witkowska AM.Soluble ICAM-1:a marker of vascular inflammation and lifestyle[J].Cytokine,2005,31(2):127-134.
[4]Chang JF,Hsu SP,Pai MF,et al.High soluble vascular cell adhesion molecule-1 concentrations predict long-term mortality in hemodialysis patients[J].Int Urol Nephrol,2013,45(6):1693-1701.
[5]Paterson RL,Galley HF,Dhillon JK,et al.Increased nuclear factor kappa B activation in critically ill patients who die[J].Crit Care Med,2000,28(4):1047-1051.
[6]Soeters PB,Reijven PL,van Bokhorst-de van der Schueren MA,et al.A rational approach to nutritional assessment[J].Clin Nutr,2008,27(5):706-716.
[7]Phanish MK,Marcora SM,Lemmey AB.Malnutrition,chronic inflammation and atherosclerosis in dialysis patients[J].Nephrol Dial Transplant,2003,18(2):446.
[8]洪忠新.又论危重患者的营养支持与营养评价[J].内科急危重症杂志,2014,20(2):83-86.
[9]Norman K,Stobäus N,Kulka K,et al.Effect of inflammation on handgrip strength in the non-critically ill is independent from age,gender and body composition[J].Eur J Clin Nutr,2014,68(2):155-158.
[10]White JV,Guenter P,Jensen G,et al.Consensus statement:Academy of Nutrition and Dietetics and American Society for Parenteral and Enteral Nutrition:characteristics recommended for the identification and documentation of adult malnutrition(undernutrition)[J].JPEN J Parenter Enteral Nutr,2012,36(3):275-283.
[11]Forsythe CE,Phinney SD,Fernandez ML,et al.Comparison of low fat and low carbohydrate diets on circulating fatty acid composition and markers of inflammation[J].Lipids,2008,43(1):65-77.
[12]Ballard KD,Quann EE,Kupchak BR,et al.Dietary carbohydrate restriction improves insulin sensitivity,blood pressure,microvascular function,and cellular adhesion markers in individuals taking statins[J].Nutr Res,2013,33(11):905-912.
[13]Van Baal WM,Emeis JJ,Kenemans P,et al.Short-term hormone replacement therapy:reduced plasma levels of soluble adhesion molecules[J].Eur J Clin Invest,1999,29(11):913-921.
[14]Chou ET,Schulman SP,Thiemann DR,et al.Effect of short-term estrogen with and without progesterone therapy on circulating markers of endothelial activation and injury in postmenopausal women with unstable angina pectoris[J].Am J Cardiol,2003,91(10):1240-1242.
[15]Dandona P,Ghanim H,Sia CL,et al.A mixed anti-inflammatory and pro-inflammatory response associated with a high dose of corticosteroids[J].Curr Mol Med,2014,14(6):793-801.
[16]Derosa G,Ferrari I,D′Angelo A,et al.Oral fat load effects on inflammation and endothelial stress markers in healthy subjects[J].Heart Vessels,2009,24(3):204-210.
[17]McBride PE.Triglycerides and risk for coronary heart disease[J].JAMA,2007,298(3):336-338.
[18]Nordestgaard BG,Benn M,Schnohr P,et al.Nonfasting triglycerides and risk of myocardial infarction,ischemic heart disease,and death in men and women[J].JAMA,2007,298(3):299-308.
[19]Groot PH,van Stiphout WA,Krauss XH,et al.Postprandial lipoprotein metabolism in normolipidemic men with and without coronary artery disease[J].Arterioscler Thromb,1991,11(3):653-662.
[20]Maggi FM,Raselli S,Grigore L,et al.Lipoprotein remnants and endothelial dysfunction in the postprandial phase[J].J Clin Endocrinol Metab,2004,89(6):2946-2950.
[21]Norman K,Pichard C,Lochs H,et al.Prognostic impact of disease-related malnutrition[J].Clin Nutr, 2008,27(1):5-15.
[22]Moreira Alves RD,Boroni Moreira AP,Macedo VS,et al.High-oleic peanuts:new perspective to attenuate glucose homeostasis disruption and inflammation related obesity[J].Obesity(Silver Spring),2014,22(9):1981-1988.
[23]王瑾,于健春,康维明,等.鱼油脂肪乳剂对炎症的影响及其临床应用[J].中国实用外科杂志,2011,31(4):354-357.
[24]Plat J,Jellema A,Ramakers J,et al.Weight loss,but not fish oil consumption,improves fasting and postprandial serum lipids,markers of endothelial function,and inflammatory signatures in moderately obese men[J].J Nutr,2007,137(12):2635-2640.
[25]Livingstone KM,Givens DI,Jackson KG,et al.Comparative effect of dairy fatty acids on cell adhesion molecules,nitric oxide and relative gene expression in healthy and diabetic human aortic endothelial cells[J].Atherosclerosis,2014,234(1):65-72.
[26]Goletzke J,Buyken AE,Joslowski G,et al.Increased intake of carbohydrates from sources with a higher glycemic index and lower consumption of whole grains during puberty are prospectively associated with higher IL-6 concentrations in younger adulthood among healthy individuals[J].J Nutr,2014,144(10):1586-1593.
[27]Dandona P,Aljada A,Chaudhuri A,et al.Metabolic syndrome:a comprehensive perspective based on interactions between obesity,diabetes,and inflammation[J].Circulation,2005,111(11):1448-1454.
[28]Liu S,Manson JE,Buring JE,et al.Relation between a diet with a high glycemic load and plasma concentrations of high-sensitivity C-reactive protein in middle-aged women[J].Am J Clin Nutr,2002,75(3):492-498.
[29]Mohanty P,Hamouda W,Garg R,et al.Glucose challenge stimulates reactive oxygen species(ROS)generation by leucocytes[J].J Clin Endocrinol Metab,2000,85(8):2970-2973.
[30]Esposito K,Nappo F,Marfella R,et al.Inflammatory cytokine concentrations are acutely increased by hyperglycemia in humans:role of oxidative stress[J].Circulation,2002,106(16):2067-2072.
[31]Solga S,Alkhuraishe AR,Clark JM,et al.Dietary composition and nonalcoholic fatty liver disease[J].Dig Dis Sci,2004,49(10):1578-1583.
[32]Kerner A,Avizohar O,Sella R,et al.Association between elevated liver enzymes and C-reactive protein:possible hepatic contribution to systemic inflammation in the metabolic syndrome[J].Arterioscler Thromb Vasc Biol,2005,25(1):193-197.
[33]Islam KN,Devaraj S,Jialal I.alpha-Tocopherol enrichment of monocytes decreases agonist-induced adhesion to human endothelial cells[J].Circulation,1998,98(21):2255-2261.
[34]Meydani SN,Barklund MP,Liu S,et al.Vitamin E supplementation enhances cell-mediated immunity in healthy elderly subjects[J].Am J Clin Nutr,1990,52(3):557-563.
[35]Dieber-Rotheneder M,Puhl H,Waeg G,et al.Effect of oral supplementation with D-alpha-tocopherol on the vitamin E content of human low density lipoproteins and resistance to oxidation[J].J Lipid Res,1991,32(8):1325-1332.
[36]Rohde LE,Hennekens CH,Ridker PM.Cross-sectional study of soluble intercellular adhesion molecule-1 and cardiovascular risk factors in apparently healthy men[J].Arterioscler Thromb Vasc Biol,1999,19(7):1595-1599.
[37]Institute of Medicine(US) Panel on Dietary Antioxidants and Related Compounds.Dietary Reference Intakes for Vitamin C,Vitamin E,Selenium,and Carotenoids[M].Washington(DC):National Academies Press,2000.
[38]Rayment SJ,Shaw J,Woollard KJ,et al.Vitamin C supplementation in normal subjects reduces constitutive ICAM-1 expression[J].Biochemical Biophysical Res Commun,2003,308(2):339-345.
[39]Yilmaz R,Akoglu H,Altun B,et al.Dietary salt intake is related to inflammation and albuminuria in primary hypertensive patients[J].Eur J Clin Nutr,2012,66(11):1214-1218.
[40]Azak A,Huddam B,Gonen N,et al.Salt intake is associated with inflammation in chronic heart failure[J].Int Cardiovasc Res J,2014,8(3):89-93.
(本文编辑:贾萌萌)
Malnutrition,Vascular Inflammation and Soluble Intercellular Adhesion Molecule-1
HONGZhong-xin,GEZhi-wen.
DepartmentofNutrition,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China
Malnutrition usually includes both undernutrition and overnutrition,and the two could both contribute to the inflammatory activities.Malnutrition could be classified by whether inflammation exists.Albumin and high-sensitivity-C reactive protein are common indexes to assess the inflammatory reaction.Besides,soluble intercellular adhesion molecule-1(sICAM-1),a kind of m-M-CSF ICAM-1 that can flow and circulate,has become a hot topic in the relevant researches of inflammatory reaction nowadays.In this paper,we made an introduction about the relationship among malnutrition,vascular inflammation and sICAM-1,in order to provide references for clinical practice.
Malnutrition;Inflammation;Soluble intercellular adhesion molecule 1
100050北京市,首都医科大学附属北京友谊医院营养科
葛智文,100050北京市,首都医科大学附属北京友谊医院营养科;E-mail:loggve@163.com
R 723.13 R 364.5 R 392.11
A
10.3969/j.issn.1007-9572.2015.26.027
研究对象sICAM-1(pg/L)Mizia-Stec32例不稳定型心绞痛患者138±3827例稳定型心绞痛患者141±2020例健康者153±30Guray43例急性心肌梗死患者424±1545例不稳定型心绞痛患者403±1234例稳定型心绞痛患者381±1629例健康者244±11Eschen206例稳定型心绞痛患者318±14085例冠状动脉造影者290±75Ghaisas15例不稳定型心绞痛患者373±1815例稳定型心绞痛患者246±1415例非心源性胸痛患者220±1215例健康者208±13Parker76例不稳定型心绞痛患者210± 932例稳定型心绞痛患者192±13
2015-04-13;
2015-07-15)

