粪肠球菌裂解性噬菌体φEn-ZZ8生物学特性的初步分析
张哲,李菁华,逯茵茵,韩放,李诗恒,孙延波
吉林大学白求恩医学部基础医学院病原生物学系,长春 130021

粪肠球菌裂解性噬菌体φEn-ZZ8生物学特性的初步分析
张哲,李菁华,逯茵茵,韩放,李诗恒,孙延波
吉林大学白求恩医学部基础医学院病原生物学系,长春 130021
摘要:本研究旨在通过分离粪肠球菌裂解性噬菌体并分析其生物学特性,为噬菌体疗法应用于肠球菌感染提供依据。以粪肠球菌为宿主菌,用双层琼脂法从环境污水中分离出1株裂解性噬菌体(命名为φEn-ZZ8),对其生物学特性进行初步分析。透射电镜观察发现,φEn-ZZ8头部呈二十面体立体对称,直径约40 nm;尾部呈丝状,长约200 nm。吸附实验表明,在10 min内超过90%的噬菌体可吸附至宿主菌细胞。一步生长曲线显示,φEn-ZZ8的潜伏期为15 min,爆发期为40 min,爆发量为150 pfu/cell。φEn-ZZ8基因组对内切酶Hind Ⅲ、EcoR Ⅴ、NdeⅠ、PstⅠ、XbaⅠ和SacⅡ敏感;基因组大小约为42 kb。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳至少可见14条蛋白带,相对分子质量为10 000~130 000。φEn-ZZ8对26株粪肠球菌的裂解率达30.8%,其裂解活性在pH 5~8和50~70 ℃条件下仍稳定。结果提示,φEn-ZZ8是一种裂解性强、裂解谱较宽、对温度具有耐受性的裂解性噬菌体,有望成为抗耐药性肠球菌感染的噬菌体生物制剂。
关键词:粪肠球菌;耐万古霉素肠球菌;噬菌体;噬菌体疗法
肠球菌属细菌为兼性厌氧革兰阳性球菌,可寄生于人和动物肠道内,是肠道正常菌群成员。肠球菌属主要包括粪肠球菌、屎肠球菌、鸟肠球菌、鹑鸟肠球菌、铅黄色肠球菌、盲肠肠球菌等。近年来,随着抗生素和免疫抑制剂的广泛应用、各种侵入性治疗的开展及肠球菌多重耐药菌株的出现,肠球菌引起的医院内感染逐渐增多,特别是在艾滋病患者、接受化疗的癌症患者、术后和器官移植患者中[1]。全球范围内,肠球菌感染主要由粪肠球菌和屎肠球菌引起[2]。国内研究显示[3],粪肠球菌和屎肠球菌对高浓度庆大霉素、红霉素和利福平呈现较高的耐药率。在北美地区,肠球菌所致菌血症的病死率高达25%~50%[4]。肠球菌对头孢菌素的固有耐药性及其对氨苄西林和万古霉素耐药性趋势的增强,无疑给肠球菌感染的治疗带来诸多困难。
噬菌体是一类能感染细菌的病毒,广泛存在于自然界。噬菌体感染细菌后能在细菌细胞内增殖,产生子代噬菌体,并最终裂解细菌,通常称为裂解性噬菌体。利用裂解性噬菌体控制细菌性感染称为噬菌体疗法。面对细菌耐药性的严峻形势,噬菌体疗法又重新引起人们的关注[5]。因此,积极开展肠球菌噬菌体生物学特性的研究和肠球菌感染的噬菌体疗法,具有重要的现实意义和潜在的应用价值。
1材料与方法
1.1 材料
1.1.1菌株26株粪肠球菌由吉林省人民医院检验科提供,菌株经法国生物梅里埃公司VITEK-32全自动微生物分析系统鉴定。金黄色葡萄球菌ATCC 29231和肺炎链球菌1501由吉林大学基础医学院病原生物学系保存。
1.1.2培养基和主要试剂脑-心浸液培养基、胰蛋白胨、酵母浸粉、琼脂粉购自青岛高科园海博生物技术有限公司,聚乙二醇〔poly (ethylene glycol), PEG〕 6000购自Merck公司,酚∶氯仿∶异戊醇(25∶24∶1)购自北京鼎国生物技术有限责任公司,蛋白酶K购自Ameresco公司,各种限制性内切酶购自TaKaRa公司。
1.2 方法
1.2.1噬菌体的分离和初步纯化取环境污水800 ml,加入固体CaC12至终浓度为l mmol/L,混匀,5 000g离心10 min;取上清液500 ml置三角烧瓶中,加入脑-心浸液液体培养基50 ml、26株新鲜培养的粪肠球菌各2 ml,37 ℃震荡培养16 h。次日10 000g离心10 min,取上清液,用0.42 μm滤器过滤,得到噬菌体原液;取0.3 ml噬菌体原液与0.3 ml新鲜培养的宿主菌悬液混匀,室温静置15 min;加入融化的0.7%脑-心浸液琼脂4 ml,均匀铺于固体脑-心浸液琼脂平板上,37 ℃过夜培养,观察噬菌斑生长情况。
在噬斑形成后,取单个噬斑溶于10 μl LB培养基中,依次10倍稀释后进行噬斑实验。以最低稀释倍数形成的单个噬斑进行扩增,即可获得纯化的噬菌体。纯化的噬菌体液经稀释后用噬斑法测定噬菌体滴度,噬菌体滴度(pfu/ml) = 稀释倍数×噬斑数 (pfu/ml)。
1.2.2噬菌体的电镜观察取初步纯化的噬菌体20 μl滴在复膜铜网上,自然沉淀15 min,用滤纸从 侧面吸干多余的液体,加1滴2%磷钨酸(phosphotungstic acid,PTA)于铜网上,染色10 min,在电压80 kV条件下,用Hitachi透射电镜观察、照相。
1.2.3噬菌体的吸收率和一步生长曲线测定参照文献[6]方法,将宿主菌培养至对数生长期后加入噬菌体(100∶1),37 ℃振荡培养,每分钟取培养物100 μl并加SM Buffer(50 mmol/L Tris-HCl、0.58% NaCl和MgSO4) 400 μl,10 000g离心5 min,用双层琼脂噬斑法计算不同时间内游离噬菌体的百分率。
在观察一步生长曲线时,按100∶1将宿主菌与噬菌体混匀,37 ℃孵育15 min,使噬菌体充分吸附至宿主菌;10 000g离心30 s,弃上清液,洗2次,去除未吸附于宿主菌的噬菌体,于20 ml培养基中充分混匀,迅速置于37 ℃培养;每隔10 min取样200 μl,10 000g离心30 s,取上清液测定噬菌体滴度,每个时间点均重复3次。以时间为横坐标,以噬菌体滴度的对数值为纵坐标,绘制一步生长曲线并测定噬菌体的潜伏期、爆发期和爆发量。爆发量=爆发末期噬菌体滴度(pfu/ml)/裂解初期宿主菌浓度(cfu/ml)。
1.2.4噬菌体基因组的提取和酶切电泳参照文献[7]方法,在初步纯化的噬菌体悬液中加入DNase Ⅰ(终浓度5 μg/ml)和RNase A(终浓度1 μg/ml),加PEG,37 ℃温育50 min,10 000g离心10 min;将沉淀悬于等体积缓冲液中,用等体积氯仿∶异戊醇(24∶1)混匀,5 000g离心10 min;上清液中再次加入DNase Ⅰ和RNase A,37 ℃温育50 min;加乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)(pH 8.0)至终浓度20 mmol/ L以终止核酸酶活性,加蛋白酶K至终浓度50 μg/ml,十二烷基硫酸钠(sodium dodecyl sulfate,SDS)至终浓度0.5%,56 ℃温育1 h;用等体积平衡酚(pH 8.0)抽提离心,收集水相,再用等体积氯仿抽提后取水相,加入1/10体积的3 mol/L NaAc(pH 5.2),用无水乙醇沉淀核酸;干燥后的核酸溶于双蒸水中,-20 ℃保存。将提取的核酸分别与各种限制性内切酶作用后,经琼脂糖凝胶电泳分析。
1.2.5噬菌体蛋白的SDS-聚丙烯酰胺凝胶电泳分析取500 ml对数生长期的宿主菌液,加入1 ml噬菌体液,37 ℃振荡培养。当宿主菌液澄清后,离心过滤去除宿主菌菌体碎片,用100 000超滤管截留噬菌体,用少量磷酸盐缓冲液(phosphate buffered saline,PBS)洗脱噬菌体;加入2×上样缓冲液混匀,煮沸5 min,置冰上1 min,室温冷却后进行SDS-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)。
1.2.6噬菌体的稳定性实验分别用1 mol/L HCl和0.5 mol/L NaOH 将液体培养基pH 调至1~14,将100 μl噬菌体悬液(108pfu/ml)放置pH调整后的培养基中,37 ℃水浴1 h,用双层琼脂法计算噬菌体数量,测定噬菌体在不同pH条件下的稳定性。将200 μl噬菌体悬液(107PFU/ml)分别置于50 ℃、60 ℃、70 ℃和80 ℃水浴中,10、20、30、40、50和60 min后取100 μl,用双层琼脂噬斑法测定不同温度下的噬菌体数量。
1.2.7裂解谱实验将脑-心浸液固体培养基铺于24孔板内,取新鲜细菌培养物100 μl均匀涂抹于培养基表面,待干燥后将纯化的噬菌体10 μl(108pfu/ml)滴种于培养基中央,37 ℃过夜,观察溶菌斑的形成。能形成完全透明、清晰的溶菌斑,判定噬菌体对该宿主菌有裂解作用。
2结果
2.1 噬菌体φEn-ZZ8 的分离和电镜观察
用双层琼脂法分离出1株粪肠球菌毒性噬菌体,命名为φEn-ZZ8。噬菌体在双层琼脂平板上形成圆形、透明、直径为3~5 mm 的噬菌斑。单个噬斑经3~5次扩增后,测得噬菌体滴度为2×1010pfu/ml。初步纯化的噬菌体颗粒经负染法进行电镜观察。结果显示,噬菌体φEn-ZZ8的形态呈蝌蚪样;头部呈二十面体立体对称,直径约40 nm;尾部呈丝状,长约200 nm(图1)。

A: Plaques of phage φEn-ZZ8. B and C: Morphology of phage φEn-ZZ8 under transmission electron microscope.图1 噬菌体φEn-ZZ8的噬菌斑和电镜照片Fig.1 Plaques and electron micrograph of phage φEn-ZZ8
2.2 噬菌体的吸收率和一步生长曲线
将宿主菌培养至对数生长期后加入噬菌体,37 ℃振荡培养,每分钟取培养物测定游离噬菌体数量。结果发现,在第5分钟时游离噬菌体的百分率降至60%,第10分钟时游离噬菌体的百分率不足10%,表明φEn-ZZ8吸附至宿主菌细胞的速度较快(图2 A)。将φEn-ZZ8 (1.5×106pfu/ml)和宿主菌(1×108cfu/ml)混合培养,以时间为横坐标,取噬菌体滴度的对数为纵坐标,绘制一步生长曲线。结果显示,φEn-ZZ8感染宿主菌的潜伏期为15 min,爆发期约为45 min,爆发量为150 pfu/cell(图2 B)。
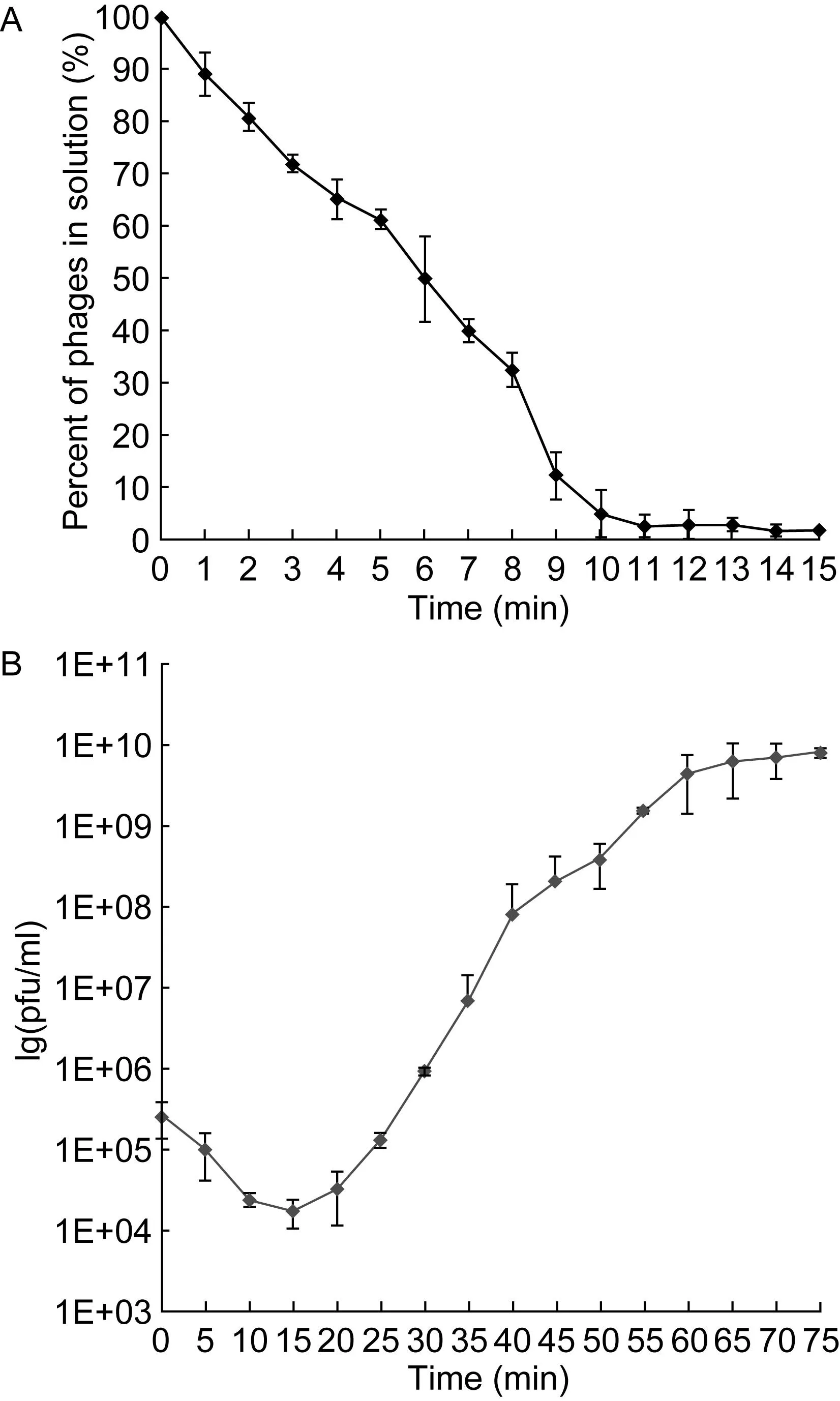
A: Assay of adsorption of φEn-ZZ8 to Enterococcus faecalis. B: One-step growth curve of φEn-ZZ8 in Enterococcus faecalis.图2 噬菌体φEn-ZZ8感染宿主菌分析Fig.2 Infection analysis of phage φEn-ZZ8
2.3 噬菌体φEn-ZZ8基因组的限制性酶切图谱
将提取的噬菌体φEn-ZZ8基因组经10种限制性内切酶作用后行0.8%琼脂糖凝胶电泳,发现φEn-ZZ8基因组中有Hind Ⅲ、EcoRⅤ、NdeⅠ、PstⅠ和XbaⅠ多个酶切位点,有SacⅡ一个酶切位点。对其余4种内切酶不敏感(无BglⅡ、NotⅠ、EcoRⅠ和XhoⅠ酶切位点)(图3)。将基因组经NdeⅠ和PstⅠ酶切后获得不同片段的相对分子质量相加,并用Quantity One软件比对分析,结果显示φEn-ZZ8的基因组大小约为42 kb。
2.4 噬菌体φEn-ZZ8蛋白的SDS-PAGE分析
将纯化后的噬菌体颗粒进行SDS-PAGE,经考马斯亮蓝染色和脱色,至少观察到14种蛋白(包括结构蛋白和非结构蛋白),相对分子质量为10 000~130 000。其中25 000~35 000和15 000~25 000的2个为主要蛋白,其余为次要蛋白(图4)。
2.5 噬菌体φEn-ZZ8在不同pH和温度条件下的稳定性
将噬菌体悬液置于不同pH值的培养基中,37 ℃水浴1 h。结果显示,在pH 5~8范围内,φEn-ZZ8感染并裂解宿主菌的活性无明显变化,即噬菌体数量保持在107pfu/ml以上。在pH≥9时,噬菌体活性明显下降。不同温度对噬菌体活性的影响显示,50 ℃时噬菌体活性不受影响,60 ℃和70 ℃ 30 min时噬菌体数量开始急剧下降,80 ℃时噬菌体全部灭活,表明φEn-ZZ8在60 ℃以上耐热性较差(图5 )。

M, DNA maker; Lanes 1-10, digestion of DNA with HindⅢ, EcoRⅤ, NdeⅠ, PstⅠ, BglⅡ, XbaⅠ, NotⅠ, EcoRⅠ, XhoⅠand SacⅡ, respectively. Lane 11, phage genome.图3 噬菌体φEn-ZZ8基因组限制性酶切电泳Fig.3 Restriction analysis of phage φEn-ZZ8 genome

Lane 1, PageRuler Pestrained Protein Ladder; Lane 2, phage φEn-ZZ8.图4 噬菌体蛋白的SDS-PAGEFig.4 SDS-PAGE of phage protein
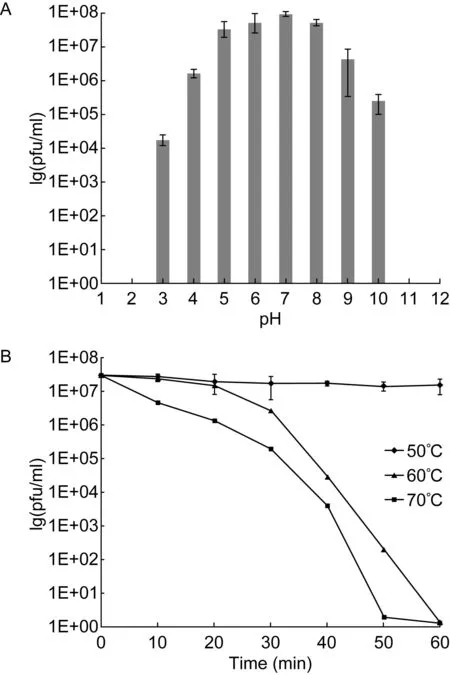
A: pH stability test of phage φEn-ZZ8. B: Thermal stability test of φEn-ZZ8. Strains were grown in BHI medium at 37 ℃. Spots were divided into categories: clear zone (+) and no reaction (-).图5 噬菌体φEn-ZZ8稳定性实验Fig.5 Stability test of phage φEn-ZZ8
2.6 噬菌体φEn-ZZ8的裂解谱实验
在分离和鉴定裂解性φEn-ZZ8的基础上,进一步观察其对26株粪肠球菌分离株的裂解情况。结果显示,φEn-ZZ8能裂解其中的8株粪肠球菌,裂解率为30.8%(表1)。
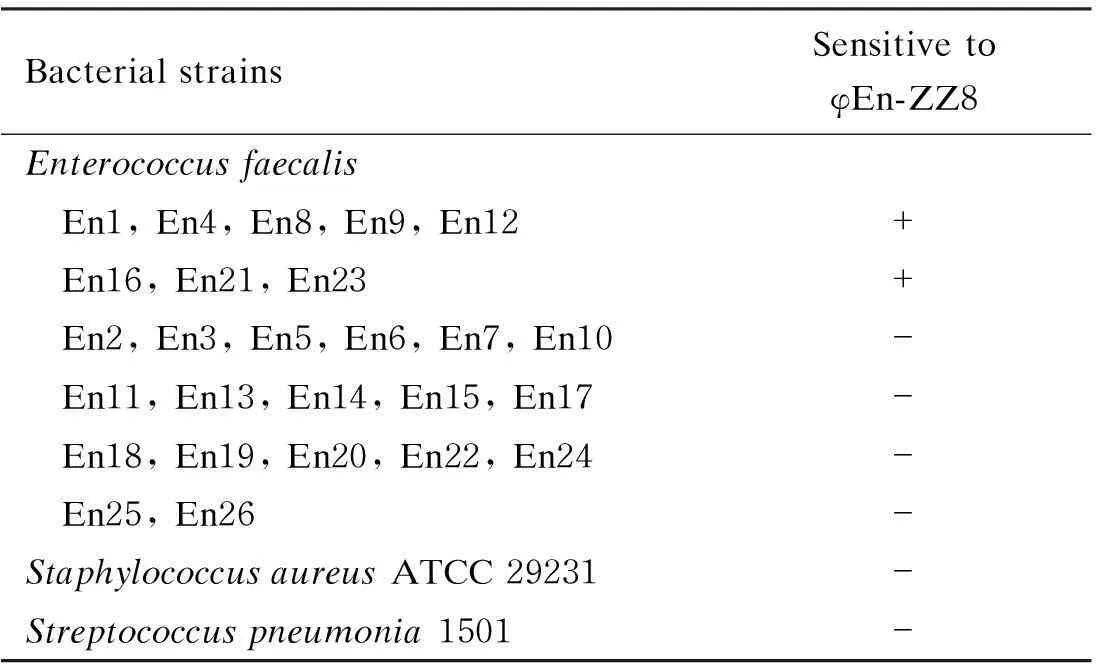
表1 噬菌体φEn-ZZ8对不同粪肠球菌的裂解活性Tab.1 Lytic activity of φEn-ZZ8 against various Enterococcus strains
3讨论
肠球菌属细菌是人和动物肠道内的正常菌群成员,一般情况下不引起感染,但在免疫功能低下和长期住院老年患者中,以及在医院的一些特殊环境如重症监护室、烧伤病房等中,肠球菌已被公认是引起医院内感染的重要病原菌之一。此外,由于用万古霉素治疗耐甲氧西林金黄色葡萄球菌感染越来越普遍,结果选择性压力导致耐万古霉素肠球菌(vancomycin-resistantEnterococcus,VRE)不断出现[8],多重耐药肠球菌和VRE引起的感染是当今医务界面临的重要挑战。目前,利用噬菌体控制细菌感染引起广泛关注[9],西方学者已开展针对肠球菌感染的噬菌体疗法的研究[10,11]。
本研究采用双层琼脂法从环境污水中分离出1株能裂解粪肠球菌的毒性噬菌体,命名为φEn-ZZ8。电镜观察显示,噬菌体φEn-ZZ8属有尾噬菌体,其头部呈立体对称,直径约40 nm;尾部长达近200 nm,在尾部末端可见尾板结构。根据Ackermann分类法[12], φEn-ZZ8属于有尾病毒目(Caudovirales)管尾病毒科(Siphoviridae)噬菌体。Parasion等[13]分离的粪肠球菌噬菌体φ4D尾部较短,属于肌尾噬菌体科(Myoviridae),提示不同地域针对同一种细菌的噬菌体在形态特征上可完全不同。吸附实验反映噬菌体吸附至宿主菌的效率。本研究显示,在10 min内超过90%的噬菌体颗粒吸附至宿主菌表面,表明φEn-ZZ8感染宿主菌的效率很高。一步生长曲线显示,φEn-ZZ8的潜伏期为15 min(即从噬菌体吸附至宿主菌到大量子代噬菌体释放的时间),爆发期为45 min(从15 ~60 min),爆发量达150 pfu/cell。一般认为,一个裂解性噬菌体感染宿主菌后,可释放出超过100个子代噬菌体[14],释放的噬菌体又可感染和裂解宿主菌,表明噬菌体裂解细菌的效率非常高。限制性酶切图谱表明,φEn-ZZ8的基因组为双链DNA,且含有Hind Ⅲ、EcoRⅤ、NdeⅠ、PstⅠ和XbaⅠ酶切位点,基因组大小约为42 kb,而Uchiyama等[15]分离的粪肠球菌噬菌体φEF24C基因组长度为142 kb,表明在不同地域和生态环境下粪肠球菌噬菌体的基因组存在很大差异。
SDS-PAGE初步分析提示,φEn-ZZ8蛋白包括2个主要蛋白和至少12个次要蛋白。稳定性实验表明,φEn-ZZ8在pH 5~8范围内仍具有很高活性,但对热的稳定性较差。进一步分析φEn-ZZ8 对26株粪肠球菌的裂解谱,结果显示其能裂解8株粪肠球菌,裂解率为30.8%。Uchiyama等[16]分离的粪肠球菌噬菌体φEF24C具有很宽的裂解谱,对30株粪肠球菌的裂解率达86.6%。虽然φEn-ZZ8的裂解谱不及φEF24C,但未来噬菌体疗法的发展趋势是制备噬菌体混合制剂(含不同裂解谱的噬菌体),即噬菌体的鸡尾酒疗法[17,18]。因此,今后一方面要分离具有宽裂解谱的肠球菌噬菌体,另一方面要开展肠球菌噬菌体混合制剂的研究,以期达到具有宽裂解谱的目的。
随着抗生素和免疫抑制剂的广泛应用,多重耐药粪肠球菌和屎肠球菌不断出现,给临床治疗带来极大挑战。本研究分离到1株粪肠球菌裂解性噬菌体,可为以后的噬菌体疗法打下基础。
参考文献
[1]Cetinkaya Y, Falk P, Mayhall CG. Vancomycin-resistant enterococci [J]. Clin Microbiol Rev, 2000, 13(4): 686-707.
[2]Noskin GA, Peterson LR, Warren JR. Enterococcus faecium and Enterococcus faecalis bacteremia: acquisition and outcome [J]. Clin Infect Dis, 1995, 20(2): 296-301.
[3]杨青,俞云松,倪语星,孙景勇,徐英春,孙宏莉,孙自镛,简翠,汪复,朱德妹,胡付品,蒋晓飞,王传清,王爱敏,卓超,苏丹虹,胡云建,艾效曼,黄文祥,贾蓓,张朝霞,季萍,张泓,李万华,魏莲花,吴玲,徐元宏,沈继录,单斌,杜艳.2009年中国CHINET肠球菌属细菌耐药性监测 [J].中国感染与化疗杂志,2010,10(6):421-425.
[4]Billington EO, Phang SH, Gredson DB, Pitout JD, Ross T, Church DL, Laupland KB, Parkins MD. Incidence, risk, factors, and outcomes of Enterococcus spp. blood stream infections: a population-based study [J]. Int J Infect Dis, 2014, 26: 76-82.
[5]Burrowes B, Harper DR, Anderson J, McConville M, Enright MC. Bacteriophage therapy: potential uses in the control of antibiotic-resistant pathogens [J]. Expert Rev Anti Infect Ther, 2011, 9(9): 775-785.
[6]Wang J, Hu B, Xu M, Yan Q, Liu S, Zhu X, Sun Z, Reed E, Ding L, Gong J, Li QQ, Hu J. Use of bacteriophage in the treatment of experimental animal bacteremia from imipenem-resistant Pseudomonas aeruginosa [J]. Int J Mol Med, 2006, 17(2): 309-317.
[7]萨姆布鲁克 J, 弗里奇 EF, 曼尼阿蒂斯 T.分子克隆实验指南[M].金冬雁,黎孟枫 译.第2版.北京:科学出版社,1996:133-138.
[8]Chavers LS, Moser SA, Benjamin WH, Banks SE, Steinhauer JR, Smith AM, Johnson CN, Funkhouser E, Chavers LP, Stamm AM, Waites KB. Vancomycin-resistant enterococci: 15 years and counting [J]. J Hosp Infect, 2003, 53(3): 159-171.
[9]Reardon S. Phage therapy gets revitalized [J]. Nature, 2014, 510(7503): 15-16.
[10]Biswas B, Adhya S, Washart P, Paul B, Trostel AN, Powell B, Carlton R, Merril CR. Bacteriophage therapy rescues mice bacteremic from a clinical isolate of vancomycin-resistant Enterococcus faecium [J]. Infect Immun, 2002, 70(1): 204-210.
[11]Paisano AF, Spira B, Cai S, Bombana AC. In vitro antimicrobial effect of bacteriophages on human dentin infected with Enterococcus faecalis ATCC 29212 [J]. Oral Microbiol Immunol, 2004, 19(5): 327-330.
[12]Ackermann HW. 5 500 phages examined in the electron microscope [J]. Arch Virol, 2007, 152(2): 227-243.
[13]Parasion S, Kwiatek M, Mizak L, Gryko R, Bartoszcze M, Kocik J. Isolation and characterization of a novel bacteriophage φ4D lytic against Enterococcus faecalis strains [J]. Curr Microbiol, 2012, 65(3): 284-289.
[14]Hanlon GW. Bacteriophages: an appraisal of their role in the treatment of bacterial infections [J]. Int J Antimicrob Agents, 2007, 30(2): 118-128.
[15]Uchiyama J, Rashel M, Takemura I, Wakiguchi H, Matsuzaki S. In silico and in vivo evaluation of bacteriophage phiEF24C, a candidate for treatment of Enterococcus faecalis infections [J]. Appl Environ Microbiol, 2008, 74(13): 4149-4163.
[16]Uchiyama J, Rashel M, Maeda Y, Takemura I, Sugihara S, Akechi K, Muraoka A, Wakiguchi H, Matsuzaki S. Isolation and characterization of a novel Enterococcus faecalis bacteriophage phiEF24C as a therapeutic candidate [J]. FEMS Microbiol Lett, 2008, 278(2): 200-206.
[17]Kelly D, McAuliffe O, Ross RP. O'Mahony J, Coffey A. Development of a broad-host-range phage cocktail for biocontrol [J]. Bioeng Bugs, 2011, 2(1): 31-37.
[18]Chan BK, Abedon ST, Loc-Carrillo C. Phage cocktails and the future of phage therapy [J]. Future Microbiol, 2013, 8(6): 769-783.
·论著·
Corresponding author. SUN Yan-Bo, E-mail: sunyb@jlu.edu.cn
Biological characteristics of a virulent bacteriophage φEn-ZZ8 isolated fromEnterococcusfaecalis
ZHANG Zhe, LI Jing-Hua, LU Yin-Yin, HAN Fang, LI Shi-Heng, SUN Yan-Bo
Department of Pathogen Biology, College of Basic Medical Sciences, Jilin University, Changchun 130021, China
Abstract:This study aims to isolate lytic bacteriophages from Enterococcus faecalis (E. faecalis),analyze its biological characteristics and to establish the research basis for a phage-based therapy against Enterococcus infections. A lytic bacteriophage (named φEn-ZZ8) was isolated from the sewage using double-agar method and its basic biological characteristics were analyzed. The results showed that φEn-ZZ8 had an icosahedral head of 40 nm in diameter and a filamentous tail of 200 nm in length. The adsorption rate of φEn-ZZ8 reached 90% in 10 min. One-step growth showed that φEn-ZZ8 had a short latency period of 15 min, a rise period of 40 min, and a burst size of 150 pfu/cell. The genome of φEn-ZZ8 was sensitive to HindIII, EcoRV, NdeI, PstI, Xba I and Sac II, and the size of the genome was estimated to be 42 kb. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) revealed that at least 14 proteins were observed on the gel, ranging from 11 000 to 130 000. The bacteriophage specifically infected and lysed 30.8% E. faecalis isolates. The φEn-ZZ8 also exhibited stability to the wide range of pH and temperature. The data suggest that phage φEn-ZZ8 may be a candidate therapeutic agent to control Enterococcus infections.
Key words:Enterococcus faecalis; Vancomycin-resistant Enterococcus; Bacteriophage; Phage therapy
收稿日期:(2014-08-25)
通信作者:孙延波
基金项目:吉林省科技厅科技发展计划国际科技合作项目(20140414042GH)

