噬菌体药代动力学研究进展
于华波,张 亮,冯 超,迟 腾,齐艳玲,贾凯翔,张 洋,钱爱东,单晓枫,张 蕾 (吉林农业大学 动物医学学院/动物科学技术学院,吉林 长春 130118)
噬菌体于19世纪末被首次发现[1],但由于当时对噬菌体生物学缺乏了解,再加上抗生素的出现及其对细菌良好的治疗效果,导致噬菌体研究暂时被搁置。然而抗生素的滥用及各种耐药细菌的出现使得研发新的抗生素替代品迫在眉睫,于是噬菌体重新出现在人们的视野中,成为治疗细菌感染的新选择。与常规抗生素和其他化学药物相比,使用噬菌体治疗细菌性感染具有很多治疗优势,GOLKAR等[2]总结噬菌体的治疗优势包括特异性强、只针对于宿主菌并且对其他细菌无害、与抗生素相比,噬菌体在治疗过程中很少出现过敏反应、继发感染及其他副作用、在宿主菌死亡后相应的噬菌体也会裂解,不会对环境造成污染、研制周期短、成本低、便于运输和使用。药代动力学是研究机体对药物处置的动态变化,即包括药物在机体内的吸收、分布、生物转化及排泄的过程,特别是血药浓度随时间而变化的规律。因此,现综述噬菌体药代动力学特征,并对比不同动物体内药代动力学参数,以期为噬菌体临床治疗、分析技术开发以及发展应用方面提供理论参考。
1 不同给药途径对噬菌体疗效的影响
临床上应用噬菌体治疗细菌感染性疾病的给药方式有许多种,不同的给药方式对于噬菌体的治疗效果有非常显著地影响(图 1)。
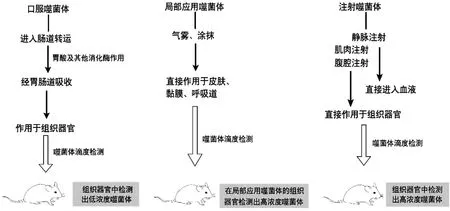
图1 不同给药途径对小鼠体内噬菌体滴度的影响
1.1 口服噬菌体口服噬菌体是临床治疗中是最常见的给药途径之一,其优点是相对安全以及操作简单,常用于靶向治疗胃肠道细菌感染。EASWARAN等[3]通过试验证明口服噬菌体pAh-1对于感染嗜水气单胞菌的斑马鱼具有良好的治疗效果,患病斑马鱼的存活率有了显著提高。GALTIER等[4]发现口服噬菌体能够减少小鼠肠道内耐药菌的数量。MAJEWSKA等[5]研究发现,口服T4噬菌体可以治疗小鼠肠道大肠杆菌感染,而在治疗后92 d 才出现耐噬菌体大肠杆菌。然而相对于其他给药途径,口服噬菌体在胃肠道转运的效果较差。主要影响噬菌体胃肠道转运的因素有以下2种:首先,大部分噬菌体对于pH敏感性很高,动物胃酸pH值小于3,这种酸性环境很容易抑制噬菌体的生长和增殖。对43株噬菌体pH偏嗜性进行统计(表1),发现大多数噬菌体可生存在pH5~8之间,直接口服会造成噬菌体在酸性环境中活性降低,甚至失活;另一个影响噬菌体胃肠道转运的因素是宿主的免疫反应。SMITH等[6]口服噬菌体治疗小牛胃肠道大肠杆菌感染,在胃肠道中存在的某些特异性抗体导致肠道活性噬菌体大量减少,治疗效果受到抑制。JOANNA等[5]通过对小鼠长期口腔饲喂T4噬菌体,并且检测肠道、血液中抗体的含量,发现IgA含量增加,可以拮抗活性噬菌体在肠道内转运。综上,口服噬菌体对于胃肠道细菌感染有一定的治疗效果,然而,受胃肠道pH值的影响,如果不能克服胃酸障碍,噬菌体的疗效将会受到很大的影响。
1.2 局部应用噬菌体局部应用噬菌体是将噬菌体通过喷洒、涂抹等方式应用皮肤或黏膜等处。在临床上,通常利用吸入、鼻内和气管内给药治疗呼吸系统疾病。ANDRZEJ等[7]研究发现吸入、鼻内、气管内给药对于噬菌体治疗效果没有显著差异,都可以有效缓解小鼠肺部细菌感染。LIU等[8]通过超声雾化吸入噬菌体D29的方式治疗小鼠结核分枝杆菌感染,试验组治疗效果良好,肺部炎症消失,并且噬菌体在肺部的停留时间达到72 h。除小鼠模型外,吸入噬菌体对于由铜绿假单胞菌引起的水貂出血性肺炎具有很好的治疗作用。顾敬敏等[9]通过鼻内给药噬菌体YH30治疗水貂出血性肺炎,显著改善由出血性肺炎引起的肺部损伤,且感染水貂的存活率明显升高,具有很大的潜力。同样,噬菌体喷雾疗法对于治疗由大肠杆菌引起的鸡呼吸道感染也有着可观的治疗效果[10-11]。
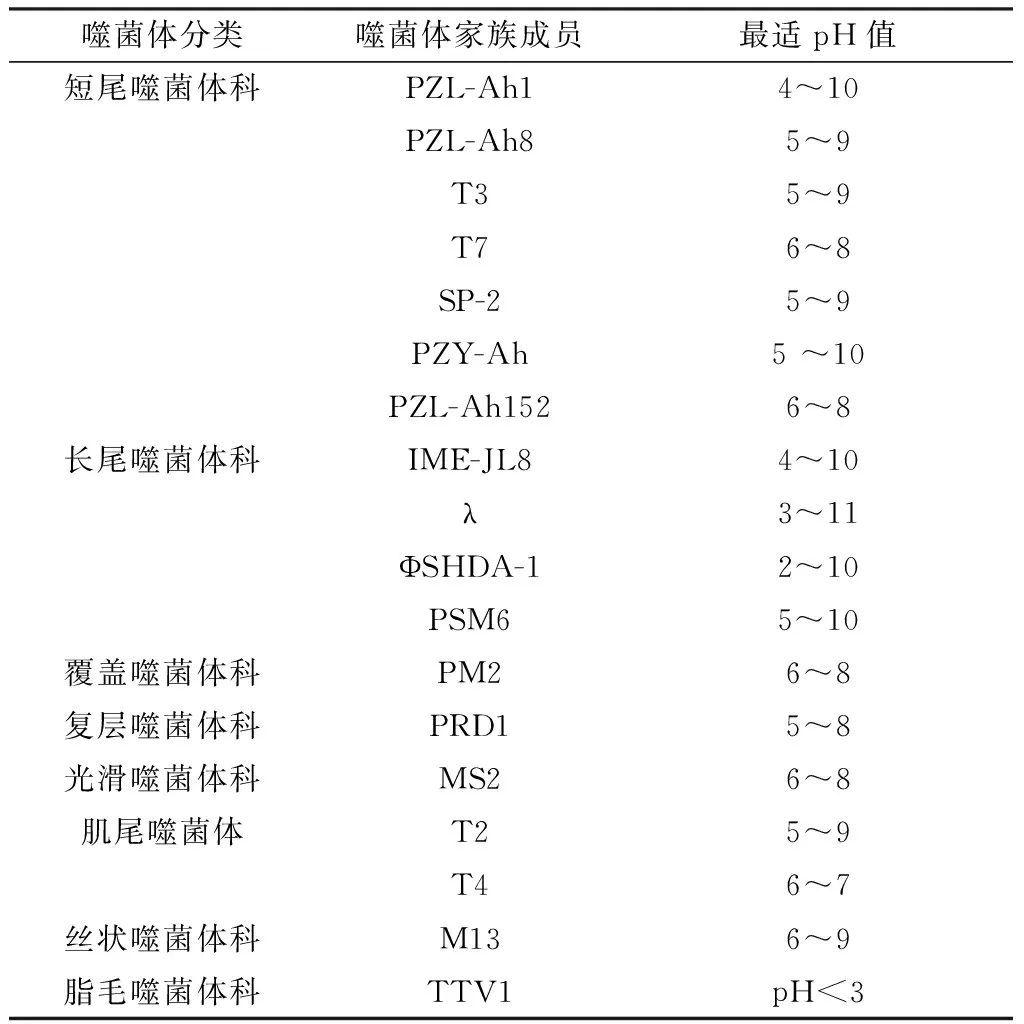
表1 噬菌体分类及其适合生长的pH范围
1.3 注射噬菌体给药注射噬菌体给药途径包括腹腔注射、肌肉注射、皮下注射以及静脉注射,其特点是噬菌体可以通过血液循环到达机体几乎所有器官和组织。研究表明,注射噬菌体的给药效果明显优于其他给药途径。在注射噬菌体后,通常1 h内就可以在小鼠血液循环中检测到活性噬菌体。HUFF等[12]比较雾化喷雾剂和肌内注射噬菌体治疗鸟大肠杆菌感染的治疗效果,在肌内注射噬菌体后鸟的存活率以及血液内噬菌体的含量都远远高于吸入噬菌体给药。MATSUZAKI等[13]发现,腹腔注射纯化的噬菌体phi MR11(MOI≥0.1)可以有效抑制由耐药性金黄色葡萄球菌引起的小鼠败血症,且腹腔注射噬菌体1 h后,小鼠血液中的噬菌体滴度较低,但在6 h后急速增加。研究人员对这种现象的解释是细菌最初结合了原本体内存在的自由噬菌体,从而阻止了phi MR11在整个系统中的快速传播。而6 h后,噬菌体phi MR11随着细菌的扩增而逐渐增多,其在血液中的效价也随之增加。JIA等[14]和张洋等[15]发现通过腹腔注射噬菌体可以有效保护鲫鱼,从而减少嗜水气单胞菌对鲫鱼的侵害,提高了鲫鱼存活率。噬菌体通过注射给药方式最容易克服身体防御屏障,已被证明是噬菌体递送最有效途径。

表2 针对不同动物应用噬菌体治疗的给药途径
2 噬菌体在机体内的循环
进入血液循环中的噬菌体的浓度很大程度上与噬菌体给药剂量有关。由于噬菌体在进入机体循环过程中会被体液稀释,所以这种计量依赖性关系与实验动物的体积和血容量有关。然而早在1957年科学家们就发现,静脉注射噬菌体2.5 min后,兔血液中的实际噬菌体浓度比根据噬菌体剂量在血容量中计算出的假定滴度低100倍左右[1]。KRYSTYNA等[16]通过计算,得出小鼠经静脉注射噬菌体1~5 min内,噬菌体滴度应该为0.4,0.5 h后为0.068。但在实际试验中发现静脉注射噬菌体1~5 min后,血液中噬菌体的滴度值为0.02,而注射0.5 h后的滴度值约为0.003。研究发现噬菌体实际滴度值明显低于假设值,这是由于当噬菌体进入体循环时,不仅会被血液稀释,还可以被单核吞噬细胞捕获或过滤。
肝脏和脾脏是噬菌体聚集的主要场所,相比于血液,肝脏、脾脏中所含噬菌体的效价相对较高,并且停留时间相对较长[17-18]。噬菌体经全身循环后,可在几分钟内到达脾脏和肝脏,并在1~3 h内达到相对较高的滴度[19]。脾脏是检测到活性噬菌体存在时间最长的器官,甚至在给药后多日仍能检测到噬菌体的存在。INCHLEY等[20]发现,通过静脉注射,在小鼠肝脏和脾脏中都能检测到噬菌体,但噬菌体在肝脏中的滴度下降更快。推测是肝脏中存在枯否氏细胞能够迅速地捕获和吞噬噬菌体从而使噬菌体滴度下降。
肾脏在许多药物的清除中起着重要作用,主要反映药物排入尿液的情况。体外研究表明,噬菌体在人和动物的尿液中都能稳定存在。然而由于个体差异,研究人员并非在所有动物或人类的肾脏或尿液中都能检测到活的噬菌体。噬菌体在尿液中的滴度甚至比在血液中还要低几个数量级,且在肾脏中的滴度也远远低于肝脏和脾脏。
噬菌体也可以穿透血脑屏障治疗由某些敏感菌引起的脑内感染。研究人员将不同形态的噬菌体(肌尾、长尾、短尾)注入血液,在动物大脑中发现了活跃的噬菌体。MLLER等[21]证明噬菌体可以治疗脑内的大肠杆菌感染,通过治疗,在感染细菌的动物大脑内,噬菌体的滴度逐渐增高,表明噬菌体在大脑中能有效增殖。影响噬菌体进入大脑的主要因素包括剂量、噬菌体的形态和给药途径[22-23]。FRENKEL等[24]通过研究发现当小鼠发生脑内感染时,通过鼻内注入的丝状噬菌体能够有效进入小鼠大脑。然而对同一噬菌体进行化学诱导使其从丝状变为球状,采用相同的给药途径时发现噬菌体不能进入大脑。
另外,经全身循环后能够检测到噬菌体的器官还有骨骼肌、心脏、胸腺、骨髓和膀胱(图2)。虽然这些器官不能聚集噬菌体,但噬菌体可以到达这些器官从而有效地控制这些器官发生感染。

图2 噬菌体在不同组织器官中的含量
3 影响噬菌体在体内清除的因素
影响噬菌体在体内清除速率因素一方面在于噬菌体本身,包括给药剂量、噬菌体颗粒大小以及噬菌体的修饰和包装,另一方面在于机体的免疫系统对噬菌体清除速率。MICROBIOLOGICA等[25]对比T2噬菌体(肌尾病毒科,90 nm× 200 nm)与phiX174噬菌体(微病毒科,头部直径30 nm)在乳猪体内清除速率发现,T2噬菌体在机体内的清除速率比phiX174噬菌体快,表明在体内体积大的噬菌体颗粒比小的噬菌体更容易被过滤掉。噬菌体的包装和修饰也可以显著改变噬菌体的药代动力学。COLOM等[26]利用海藻酸钠/CaCO3胶囊包装噬菌体以避免其活性被胃液强酸环境破坏。海藻酸钠/CaCO3胶囊包装确保了噬菌体在肠道存活的时间。此外,小尺寸胶囊(125~150 μm)也方便噬菌体口服给药。SALONI等[27]通过试验发现,噬菌体经过纳米脂质体包装,可以有效降低体内酸碱、离子因素对其活性的影响,也可以降低免疫系统对噬菌体的识别,对预防由肺炎克雷伯菌引起的小鼠大叶性肺炎有很大潜力。对比发现,采用脂质体包装的噬菌体在肺炎克雷伯菌感染后3 d内都能提供有效保护,而非脂质体包装的噬菌体有效时间只有24 h。
免疫系统在噬菌体清除过程中起到关键作用,即使没有产生针对噬菌体的特异性抗体,固有免疫系统也会清除外源性噬菌体颗粒。吞噬细胞在体内循环,同时也大量存在于脾脏和肝脏中,该细胞捕获吞噬噬菌体,已被证明是体内主要的“噬菌体陷阱”。KATARZYNA等[28]研究发现在细菌感染期间,固有免疫会得到增强,研究人员利用绿色荧光标记的噬菌体,检测巨噬细胞对噬菌体的吞噬作用,结果在巨噬细胞中检测到大量噬菌体,表明巨噬细胞对噬菌体有吞噬作用。吞噬细胞除了可使噬菌体直接失活外,也是抗原提呈细胞处理和提呈噬菌体抗原的第一步。针对机体产生噬菌体特异性抗体的研究非常广泛,在大多数情况下,噬菌体特异性抗体降低了体循环中活性噬菌体的浓度,然而,并非在所有试验中都会观察到预期的抗体形成或噬菌体具有控制细菌感染的能力。DENOU等[29]、JING等[30]研究发现,小鼠口服或静脉注射噬菌体,在治疗结束后3周才检测到特异性抗体的存在。小鼠口服高剂量T4噬菌体才可以刺激机体产生特异性抗体。
研究表明,外来噬菌体不会影响机体肠道菌群的丰度。程梦珺等[31]通过研究发现,在应用噬菌体治疗由屎肠球菌引起的小鼠肠道感染时,噬菌体可以缓解肠道菌群不平衡,使肠道内菌群恢复到正常值。当应用大剂量噬菌体进行治疗时,虽然会对肠道菌群造成短时间的失衡,但是在治疗过后对试验小鼠的健康和体质量不会造成影响。RASMUSSEN等[32]总结得出,噬菌体群落在不同机体的肠道存在是高度稳定的,外来噬菌体很难在肠道中定植从而影响肠道菌群的丰度,所以在应用外源噬菌体治疗时,外源噬菌体对肠道菌群的影响微乎其微。噬菌体可以将肠道上皮细胞当作转运的介质,从而达到进入机体的目的。NGUYEN等[33]通过研究发现肠道上皮细胞可以吸收并转运噬菌体,从而使噬菌体得以进入机体的其他组织器官。
4 总结
噬菌体对细菌裂解具有特异性,不会杀死真核细胞,也不会破坏机体的正常菌群,其不仅是一种具有应用潜力的新概念药物,在开发新型疫苗方面也具有很大潜力[34-35]。本文从噬菌体的给药方式、体内分布以及体内清除等方面,总结了噬菌体在机体内的药代动力学特征。目前阶段对于噬菌体药代动力学的检测方法主要包括涂板法、同位素标记示踪法、液相色谱-质谱联用法等[36],尚未形成一套系统、准确的检测方法,这是制约噬菌体药代动力学参数准确性的一个方面。另一方面,目前阶段对于噬菌体药代动力学的研究主要集中在哺乳动物尤其是小鼠,禽类则大多数是围绕着鸡来进行,水生生物只有14例是研究鱼类噬菌体治疗的特点,尚未有关于爬行动物和两栖类动物的研究。且不同物种、不同性别、年龄的个体即便用同一种给药方式,噬菌体药代动力学参数都会不同,因此急需更多相关研究,为噬菌体在临床应用提供更多的帮助。综上所述,在对噬菌体药代动力学研究的动物样本进行分析时,应制定一套系统准确的检测方法,以获得噬菌体在不同动物体内吸收、分布、代谢排泄的全面信息,为噬菌体药物在今后的研发和临床应用提供更多的理论依据。

