蟾蜍灵抑制Raf/MEK/细胞外信号调节激酶信号通路活化影响人食管鳞癌细胞增殖及迁移机制研究
丁 妍,王小玲,邓会岩,苏丽宏,张 培,刘月平
·论著·
蟾蜍灵抑制Raf/MEK/细胞外信号调节激酶信号通路活化影响人食管鳞癌细胞增殖及迁移机制研究
丁 妍,王小玲,邓会岩,苏丽宏,张 培,刘月平
目的 探讨蟾蜍灵通过抑制人食管鳞癌细胞Raf/MEK/细胞外信号调节激酶(ERK)信号通路的活化从而影响人食管鳞癌细胞增殖及迁移的作用机制。方法 培养人食管鳞癌细胞株TE13,分为对照组、不同浓度蟾蜍灵组(蟾蜍灵10 nmol/L组、蟾蜍灵25 nmol/L组、蟾蜍灵50 nmol/L组、蟾蜍灵100 nmol/L组)、UO126组和蟾蜍灵100 nmol/L+UO126组,采用Western blotting方法和免疫细胞化学方法分别检测各组Raf-1、磷酸化Raf-1(p-Raf-1)、MEK、磷酸化MEK(p-MEK)、ERK、磷酸化细胞外信号调节激酶(p-ERK)表达量和阳性表达率。划痕实验和Boyden小室实验检测各组细胞的迁移距离和穿过滤膜的细胞数量。结果 蟾蜍灵25 nmol/L组、蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组p-Raf-1、p-ERK表达量低于对照组(P<0.05);蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组p-MEK表达量低于对照组(P<0.05);蟾蜍灵100 nmol/L+UO126组p-Raf-1、p-MEK、p-ERK表达量低于UO126组(P<0.05)。蟾蜍灵25 nmol/L组、蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组p-Raf-1、p-ERK阳性表达率低于对照组(P<0.05);蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组p-MEK阳性表达率低于对照组(P<0.05);蟾蜍灵100 nmol/L+UO126组p-Raf-1、p-MEK、p-ERK阳性表达率低于UO126组(P<0.05)。划痕实验结果显示,蟾蜍灵25 nmol/L组、蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组细胞迁移距离短于对照组(P<0.05);蟾蜍灵100 nmol/L+UO126组细胞迁移距离短于UO126组(P<0.05)。Boyden小室实验结果显示,蟾蜍灵25 nmol/L组、蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组穿过滤膜的细胞数量少于对照组(P<0.05);蟾蜍灵100 nmol/L+UO126组穿过滤膜的细胞数量少于UO126组(P<0.05)。结论 蟾蜍灵可下调细胞内p-Raf-1、p-MEK、p-ERK表达量,提示蟾蜍灵可能是通过抑制Raf/MEK/ERK信号通路活化这一过程而发挥作用,从而抑制人食管鳞癌细胞的生长。蟾蜍灵对人食管鳞癌细胞株TE13的迁移和趋化运动能力具有明显的抑制作用。
食管肿瘤;蟾蜍灵;丝裂原活化蛋白激酶;细胞增殖;细胞运动
丁妍,王小玲,邓会岩,等.蟾蜍灵抑制Raf/MEK/细胞外信号调节激酶信号通路活化影响人食管鳞癌细胞增殖及迁移机制研究[J].中国全科医学,2015,18(21):2535-2541.[www.chinagp.net]
Ding Y, Wang XL, Deng HY, et al.Mechanism of Bufalin affecting the proliferation and migration of human esophageal carcinoma cells through inhibiting the activity of Raf/MEK/ERK pathway[J].Chinese General Practice,2015,18(21):2535-2541.
食管癌是人类常见的恶性肿瘤之一,其发生是多因素作用、多基因参与、多阶段共同发展的结果,然而其发生发展的确切机制尚不明确[1]。我国是世界上食管癌病死率最高的国家之一[2]。尽管近年来通过普查使得食管癌早发现、早诊断、早治疗的水平有所提高,食管癌的预后有所改善,但5年生存率仍较低[3]。因此,继续寻找新的抗肿瘤药物,并了解其在肿瘤发生、发展过程中作用的信号通路成为食管癌临床治疗研究的重点。细胞外信号调节激酶(ERK)是丝裂原活化蛋白激酶(MAPK)信号通路家族的重要成员之一,参与将细胞外信号传递至细胞核的过程,与细胞的分化、增殖有关,并参与细胞的恶性转化。其中,Ras/Raf/MEK/ERK是ERK信号通路的主要途径。蟾蜍灵是从中华大蟾蜍或黑眶蟾蜍的耳后腺及皮肤腺的干燥分泌物中提取的主要活性成分之一,属于强心苷类物质[4],已被用来作为一种传统的中药治疗感染、肿瘤以及麻醉。研究发现,蟾蜍灵可以抑制膀胱癌、肝癌细胞的侵袭和迁移[5-6],也可以通过抑制P13K/Akt信号通路诱导肺癌细胞的凋亡[7-8]。且有相关报道指出,蟾蜍灵是当今用于临床药物治疗肝癌等恶性肿瘤的注射用药华蟾素的有效成分之一,其在临床应用方面已取得令人瞩目的成绩[9]。但蟾蜍灵在人食管鳞癌发生发展中的应用在国内外鲜有报道。本实验将蟾蜍灵应用于食管癌,并观察其对人食管鳞癌细胞株TE13 Raf/MEK/ERK信号通路活化的抑制作用。
1 材料与方法
1.1 材料
1.1.1 细胞 人食管鳞癌细胞株TE13由河北医科大学第四医院科研中心提供。
1.1.2 主要试剂 RPMI 1640培养液(美国Gibco公司);胎牛血清(杭州四季青生物工程材料有限公司);蟾蜍灵、UO126(MEK/ERK磷酸化抑制剂)(上海源叶生物科技有限公司);BCA法蛋白含量测定试剂盒(北京索莱宝生物科技有限公司);兔抗Raf-1多克隆抗体(美国SANTACRUZ公司);兔抗磷酸化Raf-1(p-Raf-1)多克隆抗体(美国SANTACRUZ公司);兔抗 MEK1/2多克隆抗体(美国 SAB 公司);兔抗磷酸化MEK1/2(p-MEK1/2)多克隆抗体(美国 SAB 公司);兔抗人ERK多克隆抗体(美国SANTACRUZ公司);小鼠抗人磷酸化细胞外信号调节激酶(p-ERK)单克隆抗体(美国SANTACRUZ公司);通用型二抗(北京中杉金桥生物技术有限公司);二氨基联苯胺(DAB)显色试剂盒(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 分组 人食管鳞癌细胞株TE13分为对照组、不同浓度蟾蜍灵组(蟾蜍灵10 nmol/L组、蟾蜍灵25 nmol/L组、蟾蜍灵50 nmol/L组、蟾蜍灵100 nmol/L组)、UO126组和蟾蜍灵100 nmol/L+UO126组。其中对照组选用生长状态良好的细胞,将细胞培养于含10%胎牛血清的RPMI 1640培养液中,置37 ℃、5%CO2孵育箱中,1~2 d更换培养液,继续培养细胞备用。其余组均选用生长状态良好的细胞,当细胞生长至80%时,更换无胎牛血清的RPMI 1640培养液培养12~16 h,分别加入不同浓度蟾蜍灵(10、25、50、100 nmol/L)、UO126(20 μmol/L)、蟾蜍灵100 nmol/L+UO126(20 μmol/L),培养2 h后弃去培养液,并加入含15%胎牛血清的RPMI 1640培养液,培养30 min后收集细胞备用。
1.2.2 Western blotting法检测各组蛋白表达量 取对数生长期的细胞,提取总蛋白,测定蛋白浓度,蛋白上清液经聚丙烯酰胺凝胶(SDS-PAGE)电泳(5%浓缩胶、15%分离胶),电泳分离后,恒压转移至硝酸纤维素膜,用含1%脱脂奶粉的TBST缓冲液封闭30 min, 一抗于4 ℃孵育过夜, TBST缓冲液洗涤3次,辣根过氧化物酶标记的二抗于室温孵育2 h,TBST 缓冲液洗涤3次,膜与化学发光底物孵育5 min,经Alphainnotech凝胶成像系统显影、测定灰度值,重复3次。
1.2.3 免疫细胞化学方法观察各组蛋白表达阳性率 制备细胞玻片,取高压消毒后的盖玻片置于无菌的6孔培养板中。取对数生长期细胞,以2×104/ml接种于6孔板中,1 ml/孔。置37 ℃、5%CO2孵育箱培养并处理细胞,进行免疫细胞化学方法染色并计数结果,重复3次。
1.2.4 划痕实验、Boyden小室实验检测细胞迁移和穿过滤膜情况 划痕实验:制备细胞玻片,取高压消毒后的盖玻片置于无菌的6孔板中。取对数生长期的细胞,以2×104/ml接种于6孔板中,1 ml/孔。置37 ℃、5%CO2孵育箱培养。细胞完全融合时,弃去培养液,使用无菌枪头将盖玻片上的细胞轻轻划出“一”字,力道均匀,宽窄一致,并用磷酸盐缓冲液(PBS)清洗2次。根据不同分组处理细胞,冷甲醛固定,苏木素-伊红(HE)染色,24 h后显微镜下测量迁移距离。Boyden小室实验:将高压后的载玻片置于6孔板内,用常规方法消化细胞,调整细胞浓度为2×104个/孔,加入不同溶度的蟾蜍灵(10、25、50、100 nmol/L)、UO126、蟾蜍灵100 nmol/L+UO126,培养后取600 μl分别接种于6孔板内改良Boyden小室内,加入含10%胎牛血清的RPMI 1640培养液常规孵育24 h,棉签擦尽上室面的细胞和人工胶,甲醛溶液固定,HE染色,400倍光镜下取上、下、左、右、中心5个视野,计数滤膜下室面的细胞数量,取均数,重复5次。

2 结果
2.1 Western blotting方法结果 各组Raf-1、MEK、ERK表达量比较,差异均无统计学意义(P>0.05);各组p-Raf-1、p-MEK、p-ERK表达量比较,差异均有统计学意义(P<0.05);其中蟾蜍灵25 nmol/L组、蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组p-Raf-1、p-ERK表达量低于对照组,差异有统计学意义(P<0.05);蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组p-MEK表达量低于对照组,差异有统计学意义(P<0.05);蟾蜍灵100 nmol/L+UO126组p-Raf-1、p-MEK、p-ERK表达量低于UO126组,差异有统计学意义(P<0.05,见表1、图1)。
2.2 免疫细胞化学方法结果 p-Raf-1、p-MEK、p-ERK均表达于细胞质,呈棕黄色颗粒,并且随着药物浓度的增加,阳性细胞数量逐渐减少,棕黄色颗粒逐渐变小,密度逐渐减低(见图2~4)。各组Raf-1、MEK、ERK阳性表达率比较,差异均无统计学意义(P>0.05);各组p-Raf-1、p-MEK、p-ERK阳性表达率比较,差异均有统计学意义(P<0.05);其中蟾蜍灵25 nmol/L组、蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组p-Raf-1、p-ERK阳性表达率低于对照组,差异有统计学意义(P<0.05);蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组p-MEK阳性表达率低于对照组,差异有统计学意义(P<0.05);蟾蜍灵100 nmol/L+UO126组p-Raf-1、p-MEK、p-ERK阳性表达率低于UO126组,差异有统计学意义(P<0.05,见表2)。
2.3 划痕实验、Boyden小室实验方法结果 划痕实验结果显示,各组细胞迁移距离比较,差异有统计学意义(P<0.05);其中,蟾蜍灵25 nmol/L组、蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组低于对照组,差异有统计学意义(P<0.05);蟾蜍灵100 nmol/L+UO126组低于UO126组,差异有统计学意义(P<0.05,见表3、图5)。Boyden小室实验结果显示,各组穿过滤膜的细胞数量比较,差异有统计学意义(P<0.05);其中,蟾蜍灵25 nmol/L组、蟾蜍灵50 nmol/L组和蟾蜍灵100 nmol/L组低于对照组,差异有统计学意义(P<0.05);蟾蜍灵100 nmol/L+UO126组低于UO126组,差异有统计学意义(P<0.05,见表3)。

注:p-Raf-1=磷酸化Raf-1,p-MEK=磷酸化MEK,ERK=细胞外信号调节激酶,p-ERK=磷酸化细胞外信号调节激酶;1为对照组,2为蟾蜍灵10 nmol/L组,3为蟾蜍灵25 nmol/L组,4为蟾蜍灵50 nmol/L组,5为蟾蜍灵100 nmol/L组,6为UO126组,7为蟾蜍灵100 nmol/L+UO126组
图1 Western blotting方法检测各组Raf-1、p-Raf-1、MEK、p-MEK、ERK、p-ERK在人食管鳞癌细胞株TE13中的表达
Figure 1 Expressions of Raf-1, p-Raf-1, MEK, p-MEK, ERK and p-ERK in human esophageal carcinoma cell lines TE13 among different groups were detected by Western blotting method

表1 各组Raf-1、p-Raf-1、MEK、p-MEK、ERK、p-ERK表达量比较
注:p-Raf-1=磷酸化Raf-1,p-MEK=磷酸化MEK,ERK=细胞外信号调节激酶,p-ERK=磷酸化细胞外信号调节激酶;与对照组比较,aP<0.05;与UO126组比较,bP<0.05

图2 各组p-Raf-1在细胞中的表达(免疫细胞化学方法,×400)

图3 各组p-MEK在细胞中的表达(免疫细胞化学方法,×400)

图3 各组p-ERK在细胞中的表达(免疫细胞化学方法,×400)

注:1为对照组,2为蟾蜍灵10 nmol/L组,3为蟾蜍灵25 nmol/L组,4为蟾蜍灵50 nmol/L组,5为蟾蜍灵100 nmol/L组,6为UO126组,7为蟾蜍灵100 nmol/L+UO126组
图5 各组细胞迁移距离
Figure 5 The migration distance of esophageal carcinoma TE13 cells in different groups
表2 各组Raf-1、p-Raf-1、MEK、p-MEK、ERK、p-ERK阳性表达率比较(%,n=3)
Table 2 Comparison of the positive expression rates of Raf-1, p-Raf-1, MEK, p-MEK, ERK and p-ERK among different groups

组别Raf-1p-Raf-1MEKp-MEKERKp-ERK对照组80.3180.2376.5880.3376.4079.60蟾蜍灵10nmol/L组80.2378.6776.4768.4176.8068.00蟾蜍灵25nmol/L组80.1652.22a76.0467.3075.6057.00a蟾蜍灵50nmol/L组80.0549.28a75.4052.62a77.6044.20a蟾蜍灵100nmol/L组80.0137.59a74.9827.00a76.2011.00aUO126组80.1135.4875.8826.0476.2012.23蟾蜍灵100nmol/L+UO126组80.1920.03b76.2415.23b76.337.02bχ2值0.40812011.40310.98715432.0096.83916604.184P值0.999<0.0010.089<0.0010.336<0.001
注:与对照组比较,aP<0.05;与UO126组比较,bP<0.05
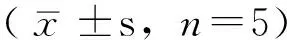
Table 3 Comparison of the migration distance and the number of cells which have penetrated filter membrane among different cell groups
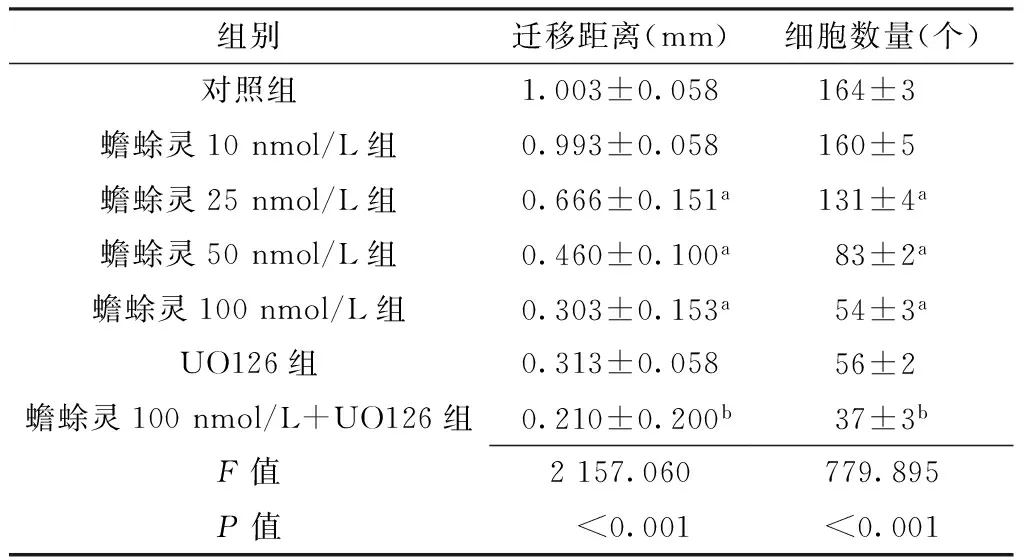
组别迁移距离(mm)细胞数量(个)对照组1.003±0.058164±3蟾蜍灵10nmol/L组0.993±0.058160±5蟾蜍灵25nmol/L组0.666±0.151a131±4a蟾蜍灵50nmol/L组0.460±0.100a83±2a蟾蜍灵100nmol/L组0.303±0.153a54±3aUO126组0.313±0.05856±2 蟾蜍灵100nmol/L+UO126组0.210±0.200b37±3bF值2157.060779.895P值<0.001<0.001
注:与对照组比较,aP<0.05;与UO126组比较,bP<0.05
3 讨论
我国是食管癌高发国家,世界卫生组织(WHO)调查资料显示,我国食管癌患者占全球的47%[10]。目前传统的食管癌治疗方法主要是早期患者尽量采用手术治疗并辅助放射治疗,晚期患者则采用姑息治疗即放化疗相配合。近年来随着化疗药物和分子靶向药物的开发应用、分子生物学的不断发展以及学科之间综合治疗模式的研究进展,食管癌的治疗效果较前有所提高,但患者总体预后仍然较差[11]。因此,寻找新的抗肿瘤药物、研究抗肿瘤药物作用的靶点及与食管癌发生发展相关的信号通路成为食管癌治疗研究的重点。
ERK作为经典的丝裂原活化的MAPK在肿瘤的发生中起了重要作用。Raf/MEK/ERK信号通路是MAPK信号通路的主要途径[12],参与细胞的生长、发育、增殖、分化、凋亡和恶性转化,与肿瘤发生、发展存在不可忽视的联系[13-15],并在细胞的侵袭迁移方面发挥重要作用,人类肿瘤中约70%可见到该信号通路的异常激活。一些细胞因子、外界刺激物通过该途径磷酸化激活ERK,活化的ERK将细胞外刺激信号传至细胞内,引起一系列细胞反应,从而参与并调节细胞生长、发育及分裂。有研究表明,ERK信号通路中活化水平的改变与包括食管癌在内的多种恶性肿瘤的发生发展有关[16],因此该信号通路一直以来均是研究的焦点。为深入探讨Raf/MEK/ERK信号通路的基因调控机制以及其生物学功能,本研究进一步深化了对食管癌发病机制的认识,以便阻断Raf/MEK/ERK信号通路的异常激活,抑制细胞异常增殖分化及肿瘤侵袭转移。
蟾蜍灵(即蟾蜍素)是从中华大蟾蜍或黑眶蟾蜍的耳后腺及皮肤腺的干燥分泌物中提取的主要活性成分之一,属于强心苷类物质[4, 17],也是当今用于临床药物治疗卵巢癌[18]、肺癌[19-20]、前列腺癌[21]、肝癌[22-23]等恶性肿瘤的注射用药华蟾素的有效成分之一,其在临床应用方面已取得令人瞩目的成绩。本实验通过观察蟾蜍灵对食管癌Raf/MEK/ERK信号通路的抑制作用证实,蟾蜍灵可通过抑制Raf/MEK/ERK信号通路活化下调细胞内p-Raf-1、p-MEK、p-ERK表达量,从而阻断ERK信号通路的异常传导,对食管癌细胞的增殖分化、侵袭转移具有明显的抑制作用。本研究结果表明,ERK信号通路的异常传导导致Raf、MEK、ERK的过度激活是影响肿瘤生长与侵袭转移的关键,而蟾蜍灵可显著抑制Raf、MEK、ERK的活化,从而有效降低细胞内p-Raf-1、p-MEK、p-ERK表达量,MEK/ERK磷酸化抑制剂UO126可增强其抑制作用。蟾蜍灵对食管癌增殖的这种抑制作用有效降低了食管癌的发生,并为食管癌的临床治疗提供了实验基础。在细胞迁移趋化方面,本实验结果表明,蟾蜍灵可使食管癌细胞的迁移趋化能力明显减弱,UO126同样可增强其对细胞迁移趋化作用的抑制,有力证实了蟾蜍灵在抑制食管癌侵袭转移方面发挥重要作用,这为临床治疗食管癌提供了可靠的理论依据。
本实验结果提示,蟾蜍灵可能是通过抑制Raf/MEK/ERK信号通路中蛋白的活化来发挥抑制肿瘤细胞增殖、侵袭、迁移等的作用。大量研究发现,信号转导调节系统的异常在肿瘤发生发展、侵袭迁移过程中发挥重要作用[24-26]。Watabe等[27]研究发现,蟾蜍灵的抗肿瘤作用与MAPK信号通路的活化密切相关。亦有研究证实,蟾蜍灵可以抑制肝癌细胞的迁移[28],但蟾蜍灵对食管癌细胞的抑制作用及其机制的研究报道甚少。本实验研究证实,蟾蜍灵在食管癌发生发展、侵袭迁移过程中发挥抑制作用,为蟾蜍灵在食管癌方面的研究提供新的资料,对临床治疗食管癌提供了有力的实验基础与治疗新动向,具有指导意义。
由于细胞凋亡及肿瘤的发生发展是一个多步骤、多因子参与的极其复杂的过程,本实验仅在肿瘤的增殖和迁移方面进行了研究,蟾蜍灵诱导肿瘤细胞凋亡、抗癌的详细机制及临床受益程度尚不明确,仍需进一步深入研究。
[1]Han SJ,Wei WQ,Zhang ST,et al.Risk factors of esophageal cancer in a high-risk area in China[J].Chinese General Practice,2012,15(11):3745.(in Chinese) 韩书婧,魏文强,张澍田,等.食管癌高发地区人群危险因素的调查研究[J].中国全科医学,2012,15(11):3745.
[2]Hou JL.Clinical effectation of Shenqifuzheng injection combined with concurrent chemoradiotherapy in treating esophageal carcinoma[J].Chinese Journal of Coal Industry Medicine,2012,15(8):1244-1246.(in Chinese) 侯激流.参芪扶正注射液在食管癌同步放化疗中的作用[J].中国煤炭工业医学杂志,2012,15(8):1244-1246.
[3] Yue F,Jia T.Clinical observation of paclitaxel liposome and paclitaxel in the treatment of patients with advanced esophageal cancer[J].Pratical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2010,18(10):1474.(in Chinese) 岳峰,贾涛.紫杉醇脂质体与紫杉醇治疗晚期食管癌的疗效研究[J].实用心脑肺血管病杂志,2010,18(10):1474.
[4]Krenn L,Kopp B.Bufadienolides from animal and plant sources[J].Phytochemistry, 1988, 48(1):1-29.
[5]Hong SH,Kim GY,Chang YC,et al.Bufalin prevents the migration and invasion of T24 bladder carcinoma cells through the inactivation of matrix metalloproteinases and modulation of tight junctions[J].Int J Oncol,2013,42(1):277-286.
[6]Chen YY,Lu HF,Hsu SC,et al.Bufalin inhibits migration and invasion in human hepatocellular carcinoma SK-Hep1 cells through the inhibitions of NF-κB and matrix metalloproteinase-2/-9-signaling pathways [J].Environ Toxicol,2015,30(1):74-82.
[7]Zhu Z,Sun H,Ma G,et al.Bufalin induces lung cancer cell apoptosis via the inhibition of P13K/Akt pathway[J].In J Mol Sci,2012,13(2):2025-2035.
[8]Yin PH, Liu X, Qiu YY, et al.Anti-tumor activity and apoptosis-regulation mechanisms of bufalin in various cancers:new hope for cancer patients[J].Asian Pac J Cancer Prev,2012,13(11):5339-5343.
[9] Qiu DZ,Zhang ZJ,Wu WZ,et al.Bufalin, a component in Chansu, inhibits proliferation and invasion of hepatocellular carcinoma cells[J].BMC Complement Altern Med,2013,19(13):185.
[10]Zhang ZB, Zhu Y, Xi JF.The observation of clinical effect of docetaxel combinate cisplatin applied in advanced esophageal cancer[J].Modern Medicine Journal of China, 2014, 16(8):73-74.(in Chinese) 张志斌,朱艳,席俊峰.晚期食管癌应用多西他赛联合顺铂治疗的临床疗效观察[J].中国现代医药杂志,2014, 16(8):73-74.
[11]Hu Z, Zhou GS, Zhou GB.Molecular-targeted therapy for cancer[J].Chinese Medicinal Biotechnology,2010, 5(5):335-341.(in Chinese) 胡政,周桂生,周光飚.肿瘤的分子靶向治疗[J].中国医药生物技术杂志,2010, 5(5):335-341.
[12]McCubrey JA,Steelman LS,Chappell WH,et al.Roles of the Raf/MEK/ERK pathway in cell growth, malignant transformation and drug resistance[J].Biochim Biophys Acta,2007,1773(8):1263-1284.
[13]Xu YB,Du QH,Zhang MY,et al.Propofol suppresses proliferation, invasion and angiogenesis by down-regulating ERK-VEGF/MMP-9 signaling in Eca-109 esophageal squamous cell carcinoma cells[J].Eur Rev Med Pharmacol Sci,2013,17(18):2486-2494.
[14]Li G,Mu ZY,Huang Y,et al.Anti-prostate cancer effect of carvacrol via MAPK signaling pathway[J].Academic Journal of Second Military Medical University,2014,35(3):285-290.(in Chinese) 李刚,穆中一,黄炎,等.香芹酚通过MAPK信号通路抗前列腺癌作用机制研究[J].第二军医大学学报,2014,35(3):285-290.
[15]Kim SO,Kim MR.Gingerol prevents disassembly of cell junctions and activities of MMPs in invasive human pancreas cancer cells through ERK/NF-κB/snail signal transduction pathway[J].Evid Based Complement Alternat Med,2013,2013:761852-761860.
[16]Zhao M,Liu YP,Liu SZ,et al.Expression and clinical significance of ERK in esophageal squamous cell carcinoma [J].Chinese Journal of Cancer Biotherapy,2011,18(5):447-449.(in Chinese) 赵萌,刘月平,刘世正,等.食管鳞状细胞癌中ERK的表达及其临床意义[J].中国肿瘤生物治疗杂志,2011,18(5):447-449.
[17]Panesar NS.Bufalin and unidentified substance(s) in traditional Chinese medicine cross-react in commercial digoxin assay[J].Clin Chem,1992,38(10):2155-2156.
[18]Takai N,Kira N,Ishii T,et al.Bufalin, a traditional oriental medicine, induces apoptosis in human cancer cells[J].Asian Pac J Cancer Prev,2012,13(1):399-402.
[19]Zhu Z,Sun H,Ma G,et al.Bufalin induces lung cancer cell apoptosis via the inhibition of P12K/Akt pathway [J].Int Mol Sci,2012,13(2):2025-2035.
[20]Ding DW,Zhang YH,Huang XE,et al.Bufalin induces mitochondrial pathway-mediated apoptosis in lung adenocarcinoma cells[J].Asian Pac J Cancer Prev,2014,15(23):10495-10500.
[21]Yin PH,Liu X,Qiu YY,et al.Anti-tumor activity and apoptosis-regulation mechanisms of bufalin in various cancers:new hope for cancer patients[J].Asian Pac J Cancer Prev,2012,13(11):5339-5343.
[22]Tsai SC,Yang JS,Peng SF,et al.Bufalin increases sensitivity to AKT/mTOR-induced autophagic cell death in SK-HEP-1 human hepatocellular carcinoma cells[J].Int J Oncol,2012,41(4):1431-1442.
[23]Miao Q, Bi LL, Li X, et al.Anticancer effects of bufalin on human hepatocellular carcinoma HepG2 cells:roles of apoptosis and autophagy[J].Int J Mol Sci,2013,14(1):1370-1382.
[24]Zhao M,Liu YP,Liu SZ,et al.The role and significance of ERK and its activation in esophageal squamous cell carcinoma[J].Chinese Journal of Clinical and Experimental Pathology,2011,27(11):1037-1040.(in Chinese) 赵萌,刘月平,刘世正,等.食管鳞癌中ERK及其活化形式蛋白的表达及意义[J].临床与实验病理学杂志,2011,27(11):1037-1040.
[25]Li F,Wang H,Niu GL,et al.Effect of curcumin on radiosensitization of breast cancer cell MDA-MB-231[J].China Journal of Modern Medicine,2013,23(35):33-37.(in Chinese) 李峰,王辉,牛国梁,等.姜黄素对乳腺癌MDA-MB-231细胞株放射增敏作用的研究[J].中国现代医学杂志,2013,23(35):33-37.
[26]Wang X,Gao P,Lin F,et al.Wilms′ tumour suppressor gene 1(WT1) is involved in the carcinogenesis of lung cancer through interaction with PI3K/Akt pathway[J].Cancer Cell Int,2013,13(1):114.
[27]Watabe M,Masuda Y,Nakajo S,et al.The cooperative interaetion of two different signaling pathways in response to bufalin induces apoptosis in human leukemia U937 cells[J].J Biol Chem,1996,271(24):14067-14072.
[28]Gai JQ,Qin JM,Fan YZ,et al.Bufalin inhibits and invasion of cancer cells proliferation human liver[J].World Chinese Journal of Digestology,2014,22(14):1921-1927.(in Chinese) 盖吉钦,秦建民,范跃祖,等.蟾毒灵对人肝癌细胞增殖与侵袭的影响[J].世界华人消化杂志,2014,22(14):1921-1927.
(本文编辑:陈素芳)
Mechanism of Bufalin Affecting the Proliferation and Migration of Human Esophageal Carcinoma Cells Through Inhibiting the Activity of Raf/MEK/ERK Pathway
DINGYan,WANGXiao-ling,DENGHui-yan,etal.
DepartmentofPathology,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China
Objective To explore the mechanism of Bufalin affecting the proliferation and migration of human esophageal carcinoma cells through inhibiting the activity of Raf/MEK/ERK pathway.Methods The esophageal carcinoma cell lines TE13 were divided into control group, bufalin 10 nmol/L group, bufalin 25 nmol/L group, bufalin 50 nmol/L group, bufalin 100 nmol/L group, Uo126 group and bufalin 100 nmol/L+UO126 group, Western blotting and immunocytochemistry were performed to detect the expression quantities of Raf-1/p-Raf-1, MEK/p-MEK and ERK/p-ERK in different groups of TE13 cells, and positive expression rates of Raf-1/p-Raf-1, MEK/p-MEK and ERK/p-ERK were calculated.Wound Healing assay and Boyden cabin experiment were used to explore the cell migration distance in different cell groups and the number of cells which had penetrated filter membrane.Results The expression quantities of p-Raf-1 and p-ERK in bufalin 25 nmol/L group, bufalin 50 nmol/L group and bufalin 100 nmol/L group were significantly fewer than those in control group, respectively(P<0.05).The expression quantities of p-MEK in bufalin 50 nmol/L group and bufalin 100 nmol/L group were significantly fewer than those in control group, respectively(P<0.05).The expression quantities of p-Raf-1, p-MEK and p-ERK in bufalin 100 nmol/L+UO126 group were significantly fewer than those in UO126 group, respectively(P<0.05).The positive expression rates of p-Raf-1 and p-ERK in bufalin 25 nmol/L group, bufalin 50 nmol/L group and bufalin 100 nmol/L group were significantly lower than those in control group, respectively(P<0.05).The positive expression rates of p-MEK in bufalin 50 nmol/L group and bufalin 100 nmol/L group were significantly lower than those in control group, respectively(P<0.05).The positive expression rates of p-Raf-1, p-MEK and p-ERK in bufalin 100 nmol/L+UO126 group were significantly lower than those in control group, respectively(P<0.05).According to results of Wound Healing assay, the cell migration distance in bufalin 25 nmol/L group, bufalin 50 nmol/L group and bufalin 100 nmol/L group was significantly shorter than that in control group, respectively(P<0.05);the cell migration distance in bufalin 100 nmol/L+UO126 group was significantly shorter than that in UO126 group(P<0.05).According to results of Boyden cabin experiment, the number of cells which had penetrated filter membrane in bufalin 25 nmol/L group, bufalin 50 nmol/L group and bufalin 100 nmol/L group was significantly fewer than that in control group(P<0.05);the number of cells which had penetrated filter membrane in bufalin 100 nmol/L+UO126 group was significantly fewer than that in UO126 group(P<0.05).Conclusion Bufalin can reduce the expression quantities of p-Raf-1, p-MEK and p-ERK.Bufalin may inhibit esophageal carcinoma cells growth though inhibiting the activity of Raf/MEK/ERK pathway.Bufalin can inhibit the migration and chemotaxis of human esophageal carcinoma cell lines TE13.
Esophageal neoplasms;Bufalin;Mitogen-activated protein kinase;Cell proliferation;Cell movement
国家自然科学基金青年基金资助项目(81303271);河北省卫生厅2013年医学科学研究课题计划(20130545)
050011 河北省石家庄市,河北医科大学第四医院病理科
刘月平,050011 河北省石家庄市,河北医科大学第四医院病理科;E-mail:annama@163.com
R 571
A
10.3969/j.issn.1007-9572.2015.21.010
2014-12-10;
2015-03-17)

