岩藻黄素对阿霉素引起心肌细胞毒性的保护作用研究
王 飞,赵玉勤,丁国芳,罗李王,张亚茹,杨最素
(1.浙江海洋学院食品与医药学院,浙江省海洋生物医用制品工程技术研究中心,浙江舟山 316022;2.浙江省海洋水产研究所,浙江舟山 316022)
岩藻黄素对阿霉素引起心肌细胞毒性的保护作用研究
王 飞1,赵玉勤1,丁国芳2,罗李王1,张亚茹1,杨最素1
(1.浙江海洋学院食品与医药学院,浙江省海洋生物医用制品工程技术研究中心,浙江舟山 316022;2.浙江省海洋水产研究所,浙江舟山 316022)
主要探究了岩藻黄素(Fucoxanthin,FUC)对阿霉素(adriamycin,ADR)引起心肌细胞毒性的保护作用。采用DPPH法测定FUC对自由基的清除作用;通过MTT法检测FUC对ADR引起H9C2细胞毒性的保护效果;AO/EB染色法观察H9C2细胞的形态学变化;经Carboxy-DCFDA法测定H9C2细胞内活性氧生成水平变化及Western Blotting检测H9C2细胞凋亡相关蛋白表达。结果表明:DPPH法结果显示FUC具有较强的清除氧自由基能力,IC50小于Vc;FUC对ADR引起的H9C2细胞毒性有较好的保护作用;FUC可以减少ADR引起的H9C2细胞凋亡小体的增加;FUC能抑制由ADR引起的H9C2细胞内活性氧水平升高;FUC可以抑制ADR引起的H9C2细胞内凋亡蛋白Caspase-8水平的下调以及Cleaved Caspase-3、Cleaved PARP水平的上调。结论:FUC具有保护ADR引起心肌细胞毒性的作用,其机理有可能是通过其抗氧化活性抑制ADR引起的心肌细胞氧化应激,进而抑制由ADR引起心肌细胞Caspase-8的活化,进一步抑制由ADR引起的Caspase-3激活及对PARP的剪切来保护心肌细胞的。
阿霉素;心肌细胞毒性;岩藻黄素
阿霉素(Adriamycin,ADR)是一种蒽环类抗肿瘤抗生素,可抑制RNA和DNA的合成,对RNA的抑制作用最强,抗瘤谱较广,对多种肿瘤均有作用,属周期非特异性药物,对各种生长周期的肿瘤细胞都有杀灭作用。阿霉素主要适用于急、慢性白血病及恶性淋巴瘤、乳腺癌等实体瘤[1]。然而,在临床应用过程中,其结构中蒽环以及醌基产生大量的活性氧自由基(ROS),引起线粒体、微粒体脂质过氧化,对心肌细胞产生强烈的损伤作用,产生阿霉素心脏毒性[2-4],这将严重影响患者的身心健康。因此,找到能降低阿霉素心脏毒性的药物对其临床应用非常必要。
右丙亚胺(Dexrazoxane,DEX)是美国Chiron公司开发的一个强效IE向心脏保护药,是目前唯一被证实,在癌症患者接受蒽环类药物治疗过程中有心脏保护作用的药物。右丙亚胺与ADR联合应用时对后者的心脏毒性有保护作用,但其发挥心脏保护作用的机制尚不十分清楚,有关其作用机制的报道大多来自离体试验和动物试验[5,6]。但右丙亚胺一般比较容易耐受,近来的报道称右丙亚胺在减弱ADR心脏毒性的同时也降低了ADR的抗肿瘤效果,同时具有引发继发性恶性肿瘤的风险的可能,比如急性白血病[7];且其价格昂贵。因此,探寻一种新的保护ADR引起心脏毒性同时不减弱ADR的抗肿瘤效果的保护剂成为ADR临床应用的迫切需要。
研究发现,海藻提取物中很多具有抗氧化和抗癌功能[8]。岩藻黄素(fucoxanthin,FUC)也称褐藻黄素,是自可食用褐藻中,如裙带菜Undaria pinnatifida、海带Laminaria japonica aresch和马尾藻Sargassum fulvellum等提取出来的天然类胡萝卜素。目前大量文献表明,FUC具有清除活性氧自由基的作用,抗氧化能力十分强[9,10],且FUC对肿瘤细胞有明显的抑制作用[11]。由以上可推测,FUC可能对ADR引起的心脏毒性有保护作用,并且与ADR合用可能具有更强的抗肿瘤效果。本课题主要是对FUC对ADR引起的心脏毒性保护进行研究。
1 材料与方法
1.1 细胞株
大鼠原代心肌H9C2细胞株购于中科院上海细胞库,由本实验室传代保存。
1.2 药物与试剂
岩藻黄素(成都普瑞法科技开发有限公司);阿霉素(浙江海正药业股份有限公司);DMEM培养基和胎牛血清(美国Gibco公司);MTT(美国Sigma公司);AO/EB(吖啶橙/溴化乙锭)(杭州昊天生物技术有限公司);Cleaved Caspase-3、PARP、Caspase-8抗体与辣根酶标记的山羊抗小鼠辣根酶标记抗体、山羊抗兔辣根酶标记抗体(北京中杉金桥生物技术有限公司)。
1.3 主要仪器
ZHJH-C1209C型超净工作台(上海智诚分析仪器制造有限公司);酶标仪(美国Bio-Rad公司);easyCyte6 HT-2L流式细胞仪(Millipore公司);BX2-FLB3荧光显微镜(OLYMPU公司);电泳仪(美国Bio-Rad公司);Fluor Chem FC3化学发光成像分析系统(美国Alpha公司)。
1.4 试验方法
1.4.1 DPPH法测定岩藻黄素对自由基的清除作用
取2 μL FUC样品液(50、25、12.5、6.25、3.125 μmol/L),加入25 μg/mL的DPPH甲醇溶液200 μL,混匀,室温静置30 min。以甲醇做空白对照,在517 nm下测吸光度值。以Vc作为阳性对照。DPPH自由基清除率按以下公式计算:

其中,As为DPPH溶液的吸光值,Ai为加入FUC或VC后的吸光值
以半数抑制率(IC50)表示清除活性。
算得样品相应浓度下的酶抑制百分率,用Logit法计算IC50及95%可信度。
1.4.2 MTT法测定岩藻黄素对阿霉素引起H9C2细胞毒性的保护作用
取H9C2细胞,用DMEM培养液吹匀成细胞悬液,用细胞计数板计数后稀释成浓度3×104个细胞/mL的细胞悬液,接种于96孔板,每孔常规培养液100 μL,置于细胞培养箱中培养24 h后加入FUC,每个浓度设置3个复孔。加FUC(0、25、50 μmol/L)后放入培养箱继续培养24 h后加入ADR(0.016、0.08、0.4、2、10 μmol/L),ADR作用24 h后,每孔加MTT每孔加10%MTT 200 μL,培养箱中培养4 h吸净,加DMSO 150 μL,震荡10 min,最后酶标仪(λ=490 nm)下检测吸光度(OD值),最后计算细胞抑制率:
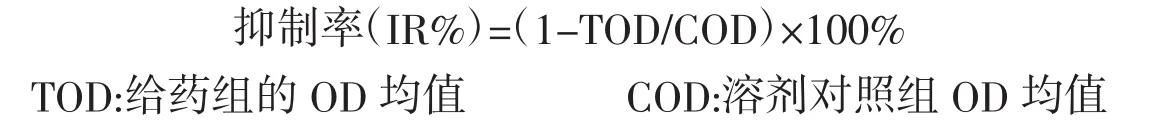
1.4.3 AO/EB染色法观察H9C2细胞形态变化
于6孔培养板内放入经处理过的盖玻片,将浓度为1×105/mL H9C2细胞悬浮接种于培养板中的盖玻片上,常规条件下培养24 h,弃培养液,加50 μmol/L FUC处理24 h后联合应用2 μmol/L ADR处理H9C2细胞24 h及设立ADR和FUC单用组,并设立空白对照组。24 h后,取出盖玻片,用95%乙醇固定30 min。(取AO和EB各1 mg分别溶解于10 mL pH7.2的PBS缓冲液中,摇匀混合,现配现用,避光保存。)观察前于载玻片上滴加40 μL PBS和10 μL AO/EB混合液,有细胞的一面朝下,荧光显微镜下观察并拍照。
1.4.4 Carboxy-DCFDA法测定H9C2细胞内活性氧生成水平变化
细胞接种与实验分组同“1.4.3”。24 h后,除去培养液后用消化液消化,并用PBS洗两遍,加入终浓度为15 μmol/L的Carboxy-DCFDA在37℃水浴中孵育30 min。将细胞用PBS洗两次,最后流式细胞仪在FL-1通道来测定绿色荧光强度,计算ROS含量变化。染色操作过程需在黑暗条件下进行。
1.4.5 Western Blotting检测H9C2细胞凋亡相关蛋白表达
设立FUC(50 μmol/L)、ADR(2 μmol/L)、FUC与ADR合用及空白对照组,加入RIPA(250 μL/50 mm2) +PMSF(10 μL/mL)后反复吹打,冰上细胞裂解30 min。收集细胞裂解液,离心,收集上清液。按照测定的蛋白含量取等体积的蛋白提取液,与5×SDS Loading按1:4的比例均匀混合后变性,-80℃储存备用。变性后的蛋白提取液采用SDS-PAGE电泳法,按照实验需要先后配置分离胶和浓缩胶;取蛋白样品各25 μL经上样缓冲液处理后上样,电压60 v电泳25 min后转换电压100 v,电泳90 min;采用湿法将蛋白转印至PVDF膜上,将PVDF膜至于5%脱脂奶粉中4℃封闭2 h;用TBST 10 mL溶液洗3次,TBS 10 mL溶液洗膜1次,将膜置于1%BSA溶液稀释后的一抗的杂交袋,4℃孵育过夜;洗膜后加入1%BSA的溶液稀释的辣根过氧化物酶标记的二抗,4℃摇床孵育2 h后,洗膜后用ECL显影,使用Alpha化学发光仪进行扫描并记录光密度强度。以β-actin作为内参对照校正并做相对量分析。
1.4.6 数据处理
所有实验组均进行3次平行试验,实验数据使用SPSS 19.0统计软件分析处理,实验结果以±s表示。
2 结果与分析
2.1 DPPH法结果
物质清除DPPH的能力反映其抗氧化活性的强弱。不同浓度的FUC的DPPH清除能力如图1所示,不同浓度的FUC具有不同的DPPH清除能力,且呈现出浓度依赖性。FUC 12.5 μmol/L和Vc 12.5 μmol/L浓度下对DPPH的清除率分别为64.2%和33.0%,FUC和Vc的IC50分别为10.88 μmol/L和14.37 μmol/L。

图1 DPPH法测定岩藻黄素自由基清除作用结果Fig.1 Determination of free radical scavenging effect of fucoxanthin by DPPH
2.2 MTT结果
不同浓度的ADR合用不同浓度FUC对H9C2细胞的抑制率如表1所示,ADR合用FUC后对H9C2细胞的抑制率明显降低。当ADR的浓度为2 μmol/L,FUC的浓度为0 μmol/L时,H9C2细胞的抑制率为52.75±4.98%。当ADR的浓度为2 μmol/L,FUC的浓度为25 μmol/L时,H9C2细胞的抑制率为41.88±6.67%(P<0.05)。当ADR的浓度为2 μmol/L,FUC的浓度为50 μmol/L时,H9C2细胞的抑制率为39.80±2.57%(P<0.05)。FUC与ADR合用组相比ADR单用组H9C2细胞的抑制率明显降低,且FUC对ADR引起H9C2细胞毒性的保护作用呈浓度依赖性。

表1 MTT法测定岩藻黄素对H9C2细胞的保护作用结果Tab.1 Protective effect of fucoxanthin on H9C2 cells was determined by MTT method
2.3 AO/EB染色法结果
空白对照组、FUC单用组、ADR单用组及FUC与ADR合用组中H9C2细经AO、EB双重染色,荧光显微镜下观察,结果如图2所示。空白对照组和FUC单用组无明显凋亡细胞。ADR单用组出现大量H9C2早期凋亡细胞,表现为细胞核为AO染色呈黄绿色荧光,浓聚成新月形或颗粒状,位于细胞的一侧。另外,还有少量晚期凋亡细胞并有凋亡小体出现,表现为细胞核为EB染色呈桔红色,浓聚和偏向。而FUC与ADR合用组中H9C2细胞凋亡数明显低于ADR单用组。

图2 AO/EB对H9C2细胞染色结果(200)A:空白对照组B:岩藻黄素50 μmol/L;C:阿霉素2 μmol/L;D:岩藻黄素50 μmol/L+阿霉素2 μmol/LFig.2 AO/EB staining results of H9C2 cells(200)A:Control B.FUC 50 μmol/L;C:ADR 2 μmol/L;D:ADR 2 μmol/L+FUC 50μmol/L
2.4 Carboxy-DCFDA法结果
生理情况下,活性氧自由基的产生和清除处于动态平衡,任何原因致自由基产生过多和/或自由基清除不力均可致自由基净水平的增加,进而引发脂质过氧化损伤,且脂质过氧化的多种降解产物如MDA可致染色体断裂、DNA交联损伤等。从图3中可以看出空白组与FUC单用组的H9C2细胞ROS水平较低,ADR单用组H9C2细胞ROS水平明显高于正常组与FUC单用组,而FUC与ADR合用组H9C2细胞ROS水平较ADR单用组明显下降(P<0.05)。
2.5 Western Blotting结果
空白对照组、FUC单用组、ADR单用组及FUC与ADR合用组中H9C2细胞内Caspase-8、Cleaved Caspase-3、PARP的蛋白电泳条带如图4所示。图4中,FUC单用组的Caspase-8、Cleaved Caspase-3、PARP的水平较空白对照组未有明显变化;ADR单用组Caspase-8的水平明显下降,Cleaved Caspase-3、PARP裂解片段(Cleaved PARP)的水平明显升高;FUC与ADR合用组中Caspase-8的水平较ADR单用组明显上调,Cleaved Caspase-3、Cleaved PARP的水平明显低于ADR单用组。从结果中可以看出,FUC对ADR引起的H9C2细胞内的Caspase-8水平下降有明显的上调作用,对ADR引起的Cleaved Caspase-3、Cleaved PARP水平升高具有显著的下调作用。

图4 Caspase-8、PARP、Cleaved Caspase-3蛋白表达电泳图Fig.4 Caspase-8,PARP,Caspase-3 Cleaved protein electrophoresis bands
3 结论与讨论
本课题对岩藻黄素对阿霉素引起心肌细胞毒性的保护作用进行了探究。首先,我们通过DPPH法测定了岩藻黄素对自由基的清除能力,结果显示其IC50为10.88 μmol/L,对自由基的清除能力强于Vc,说明岩藻黄素具有较强的抗氧化能力。其次,我们通过MTT法检测岩藻黄素对阿霉素引起H9C2细胞毒性的保护作用,结果显示岩藻黄素与阿霉素合用后H9C2细胞的抑制率明显下降,且岩藻黄素对阿霉素引起H9C2细胞毒性的保护作用呈浓度依赖性。通过AO/EB染色法观察H9C2细胞形态变化,结果显示阿霉素合用岩藻黄素后H9C2细胞凋亡小体明显减少,表明岩藻黄素可以显著抑制由阿霉素引起的心肌细胞凋亡,对心肌细胞毒性具有较强的保护作用。
研究发现,阿霉素是通过降低心肌细胞内抗氧化酶活性,造成自由基清除功能障碍,从而引起心肌细胞氧化损伤的[12]。活性氧簇ROS是细胞代谢的副产物,少量的ROS有助于促进细胞的增殖和分化,然而过量的ROS能对细胞内的脂类、蛋白质和DNA造成氧化损伤[13,14]。从DPPH的实验结果中,我们已经得知岩藻黄素具有较强的抗氧化能力。进一步,我们通过Carboxy-DCFDA法测定了H9C2细胞内活性氧生成水平变化,得出阿霉素与岩藻黄素合用后能够显著抑制由阿霉素诱导的H9C2细胞内活性氧水平升高,表明岩藻黄素有可能是通过减少H9C2细胞内活性氧的产生,抑制心肌细胞的氧化应激对心肌细胞毒性产生保护作用。
另有研究表明,细胞凋亡的死亡受体途径依赖于ROS[15]。所以,我们进一步推测岩藻黄素对H9C2心肌细胞的保护机制有可能与阻断死亡受体途径有关。为验证我们的推测,本研究通过Western Blotting对H9C2细胞死亡受体途径相关凋亡蛋白的表达进行了检测。在死亡受体介导的细胞凋亡途径中,Caspase-8是关键的启动型Caspase。从我们的实验结果中可以看出,岩藻黄素与阿霉素合用组中Caspase-8的水平明显高于阿霉素单用组,说明岩藻黄素有可能通过抑制阿霉素诱导的Caspase-8活化,从死亡受体途径上游抑制H9C2细胞的凋亡,对阿霉素引起的心肌细胞毒性产生保护作用。
在死亡受体途径中后期,活化后的Caspase-8能够引发Caspase蛋白酶解级联反应,并进一步链式水解激活其下游的同源酶,如Caspase-6、Caspase-7等,最后激活其效应物Caspase-3发生凋亡效应。Caspase-3是细胞凋亡下游的关键执行者。活化的Caspase-3可以降解ADP-核糖多聚合成酶(PARP),激活核内核酸内切酶,使核小体间DNA链水解断裂,产生凋亡所特有的DNA节段化。在我们的实验结果中可以看出岩藻黄素与阿霉素合用组中Cleaved Caspase-3与Cleaved PARP的水平明显低于阿霉素单用组,说明岩藻黄素有可能通过抑制由阿霉素引起死亡受体抑制下游关键Caspase的活化从而对H9C2细胞毒性进行保护。
综上所述,本实验得出岩藻黄素对阿霉素引起心肌细胞毒性具有保护作用,其保护机理有可能是通过其抗氧化活性抑制阿霉素引起的心肌细胞氧化应激,进而抑制由阿霉素引起心肌细胞Caspase-8的活化,进一步抑制由阿霉素引起的Caspase-3激活及对PARP的剪切来保护心肌细胞的。而岩藻黄素是否具有对阿霉素引起心脏毒性的保护作用还需要进一步的体外实验进行探究。
[1]OLIVEIRA M S,CARVALHO J L,CAMPOS A C,et al.Doxorubicin has in vivo toxicological effects on ex vivo cultured mesenchy-mal stem cells[J].Toxicol Lett,2014,224(3):380-386.
[2]STEBA M,POPELOAVA O,VAVROVA A,et al.Oxiative stress,redox signaling,and metal chelation in anthracycline cardiotoxicity and pharmacological cardioprotection[J].Anioxid Redox Signal,2013,18(8):899-920.
[3]HARAKE D,FRANCO V I,HENKEL J M,et al.Cardiotoxicity in childhood cancer survivors:strategies for prevention and management[J].Future Cardiol,2012,8(4):647-670.
[4]MARIOTTO A B,ROWLAND J H,YABROFF K R,et al.Long-term survivors of childhood cancers in the United State[J]. Cancer Epidemiol Biomarkers Prev,2009,18(4):1 033-1 040.
[5]WISEMAN L R,SPENCER C M.Dexrazoxane:a review of its use as a cardioprotective agent in patients receiving anthracyclinebased chemotherapy[J].Drugs,1998,56:385-403.
[6]HASINOFF B B,HELLMANN K,HERMAN E H,et al.Chemical,biological and clinical aspects of dexrazoxane and other bisdioxopiperazines[J].Curr Med Chem,1998,5:1-28.
[7]TEBBI C K,LONDON W B,FRIEDMAN D,et al.Dexrazoxane-associated risk for acute myeloid leukemia/myelodysplastic syndrome and other secondary malignancies in pediatric Hodgkin's diseas[J].J Clin Oncol,2007,25(5):493-500.
[8]丁国芳,郑玉寅,杨最素,等.海洋保健食品研究进展[J].浙江海洋学院学报:自然科学版,2010,29(2):162-166.
[9]HEO S J,JEON Y J.Protective effect of fucoxanthin islated from Sargassum siliquastrum on UV-B induced cell damage[J].J Photochem and Photobio B:Biology,2009(95):59-67.
[10]HEO S J,KO S C,KANG S M,et al.Cytoprotective effect of fucoxanthin isolated from brown algae Sargassum siliquastrum against H2O2-induced cell damage[J].Eur Food Res Technol,2008(228):145-151.
[11]HOSOKAWA M,KUDO M,MAEDA H,et al.Fucoxanthin induces apoptosis and enhances the antiproliferative effet of the PPARg ligand,troglitazone,on colon cancer cells[J].Bioch et Biophy Acta,2004(1675):113-119.
[12]KALIVENDI S V,KONOREV S V,CUNNINGHAM S,et al.Doxorubicin activates nuclear factor of activated T-lymphocytes and Fas ligand transcription:role of mitochondrial reactive oxygen species and calcium[J].Biochem J,2005,389(2):527-539.
[13]ANAVI S,NI Z,TIROSH O,et al.Steatosis-induced proteins adducts with lipid peroxidation products and nuclear electrophilic stress in hepatocytes[J].Redox Biol,2015,4:158-168.
[14]GUPTA S,GOSWAMI P,BISWAS J,et al.6-Hydroxydopamine and lipopolysaccharides induced DNA damage in astrocytes: Involvement of nitric oxide and mitochondria[J].Mutat Res Genet Toxicol Environ Mutagen,2015,778:22-36.
[15]CIRCU M L.Reactive oxygen species,cellular redox systems,and apoptosis[J].Free Radical Biol Med,2010,48(6):749-762.
The Protective Effect of Fucoxanthin on Adriamycin-induced Cytotoxicity in Cardiac Muscle Cells
WANG Fei1,ZHAO Yu-qin1,DING Guo-fang2,et al
(1.School of Food Science and Pharmacy of Zhe Jiang Ocean University/Zhe Jiang Provincial Engineering Technology Research Center of Marine Biomedical Products,Zhoushan 316022;2.Zhejiang Marine Fisheries Research Institution,Zhoushan 316022,China)
This paper mainly explored the protective effect of fucoxanthin (FUC)on adriamycin-induced cytotoxicity in cardiac muscle cells.The DPPH method used to determinate the free radical scavenging effect of FUC and MTT assay for detecting the protective effect of FUC on adriamycin-induced cytotoxicity in H9C2 cells.AO/EB staining to observe the morphological changes of H9C2 cells,H9C2 cells in ac-tive oxygen generation level changes determined by the Carboxy-DCFDA method and Western blotting detected the expression of apoptosis protein in H9C2 cells.It showed that FUC has strong scavenging oxygen free radical ability in DPPH experiment,with IC50less than VC;FUC against ADR induced H9C2 cells toxicity effect has a good protection effect;FUC can reduce H9C2 cells apoptotic body increased which induced by ADR;FUC can inhibit the elevated levels of reactive oxygen species in the cells induced by ADR;FUC can inhibit the regulation of ADR induced cardiomyocyte apoptosis protein Caspase-8 up and Cleaved Caspase-3,Cleaved PARP down in H9C2 cells.FUC has the protective effect to cardiac cells toxicity induced by ADR,and its protective effect is possibly achieved by inhibiting ADR induced oxidative stress in cardiomyocytes by its antioxidant activity,And then inhibited the activation of Caspase-8 induced by ADR,and further inhibited the activation of Caspase-3 induced by ADR and the shear of PARP to protect cardiomyocytes.
adriamycin;cardiac cells toxicity;fucoxanthin
R966
A
1008-830X(2015)06-0582-06
2015-07-10
浙江省教育厅项目(Y201225031);浙江海洋学院校级重大项目(X12ZD09);浙江海洋学院科研启动经费资助项目(岩藻黄素对阿霉素药物心脏毒性的保护作用及机理研究)
王飞(1991-),男,硕士研究生,研究方向:海洋药物.E-mail:wishwangfei@163.com
丁国芳(1958-),教授,硕士生导师,研究方向:海洋药物.E-mail:dinggf2007@163.com

