老年急性脑梗死患者颈动脉粥样硬化新危险因素研究*
王少颖,王青青,李净兵,朱见文,徐素芝,王莉迪
(河北省老年病医院神经内科,河北 石家庄 050011)
以往研究已证实,吸烟、饮酒、高血压、高同型半胱氨酸等是老年急性脑梗死(acute cerebral infarction,ACI)患者颈动脉粥样硬化(carotid atherosclerosis,CAS)发生的独立危险因素[1]。但对这些危险因素的防治仍不足以控制CAS的发病。近年研究发现,高血糖、高脂血症及血管炎症反应共同参与了CAS的发病与发展,胆红素在此过程中可发挥抗氧化功能而抵抗CAS斑块形成。本研究旨在分析胆红素、高尿酸(Uric acid,UA)、C 反应蛋白(C-reactive protein,CRP)、纤维蛋白原(Fibrinogen,Fib)与CAS发病与发展的关系,明确ACI患者常被临床忽略的CAS高危因素,现报道如下。
1 资料与方法
1.1 一般资料:选择2011年11月至2013年7月在河北省老年病医院住院治疗的ACI患者162例。入选标准:①符合《中国脑血管病防治指南(2010年版)》中相关诊断标准[2],并经头颅CT或MRI扫描证实。②首次发病,发病时间≤3d;③临床资料完整。排除标准:①合并严重心、肝、肾疾病;②心源性脑栓塞、出血性脑梗死或合并脑出血患者;③颅内静脉窦血栓、大动脉炎等所致的脑梗死。其中男90例,女72例,年龄50~86 岁,平均(63.67±8.90)岁。根据超声检查结果将162例患者分为无斑块组70例,斑块组92例,其中稳定斑块组52例,不稳定斑块组40例。无斑块组男39 例,女 31 例,年龄 53~86 岁,平均(63.63±8.89)岁。斑块组男51例,女41例,年龄50~84岁,平均(65.96±9.45)岁。两组性别、年龄比较差异无统计学意义(P>0.05)。
1.2 检查方法
1.2.1 超声检查:162例患者均采用飞利浦IU-22彩色超声诊断仪(荷兰生产),探头频率为(L12-5)MHz。患者采用仰卧位,头偏向颈动脉检查的对侧,用枕头将肩部适当垫高,使其颈部能充分暴露,常规检查双侧颈总动脉(CCA)、颈动脉膨大至分叉(BIF)、颈内动脉(ICA)。测量颈动脉内-中膜厚度((Intima-media thickness,IMT),确定是否有斑块形成,如有斑块形成则观察斑块发生部位、厚度、长度及狭窄程度等。
1.2.2 实验室检查:入院次日抽取空腹肘静脉血10mL。取4mL检测血尿酸、血糖、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)水平。取4mL进行3000r/min离心处理10min,取上清液,采用重氮法测定总胆红素(Total bilirubin,TBIL),直接胆红素(DBIL)和间接胆红素(IBIL)浓度;采用免疫比浊法测定 CRP,仪器均为Beckman AU5800型全自动生化分析仪(美国生产)。取3mL检测血Fib,仪器为雅培CA-7000血凝仪(美国生产)。
1.3 诊断标准[3]:①斑块形成标准:彩超检查显示局部隆起,增厚,向管腔内突出,IMT≥1.2mm。②斑块类型:根据斑块稳定性质分为稳定斑块和不稳定斑块。
1.4 统计学方法:采用SPSS17.0软件包对数据行统计学分析,计量资料用均数±标准差(±s)表示,采用t或F检验;对各生化指标与IMT的关系采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结果
表1两组生化指标浓度比较(±s)
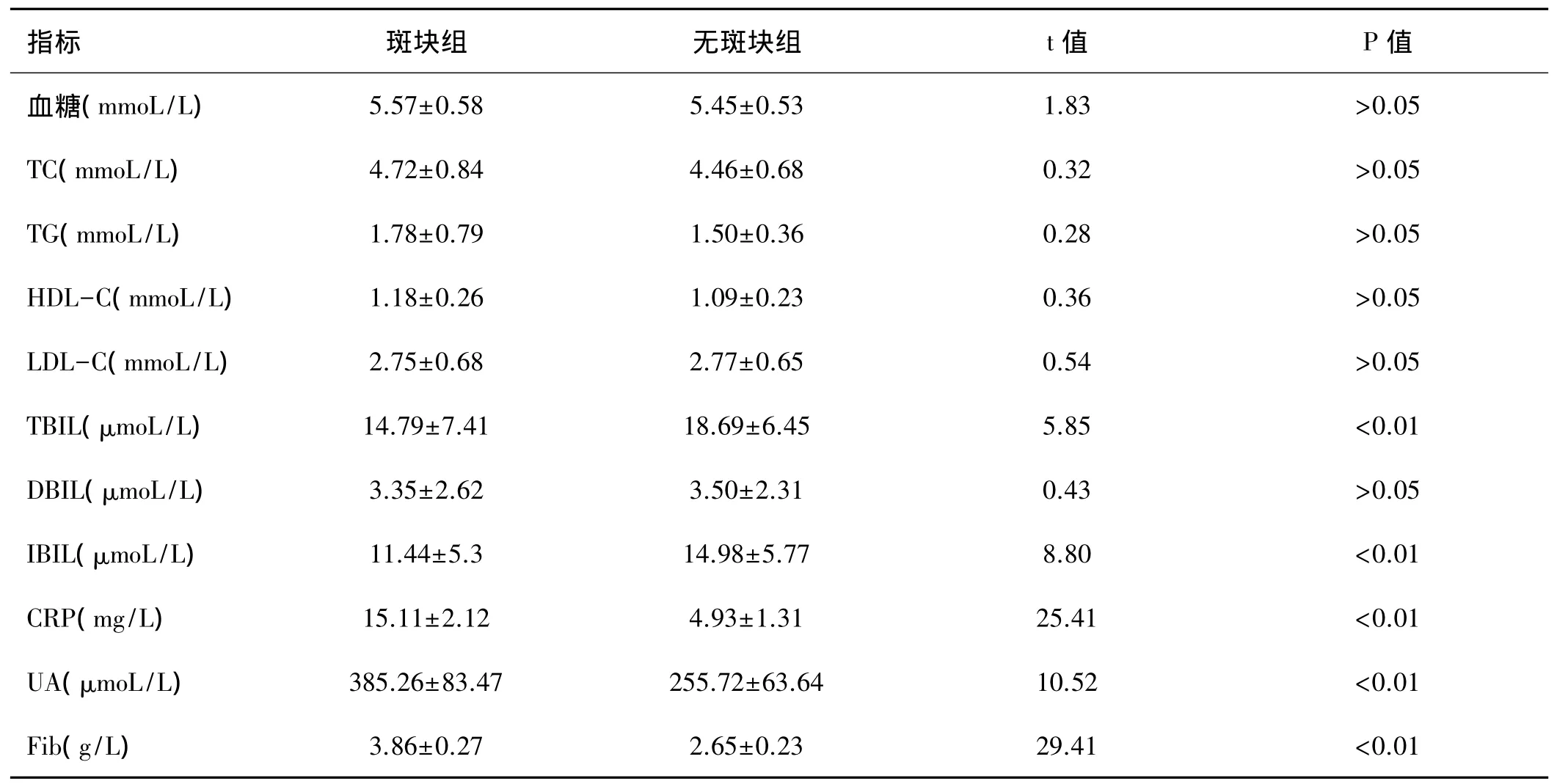
表1两组生化指标浓度比较(±s)
指标 斑块组 无斑块组 t值 P值血糖(mmoL/L) 5.57±0.58 5.45±0.53 1.83 >0.05 TC(mmoL/L) 4.72±0.84 4.46±0.68 0.32 >0.05 TG(mmoL/L) 1.78±0.79 1.50±0.36 0.28 >0.05 HDL-C(mmoL/L) 1.18±0.26 1.09±0.23 0.36 >0.05 LDL-C(mmoL/L) 2.75±0.68 2.77±0.65 0.54 >0.05 TBIL(μmoL/L) 14.79±7.41 18.69±6.45 5.85<0.01 DBIL(μmoL/L) 3.35±2.62 3.50±2.31 0.43 >0.05 IBIL(μmoL/L) 11.44±5.3 14.98±5.77 8.80<0.01 CRP(mg/L) 15.11±2.12 4.93±1.31 25.41<0.01 UA(μmoL/L) 385.26±83.47 255.72±63.64 10.52<0.01 Fib(g/L) 3.86±0.27 2.65±0.23 29.41<0.01
2.1 生化指标比较:两组血糖、血脂各项指标及DBIL浓度比较差异无统计学意义(P>0.05);斑块组TBIL、IBIL 浓度低于无斑块组(P<0.05),CRP、UA、Fib 浓度高于无斑块组(P<0.05),见表 1。
2.2 CRP、UA、Fib、TBIL、IBIL 与 IMT 的关系:无斑块组、稳定斑块组、不稳定斑块组IMT厚度逐渐增加,组间比较差异有统计学意义(P<0.05);不稳定斑块组CRP、UA、Fib浓度均高于稳定斑块组与无斑块组(P<0.05),而TBIL、IBIL浓度则低于稳定斑块组与无斑块组(P<0.05),见表 2。Spearman相关性分析显示CRP、UA、Fib 浓度与 IMT 呈正相关(r1=2.84,r2=1.45,r3=1.98,均 P<0.05),TBIL、IBIL 浓度与 IMT 呈负相关(r4=-0.74,r5=-1.02,均 P<0.05)。

表 2 CRP、UA、Fib、TBIL、IBIL 等水平与 IMT 相关性
3 讨论
颈动脉粥样硬化是老年急性脑梗死发病的基础。吸烟、饮酒、高血压、高同型半胱氨酸等对颈动脉粥样硬化发生的影响已被临床证实。近年研究发现,除了上述危险因素外,老年急性脑梗死患者仍存在其他容易被临床忽略的颈动脉粥样硬化高危因素,明确颈动脉粥样硬化发生的新高危因素对老年急性脑梗死的防治有重要意义。
颈动脉粥样硬化的发生机制复杂,但临床普遍认同内皮损伤反应学说。该学说认为动脉粥样硬化的形成是动脉内膜损伤进而引发炎症增生反应所致[4]。因此,监测颈动脉异常患者炎症指标在一定程度上可反应颈动脉粥样硬化形成情况。CRP是目前临床最敏感的急性反应时相蛋白之一。梁彩霞等[5]研究报道,进展性脑梗死患者血清CRP浓度显著升高,CRP浓度与 IMT 厚度呈正相关(r=2.06,P<0.05)。Herrera等[6]研究发现,急性脑梗死患者梗死面积及超声检出斑块数与血清CRP浓度显著相关。本研究中,斑块组血清CRP浓度显著高于无斑块组(P<0.01)。临床进一步研究发现,CRP在动脉粥样硬化损伤中的作用远远超出炎性介质的角色,它不仅可以诱导炎性因子分泌,而且可以使斑块不稳定。本研究中,不稳定斑块组血清CRP浓度显著高于稳定斑块组及无斑块组(P<0.05),Spearman相关性分析显示,CRP浓度与IMT厚度呈正相关(r=2.94,P<0.05),与梁彩霞、Herrera 等报道基本相符,提示高CRP是颈动脉粥样硬化形成的危险因素,并可导致斑块不稳定。
CRP可诱导Fib合成及释放。近年研究发现,颈动脉粥样硬化的发生于Fib异常有关。胡凡等[7]对84例急性脑梗死患者的跟踪随访发现,伴有硬化斑块的患者Fib水平明显高于未发现硬化斑块的患者(P<0.01),并且其出现早于 CRP、UA等其它炎症指标。Alves等[8]研究认为,Fib在凝血酶的作用下降解为纤维蛋白,纤维蛋白与细胞间黏附因子-1相互作用可形成“分子桥梁”结构,并且纤维蛋白在纤溶酶的作用下会降解为Bb15~42,而Bb15~42可与血管内皮钙黏附蛋白结合,引起动脉粥样硬化炎症反应。此外Fib还可与白细胞巨噬细胞、血小板结合形成白细胞血小板聚合物,此聚合物在粥样斑块的发展过程中亦起着重要作用。本研究中,Spearman相关性分析显示Fib浓度与 IMT 呈正相关(r3=1.98,P<0.05),提示高 Fib 是动脉粥样硬化形成的危险因素。
UA是机体内老化细胞、食物,尤其是动物内脏、海鲜等富含嘌呤类食物在机体内新陈代谢过程中分解产生的产物。随着我国民众生活水平的提高,高嘌呤、高蛋白饮食摄入的增加,高UA血症发病率也逐处升高。林艳等[9]对438例患者的跟踪随访发现,UA水平与动脉粥样硬化的发生紧密相关,与本研究得出结论相符,但UA如何导致动脉粥样硬化斑块形成的机制目前尚未明确,有待进一步研究。
胆红素一直被认为是无用的代谢终产物。近年研究发现,胆红素是一种有效的内源性抗氧化剂,对心血管有保护作用。Wentzel等[10]研究发现,胆红素可抑制低密度脂蛋白氧化,促进血压中氧自由基的清除,减少氧化应激反应对血管内皮的损害,进而延缓动脉粥样硬化形成。有报道,无斑块组TBIL、IBIL分别为17.8μmoL/L、6.2μmoL/L,明显高于斑块组的 15.0μmoL/L、5.0μmoL/L(P<0.05),而 DBIL 则无明显差异。本研究中,斑块组TBIL、IBIL浓度显著低于无斑块组(P<0.05),而进一步研究发现 TBIL、IBIL 浓度与 IMT呈负相关(r4= -0.74,r5= -1.02,均 P<0.05),提示低TBIL、IBIL是颈动脉粥样硬化形成的危险因素,换言之高TBIL、IBIL对颈动脉粥样硬化形成有保护作用。
[1] 张琴,黄波.急性脑梗死患者颈动脉粥样硬化斑块特征及相关危险因素分析[J].中国实用神经疾病杂志,2014,17(13):17~19.
[2] 饶明俐.中国脑血管病防治指南(2010年版)[M].北京:人民卫生出版社,2010.79.
[3] 张敏,李卫征.2型糖尿病合并脑梗死患者血清超敏C反应蛋白及同型半胱氨酸与颈动脉粥样硬化的关系[J].中国全科医学,2012,15(20):2292~2294.
[4] 王小凤.脑梗死患者血小板平均体积以及血浆纤维蛋白原水平与颈动脉粥样硬化的关系[J].中国老年学杂志,2012,32(16):3400~3401.
[5] 梁彩霞,吴雪松,岳磊.血清C反应蛋白、血浆纤维蛋白原、颈动脉粥样硬化与进展性脑梗死的临床研究[J].安徽医药,2014,18(5):914~916.
[6] Herrera VL,Decano JL,Giordano N,et al.Aortic and carotid arterial stiffness and epigenetic regulator gene expression changes precede blood pressure rise in stroke-prone dahl salt-sensitive hypertensive rats[J].PLoS One,2014,9(9):107~113.
[7] 胡凡,王卫真,冯莉莉,等.急性脑梗死患者纤维蛋白原水平与颈动脉粥样硬化的相关性研究[J].中华脑血管病杂志(电子版),2010,4(4):241~245.
[8] Alves N,Deana NF,Garay I.Detection of common carotid artery calcifications on panoramic radiographs:prevalence and reliability[J].Int Clin Exp Med,2014,7(8):1931 ~1939.
[9] 林艳,林峰.颈动脉粥样硬化斑块形成机制、危险因素与脑梗死的相关性探讨[J].神经病学与神经康复学杂志,2011,8(1):48~50.
[10] Wentzel JJ,Vernooij M,Selwaness M,et al.Atherosclerotic plaque in the left carotid artery is more vulnerable than in the right[J].Stroke,2014,16(9):123~129.

