bFGF和PDGF-B蛋白在脑缺血再灌注大鼠模型中的表达和血管形成的研究
刘伯芹 王国峰 仲 玲 赵仁亮
266002 青岛市第九人民医院神经内科(刘伯芹 王国峰 仲 玲);青岛大学附属医院神经内科[赵仁亮(通信作者)]
bFGF和PDGF-B蛋白在脑缺血再灌注大鼠模型中的表达和血管形成的研究
刘伯芹王国峰仲玲赵仁亮
266002青岛市第九人民医院神经内科(刘伯芹王国峰仲玲);青岛大学附属医院神经内科[赵仁亮(通信作者)]
脑血管病严重危害人类的健康,急性脑缺血、缺氧可诱导缺血区血管保护性增生,新生血管能够改善缺血区周围的组织灌流,增加半暗带氧气和营养物质的供应,促进缺血后神经功能的恢复[1]。碱性成纤维细胞生长因子(bFGF))和血小板源性生长因子-B(PDGF-B)在缺血性脑损伤后血管的再生和重塑过程中扮演重要角色。PDGF-B是一种分泌性蛋白,是机体内较强的促有丝分裂剂和化学诱导剂,不但与机体组织的生长发育以及各种损伤后修复有密切的关系,而且在血管新生中发挥重要生物效应如细胞增殖、趋化、迁移及成管作用等,调节血管壁形成、促进血管成熟。bFGF在体内和体外均能明显促进新生血管形成,可趋化血管内皮细胞(ECs)及平滑肌细胞,并促进其增殖和迁移,使缺血性脑损伤后血管得以再生和重塑,是主要的血管生成因子[2]。
本研究通过建立局灶性脑缺血再灌注模型,动态检测缺血再灌注不同时间窗bFGF、PDGF-B 蛋白的表达和微血管密度(MVD)的变化,以探讨缺血再灌注损伤时新生血管的形成,bFGF、PDGF-B在脑损伤中的作用及其与血管形成的关系。
1材料与方法
1.1实验动物分组SPF级SD大鼠48只,体重250~300 g,清洁级,由青岛市药物检验所实验动物中心提供。实验大鼠随机分成假手术组(6只)和MCAO/R组。缺血2 h后根据再灌注时间窗的不同分为0、6、24 h、3、7、14、21 d共7组,每组各6只大鼠。
1.2模型制作采用Zea-Longa线栓法[3]建立左侧大脑中动脉缺血再灌注模型。采用10%水合氯醛35 mg/100 g腹腔注射麻醉,颈正中切口,分离左侧颈总动脉、颈内外动脉,然后经左侧颈外-颈内动脉插线(18.5±2) mm,阻断大脑中动脉2 h后拔线,分别于再灌注0、6、24 h、3、7、14、21 d后处死大鼠。大鼠清醒后观察其行为和神经症状,以大鼠清醒后出现右前肢不能伸展、爬行时向右侧转圈并存活至规定时间点作为造模成功的标准。各组大鼠术中均用白炽灯使其肛温维持在(37±0.5) ℃,术后单笼饲养。假手术组大鼠血管分离同前,但不阻断左侧大脑中动脉。
1.3脑梗死体积的测定每组大鼠在规定时间内用4%多聚甲醛行心内灌注后断头取脑;将大脑沿冠状位横切为6片(厚2 mm),去除额极,将切好的脑片固定于同一固定液中4 h;常规脱水、透明、浸蜡和石蜡包埋。每个蜡块切取一张(片厚5 μm),行HE染色观察病理变化,并使用Simple PCI图像分析软件(美国Compix公司)计算梗死体积百分比=(非缺血侧体积-缺血侧正常脑组织体积)/非缺血侧体积×100%,非缺血侧体积或者缺血侧正常脑组织体积= (s1+s2+s3+s4+s5)×2 [s表示每片应该计算的面积,2表示每片厚度(mm)]。
1.4bFGF、PDGF-B及CD34蛋白表达水平检测对bFGF、PDGF-B蛋白表达水平的检测采用链酶亲和素-生物素-过氧化物酶复合物(Streptavidin-biotin- peroxidase complex,SABC)免疫组织化学染色法,严格按试剂盒提供的实验步骤进行操作:石蜡切片常规脱蜡至水,3% H2O2室温10 min以灭活内源性酶;微波炉加热至沸腾后断电,热修复抗原;滴加封闭液,室温20 min;滴加1∶100工作浓度的一抗,4 ℃过夜后;滴加生物素化二抗,37 ℃孵育30 min;滴加试剂SABC,37 ℃孵育30 min;DAB室温显色,镜下控制反应时间;蒸馏水洗涤中止反应;梯度酒精脱水,二甲苯透明,封片。位于胞浆或胞核内棕黄色或黄褐色颗粒为阳性表达。
CD34蛋白的表达水平检测亦采用SABC法进行检测,严格按试剂盒提供的实验步骤进行操作。位于胞浆内棕黄色颗粒为阳性表达。计数CD34抗体染色的单细胞或细胞团,有无管腔形成不限,只要与周围血管和组织有清楚的分离即认为是可计数的微血管。计数微血管密度(microvascular density,MVD)MVD参照Weidner等方法[4]进行:每张切片先在低倍镜(×100倍)下选择梗死灶周围4个血管密度最高的区域,再在高倍镜(×400倍)下计数微血管数,均值即为MVD。即用型SABC试剂盒、兔抗大鼠CD34多克隆抗体、兔抗大鼠bFGF多克隆抗体、兔抗大鼠PDGF-B多克隆抗体试剂盒均购自武汉博士德生物工程有限公司。

2结果
2.1脑梗死体积假手术组大鼠HE染色神经细胞的数量及形态分布正常,无缺血灶。MCAO/R组大鼠左侧大脑中动脉供血区包括大脑额、顶皮质、纹状体、海马等表现出不同程度的损伤改变如梗死灶中心可见明显组织稀疏,神经细胞出现脱失及细胞变形;梗死灶周围神经元、神经胶质细胞肿胀,部分细胞核固缩、浓染,出现胶质细胞浸润。MCAO/R 0h组梗死灶体积最小,随缺血再灌注时间的延长梗死灶体积逐渐增加,到第3 d达到高峰,持续至7 d左右,14 d梗死灶体积有所减小,组间有明显差异(P<0.05)(表1)。
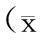
表1 各组大鼠脑组织梗死体积百分比比较±s)
注:与MCAO/R 0 h组比较,﹡P<0.05
2.2各组间MVD表达水平假手术组CD34蛋白表达不明显。MCAO/R组在梗死灶周边可见有形态不规则微血管存在,管腔由染成棕黄色的内皮细胞围成,主要分布在额顶叶皮质和纹状体(图1)。缺血再灌注6~24 h微血管分布比较稀疏,组间差异不明显(P>0.05),CD34阳性细胞在缺血再灌注3 d明显升高,7 d到达高峰,微血管在缺血灶周边区分布最为密集。MVD在缺血再灌注3、7、14 d组与缺血再灌注6 h组比较有统计学差异(P<0.05)(表2)。
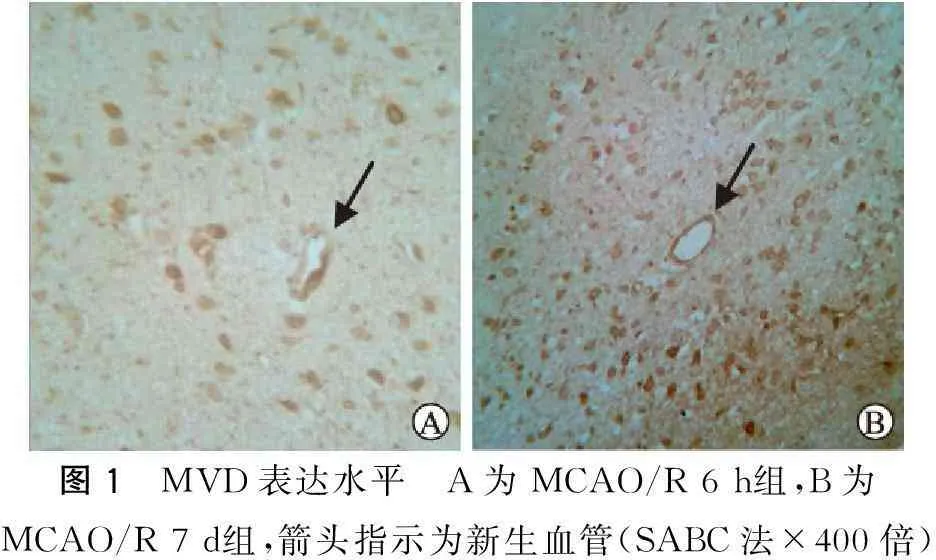
图1 MVD表达水平 A为MCAO/R6h组,B为MCAO/R7d组,箭头指示为新生血管(SABC法×400倍)
2.3各组间bFGF、PDGF-B的表达水平bFGF在假手术组有少量表达,缺血再灌注6 h后开始升高,随再灌注时间延长表达继续增加,3 d到达高峰,主要表达于梗死灶周边的神经元、胶质细胞和血管内皮细胞(图2);MCAO/R 3 d组与MCAO/R 6 h组比较,有明显差异(P<0.05),持续至7 d左右,bFGF 在再灌注14 d时开始降低,MCAO/R 21 dbFGF阳性细胞数明显减少,与MCAO/R 6 h组比较无明显差异(P>0.05)。 PDGF-B在假手术组神经元也有阳性表达,MCAO/R组PDGF-B阳性细胞数在MCAO/R 24 h后明显升高,梗死周边小胶质细胞、星形胶质细胞及神经元均可见到颗粒状特异免疫着色(图3);与假手术组比较,有明显差异(P<0.05);随再灌注时间延长表达也继续增加,3 dPDGF-B表达到高峰,7 dPDGF-B表达有所下降,但是与假手术组比较,仍有明显差异(P<0.05),14 dPDGF-B阳性细胞数又有所升高,形成第2个表达高峰,主要表达于梗死灶周围血管内皮细胞中(表2)。
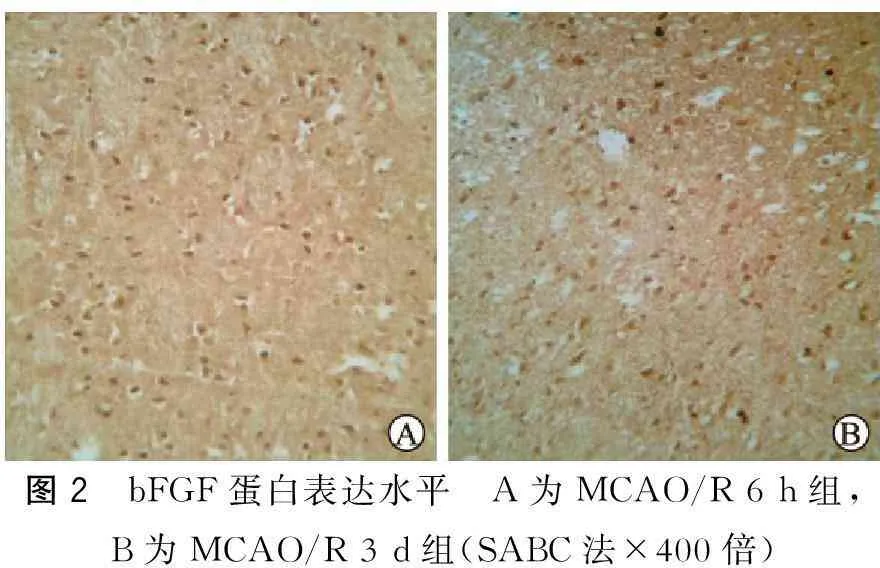
图2 bFGF蛋白表达水平 A为MCAO/R6h组,B为MCAO/R3d组(SABC法×400倍)
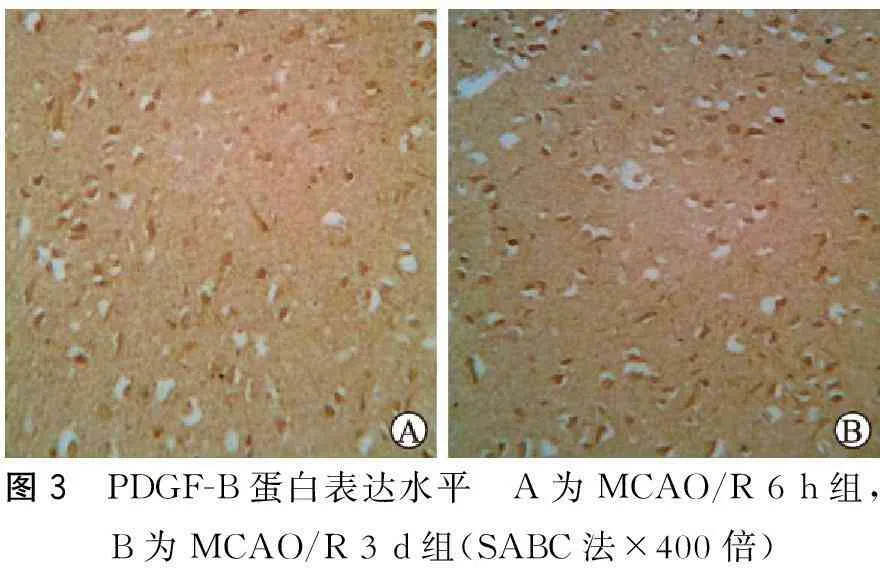
图3 PDGF-B蛋白表达水平 A为MCAO/R6h组,B为MCAO/R3d组(SABC法×400倍)
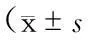
表2 各组大鼠脑梗死灶MVD、bFGF及PDGF-B蛋白
注:与假手术组比较,﹡P<0.05,与MCAO/R 6 h组比较,﹟P<0.05
2.4bFGF、PDGF-B表达水平与血管形成的相关性Pearson相关分析显示,bFGF及PDGF-B蛋白表达水平与MVD的变化呈正相关(r分别为0.642、0.706,P<0.01)(图4)。
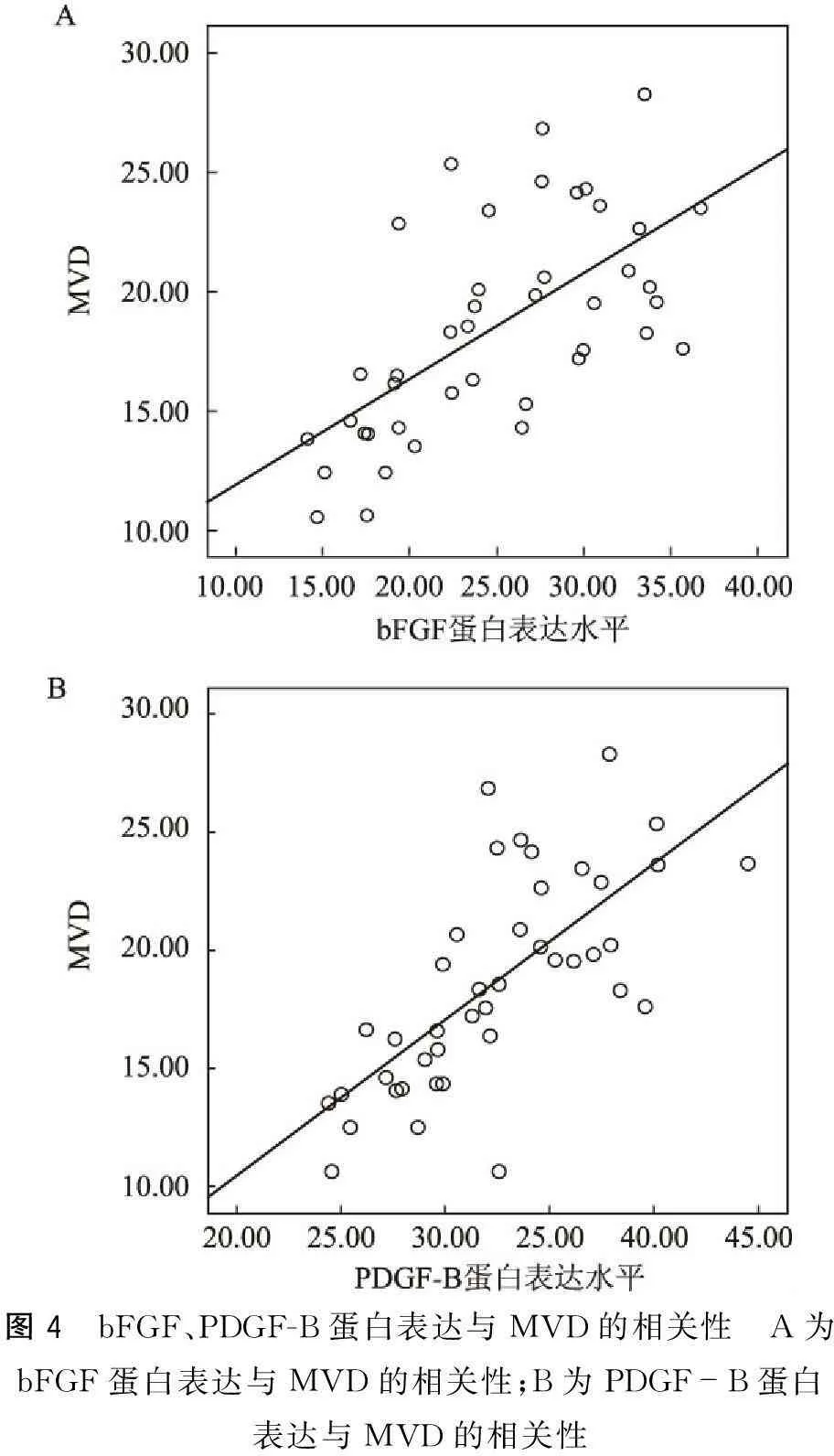
图4 bFGF、PDGF-B蛋白表达与MVD的相关性 A为bFGF蛋白表达与MVD的相关性;B为PDGF-B蛋白表达与MVD的相关性
3讨论
尽快恢复缺血区的血液供应对缺血后神经功能的恢复至关重要,缺血半暗带血流的恢复有赖于侧支循环的建立[5]。局灶性脑缺血再灌注是在局灶性脑缺血的基础上闭塞的血管再通,血流重新恢复。本实验通过缺血2 h后再灌注模型,结果显示缺血2 h后出现脑梗死灶,随再灌注时间延长梗死体积增加,到3 d梗死体积最大,表明缺血再灌注后启动损伤机制。但是缺血再灌注14 d梗死体积减小,提示随血流逐渐恢复,再灌注后期脑损伤逐渐修复。因此,缺血再灌注后血流的重新恢复对机体可能有双重作用,即早期可能加剧脑损伤,但是随着灌注时间的延长脑损伤得到修复。有研究发现,急性脑缺血后缺血半暗带微血管的密度与患者生存时间的延长有关,血管的新生对患者的恢复非常重要。缺血后血管新生是一个多因子参与调节的复杂过程,包括血管生成生长因子、血管外基质、蛋白水解酶系统以及血流的剪切力等众多因素,其中ECs的增殖、迁移和重塑是血管新生的根本途径[6]。bFGF和PDGF-B 作为血管新生调节因子,在缺血性脑损伤后血管形成过程中发挥重要作用。
bFGF是一种碱性蛋白,可以直接作用于ECs,促进其增殖和迁移,对血管形成起正调控的作用。动物模型发现,脑缺血后1 h梗死区域的神经元出现bFGF mRNA的表达,14 d内表达持续升高,梗死灶周边的神经元在缺血后1 d出现bFGF表达,ECs和胶质细胞在梗死后14 d内均不同程度地表达bFGF[7-8]。本实验发现,bFGF蛋白表达水平在缺血再灌注6 h后开始升高,随再灌注时间延长表达明显增加,3 d到达高峰,主要表达于梗死灶周边的神经元、胶质细胞和ECs,持续至7 d左右;同时发现在缺血再灌注6~24 h内微血管分布比较稀疏,新生血管形成较少,MVD在缺血再灌注早期表达不明显,MVD在缺血再灌注3 d开始明显升高,7 d到达高峰,这提示缺血再灌注损伤后bFGF蛋白表达高峰与新生血管形成的高峰并不完全一致。虽然bFGF蛋白表达早于血管的形成,但是Pearson相关分析显示,bFGF蛋白表达水平与MVD的变化呈正相关;这说明脑缺血再灌注后刺激内源性bFGF应激表达,随着bFGF持续表达增高,bFGF促进血管的新生,改善脑局部血流,从而促进受损神经组织的修复。此外,bFGF作为一种神经营养因子,促进血管新生的同时,在神经细胞的生长和发育中也起重要作用;它可以直接营养神经元,还可以通过促进神经干细胞的增殖、分化,促进缺氧、缺血脑损伤后神经系统的修复与再生[9]。因此,缺血再灌注损伤后,bFGF可能通过包括促进血管新生在内的多种途径保护神经组织,改善脑梗死大鼠预后。
PDGF-B是一种促细胞分裂剂,具有刺激ECs、成纤维细胞等特定细胞群分裂增殖的能力,在缺血性脑损伤的修复中具有重要作用[10]。有研究发现,在小鼠左侧大脑中动脉闭塞模型中双侧脑组织PDGF-B mRNA在造模后3 h~7 d内均有升高[11]。缺血性脑卒中后PDGF及其受体系统通过介导内皮细胞与周细胞的相互作用来支持血管增生以及重塑,但同时也参与血管损伤后的血管新生内膜形成,导致血管再狭窄[12]。本实验中PDGF-B蛋白在假手术组神经元也有阳性表达;在MCAO/R组PDGF-B蛋白表达在MCAO/R 24 h后明显升高,梗死灶内和梗死周边胶质细胞及神经元均可见阳性表达,随再灌注时间延长表达继续增加,3 dPDGF-B表达到高峰,7 dPDGF-B表达有所下降,14 d PDGF-B在梗死灶周围ECs中表达增多,并形成第2个高峰。PDGF-B在缺血再灌注损伤后表达变化与新生血管变化基本一致,且Pearson相关分析显示PDGF-B蛋白表达与MVD的变化呈正相关,这提示PDGF-B在缺血再灌注损伤后血管新生过程中发挥重要作用。此外,尽管在缺血再灌注3 d开始出现血管新生,但梗死体积仍为最大,主要考虑可能与早期新生血管结构、功能不全相关,由于新生血管不完整、不成熟,微血管渗漏及血脑屏障的通透性增加,一定程度上加重脑水肿,并增加出血风险;到缺血再灌注14 d随着新生血管结构和功能的成熟,梗死体积开始减轻。
综上所述,局灶性脑缺血再灌注后可刺激内源性bFGF和PDGF-B表达增加,并诱导新生血管形成,产生内源性脑保护机制,在缺血性脑损伤修复中具有重要作用。
参考文献
1Li L, Jiang Q, Zhang L, et al. Angiogenesis and Improved Cerebral Blood Flow in the Ischemic Boundary Area Detected by MRI after Administration of Sildenafil to Rats with Embolic Stroke. Brain Res, 2007,1132(1): 185-192.
2Oyamada N, Sone M, Miyashita K, et al. The role of mineralocorticoid receptor expression in brain remodeling after cerebral ischemia. Endocrinology, 2008,149(8):3764-3777.
3Longa EZ, Weinstein PR, Carlson S, et a1. Reversible midge cerebral artery occlusion without eraniectomy in rats. Stroke, 1989, 20(1):84-91.
4Weidner N. Intratumor microvessel density as a prognostic factor in cancer. Am J Pathol, 1995, 147:9-14.
5Roger VL, Go AS, Lloyd-JONES DM, et al. Executive summary: heart disease and stroke statistics-2012 update: a report from the American heart association. Circulation, 2010, 125(期):188-197.
6Emanueli C, Madedu P. Angiogenesis gene therapy to rescue ischemia tissues: achievements and future directions. Br J Pharmacol, 2001,133:951-958.
7Lin TN, Te J, Lee M, et al. Induction of basic fibroblast growth factor (bFGF) expression following focal cerebral ischemia. Brain Res Mol Brain Res,1997, 49:255-265.
8Chen HH, Chien CH, Liu HM. Correlation between angiogenesis and fibroblast growth factor expression in experimental brain infarct. Stroke, 1994,25:1651-1657.
9Wang ZL, Cheng SM, Ma MM, et al. Intranasally delivered bFGF enhances neurogenesis in adult rats following cerebral ischemia. Neurosci Lett , 2008, 446:30-35.
10Zhang J, Cao R, Zhang Y, et al. Differential roles of PDGFR-alpha and PDGFR-beta in angiogenesis and vessel stability. FASEB J, 2009,23(1):153-163.
11Renner O, Tsimpas A, Kostin S, et al. Time-and cell type specific in duction of platelet-derived growth factor receptor-beta during cerebral ischemia. Brain Res Mol Brain Res, 2003,113:44-51.
12Mantur M, Koper O. Platelet- derived growth factor-the construction, role and it's receptors. Pol Merkur Lekarski,2008,24(140):173-176.
(2014-12-24收稿)
【摘要】目的探讨脑缺血再灌注大鼠不同时间碱性成纤维细胞生长因子(bFGF)和血小板源性生长因子-B(PDGF-B)的表达水平及其与血管形成的关系。方法采用线栓法制备大鼠大脑中动脉局灶性脑缺血再灌注(MCAO/R)模型,分为假手术组和MCAO/R组,MCAO/R组缺血2 h后根据再灌注时间窗的不同分为0、6、24 h、3、7、14、21 d共7组,应用HE染色观察病理变化并测定脑梗死体积,用免疫组化法检测CD34蛋白的表达水平并计数微血管密度(MVD),用免疫组化法检测bFGF和PDGF-B蛋白的表达水平。结果bFGF蛋白表达水平在MCAO/R 6 h后即开始升高,3 d到达高峰,7 d开始降低。PDGF-B蛋白表达水平在MCAO/R 24 h后明显升高,3 d到达高峰,7 d有所下降,持续到14 d左右。MVD表达在MCAO/R 3 d开始升高,7 d到达高峰。bFGF和PDGF-B蛋白表达水平与MVD变化呈正相关(P<0.01)。结论局灶性脑缺血再灌注损伤可诱导bFGF、PDGF-B和新生血管表达增加,激活内源性脑保护机制。
【关键词】碱性成纤维细胞生长因子血小板源性生长因子-B血管形成脑缺血
【DOI】10.3969/j.issn.1007-0478.2015.04.002
The expression of basic fibroblast growth factor,platelet-derived growth factor B chain and its effects on angiogenesis in rats following cerebral ischemia/reperfusionLiuBoqin,WangGuofeng,ZhongLing,etal.DepartmentofNeurology,QingdaoNinthPeople'sHospital,Qingdao266002
【Abstract】ObjectiveTo investigate the effects of angiogenesis and the expression changes of basic fibroblast growth factor (bFGF) and platelet-derived growth factor B chain(PDGF-B ) in rats following focal cerebral ischemia/reperfusion.MethodsA model of the middle cerebral artery occlusion 2h / reperfusion (MCAO/R) in rats was performed with the intraluminal filament occlusion. Rats were divided into sham operation group and MCAO/R group. Two hours after ischemia the MCAO/R group was divided into 7 subgroups according to reperfusion time difference, including 0, 6, 24 h, 3, 7, 14, 21 d. Brain sections were stained with hematoxylin and eosin (HE) for surveying the volume of infraction. The expression of microvascular density(MVD)was determined by immunohistochemical staining. The expression of bFGF and PDGF-B protein were determined by mmunohistochemical staining.ResultsThe expressions of bFGF began to increase at 6 h after ischemia/reperfusion. It reached climax at 3 d and reduced after 7 d. The expressions of PDGF-B were significantly increased at 24 h after ischemia/reperfusion, with the first peak at 3 d and the second peak was at 14 d. The expressions of MVD began to increase at 3 d after ischemia/reperfusion and continue to 14 d. There was a significant positive correlation between expression of bFGF, PDGF-B and change of MVD(P<0.05).ConclusionsIschemia and reperfusion injury can induce expression of bFGF, PDGF-B and angiogenesis, which might play an important role in the internal protection of neurons.
【Key words】Basic fibroblast growth factorPlatelet-derived growth factor B chainAngiogenesisCerebral ischemia
【中图分类号】R743
【文献标识码】A
【文章编号】1007-0478(2015)04-0198-05

