大鼠股骨骨折后肾髓质浅层细胞的凋亡及三七总皂苷的保护作用
姚 懿,陈丑彦,唐发兵,孙少华
(1.兰州大学第一医院病理研究所,甘肃兰州 73000;2.定西市人民医院普外科,甘肃定西 734000)
近年来,随着道路交通事故及各种机械伤、坠落伤等高能量损伤发生率的不断上升,骨折病例明显增多。由于下肢起着全身的负重支撑作用,所以在受外界暴力作用时有很大几率出现下肢骨折。骨折后机体由于应激反应,会出现一系列相应的病理生理学改变。肾脏作为兼有代谢和内分泌功能的全身重要脏器,是损伤后各种影响相互作用的一个靶器官。有研究结果表明,三七总皂苷(panax notoginseng saponins,PNS)通过升高Bcl-2/Bax比值、抑制Bax的过度表达,可发挥抑制细胞过度凋亡的作用[1]。本实验采用股骨闭合骨折的动物模型,通过分析凋亡调控基因Bcl-2和Bax的变化,并结合观察TUNEL染色细胞凋亡情况,探讨PNS对肾脏髓质浅层损伤的影响和保护性作用。
1 材料与方法
1.1 实验动物 实验选用清洁级健康 Wistar大鼠102只,雄性,平均体质量(200±10)g,由兰州大学动物实验中心提供。
1.2 实验仪器及试剂 显微镜及显微照相系统为Olympus BX51及DP71型;电子天平由上海天平仪器厂生产制造;20~200μL及0~10μL微量加样器由Labsystem公司生产。注射用PNS(云南植物药业有限公司);Bcl-2、Bax原位杂交检测试剂盒,Bcl-2、Bax免疫组化检测试剂盒,TUNEL细胞凋亡试剂盒,即用型SABC免疫组化染色试剂盒,均购自武汉博士德生物工程有限公司;DAB显色试剂盒由福州迈新生物技术开发有限公司生产。
1.3 方法
1.3.1 股骨干闭合骨折模型的建立 用40mg/L水合氯醛(8mg/kg)对实验大鼠进行腹腔麻醉,麻醉起效后将大鼠仰卧位放置,选取一侧后肢,用电钻将克氏针(直径1mm)钻入骨髓腔,外展内旋位固定大鼠下肢于造模支架的铁砧凹槽上(间距15mm),以截骨刀下缘置于该大腿股骨干中1/3,取砝码(700g)至约10cm高处,让其以自由落体方式打击钝骨刀进而撞击股骨干中1/3造成骨折。股骨干骨折移位程度可以通过观察撞击后克氏针变形角度来掌握。
1.3.2 实验分组 将实验大鼠随机分为单纯骨折组(36只)、骨折治疗组(36只)、正常对照组(30只)。前两组在实施骨折造模后于1、6、12、24、36、48h各处死6只,正常对照组分别在1、6、12、24、36、48h处死5只。治疗组于骨折后立即给予PNS 70mg/kg[3]腹腔注射一次,单纯骨折组给予腹腔注射同等剂量的生理盐水一次,对照组不做任何处理。所有实验大鼠均以颈椎脱臼处死。
1.3.3 组织标本的制备、检测及图像处理 实验大鼠处死后,即刻解剖动物,提取肾脏,用中性甲醛及40g/L多聚甲醛固定,石蜡包埋,常规切片(厚4μm),进行 HE染色、免疫组化及原位杂交、TUNEL染色,观察骨折后肾髓质浅层组织形态和细胞凋亡变化及各项指标的表达情况。根据KRAAN等[4]标准,使用配备有Olympus光学显微镜的DP71图像采集器采集图片后,用Image Pro-plus 6.0图像分析软件分别对免疫组化及原位杂交染色切片所采集的图像进行阳性面积、IA值及吸光度进行测量。
1.4 统计学分析 以均数±标准差表示所有采集到的计量数据,统计学分析采用SPSS 20.0统计软件进行,多组间的比较采用方差分析,检验水准取0.05。
2 结 果
2.1 各组大鼠肾脏髓质浅层的组织病理学变化 把肾髓质冠状切面根据肾脏损伤情况及解剖结构自外向内分为:髓质浅层和髓质深层。本研究室仅对髓质浅层进行研究。在单纯骨折组中可见肾小管上皮细胞轻度颗粒变性情况出现在髓质浅层;远曲小管的上皮细胞形态无异常(图1A);间质小血管可见轻度扩张出血。在骨折治疗组中,近曲小管颗粒变性减轻,远曲小管结构正常,而这些变化随着时间改变而减轻的趋势明显(图1B)。
2.2 各组大鼠肾髓质浅层TUNEL染色结果 单纯骨折组中,肾髓质浅层凋亡细胞在石蜡切片中可清楚地显示其呈散在分布,凋亡细胞核呈棕黄色,胞质一般不着色或淡着色 (图2A);骨折治疗组肾髓质浅层可见凋亡细胞数量少于单纯骨折组,呈零星分布,凋亡细胞核呈棕黄色(图2B)。

图1 大鼠骨折后6h肾脏髓质组织的HE染色Fig.1 Pathological changes of the rat kidney at 6hafter fracture(HE,×400)A:单纯骨折组;B:骨折治疗组。图2 大鼠骨折后6h肾脏髓质组织TUNEL染色Fig.2 TUNEL staining of the rat kidney at 6hafter fracture(TUNEL,×200)A:单纯骨折组;B:骨折治疗组。
2.3 骨折后肾髓质浅层组织Bcl-2、Bax的表达Bcl-2免疫组化阳性表达见于胞质。单纯骨折组Bcl-2表达在1~36h的各时间段均高于正常对照组(P<0.001,P36h=0.010),至48h其阳性表达接近于正常范围;骨折治疗组的Bcl-2阳性表达在1~48h各时段均较正常对照组高(P<0.001,表1)。
Bax免疫组化阳性表达见于胞质。单纯骨折组Bax阳性表达在1~12h的各时段均低于正常对照组(P<0.001);在12h后阳性表达已呈现升高的走向,24、36、48h各时段阳性表达均较正常对照组高(P<0.001);骨折治疗组在1~48h各时段Bax阳性表达均较正常对照组低 (P<0.001,P1h=0.005)。Bax在骨折后1h时阳性表达较单纯骨折组高(P<0.001),而在12~48h的表达明显较单纯骨折组低(P<0.001,表1)。
表1 骨折后肾髓浅层组织Bcl-2、Bax蛋白的表达Tab.1 The IOD value of Bcl-2and Bax immunohistochemical expressions in the rat kidney medulla after fracture(±s)
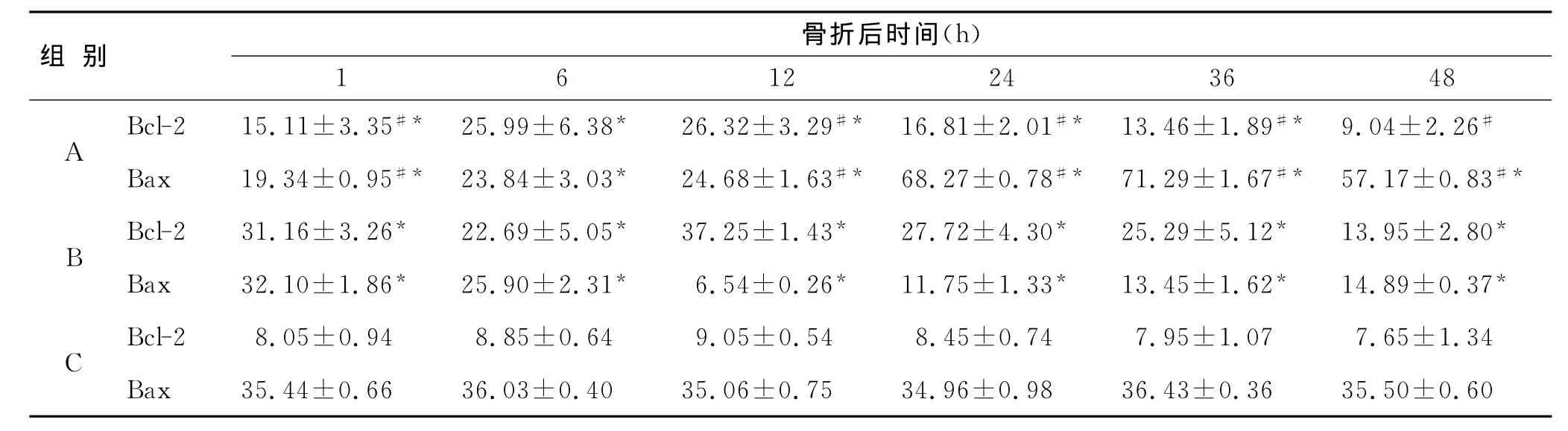
表1 骨折后肾髓浅层组织Bcl-2、Bax蛋白的表达Tab.1 The IOD value of Bcl-2and Bax immunohistochemical expressions in the rat kidney medulla after fracture(±s)
A:单纯骨折组;B:骨折治疗组;C:正常对照组;与正常对照组相比,*P<0.05;与治疗组相比,#P<0.05。
组 别 骨折后时间(h)1 6 12 24 36 48 A Bcl-2 15.11±3.35#* 25.99±6.38* 26.32±3.29#* 16.81±2.01#* 13.46±1.89#* 9.04±2.26#Bax 19.34±0.95#* 23.84±3.03* 24.68±1.63#* 68.27±0.78#* 71.29±1.67#* 57.17±0.83#*B Bcl-2 31.16±3.26* 22.69±5.05* 37.25±1.43* 27.72±4.30* 25.29±5.12* 13.95±2.80*Bax 32.10±1.86* 25.90±2.31* 6.54±0.26* 11.75±1.33* 13.45±1.62* 14.89±0.37*C Bcl-2 8.05±0.94 8.85±0.64 9.05±0.54 8.45±0.74 7.95±1.07 7.65±1.34 Bax 35.44±0.66 36.03±0.40 35.06±0.75 34.96±0.98 36.43±0.36 35.50±0.60
2.4 骨折后肾髓质浅层组织Bcl-2、Bax mRNA的表达 单纯骨折组Bcl-2mRNA表达在1~48h各时间段较正常对照组均显著升高(P<0.001),各时间段的表达整体呈下降趋势。骨折治疗组在1~48h各时段Bcl-2mRNA表达均较正常对照组明显升高(P<0.001)。Bcl-2mRNA表达在1h及6h低于单纯骨折组(P1h=0.009、P6h=0.000),而阳性表达在12~36h各时间段均较单纯骨折组高(P<0.001,其中P12h=0.007、P24h=0.004),阳性表达发展至48h低于单纯骨折组(P=0.030,表2)。
单纯骨折组,Bax mRNA表达在6h低于正常对照组(P=0.012),而在其余各时间段Bax mRNA表达均较正常对照组明显升高(P<0.001)。骨折治疗组在1~12h各时段Bax mRNA的表达均较正常对照组高(P<0.001),该时间段后mRNA表达呈下降趋势,在24h和36h已基本接近于正常对照组,阳性表达在48h时明显较正常对照组低(P<0.001)。Bax mRNA表达在1~12h各时段均较单纯骨折组高,其中在骨折后1h及6h数据组间比较有统计学差异(P<0.001),阳性表达在24~48h各时段均较单纯骨折组显著降低(P<0.001,表2)。
表2 骨折后肾髓质浅层组织Bcl-2mRNA及Bax mRNA的表达Tab.2 The IA value of Bcl-2mRNA and Bax mRNA expressions in the rat kidney medulla after fracture(IA value,±s)

表2 骨折后肾髓质浅层组织Bcl-2mRNA及Bax mRNA的表达Tab.2 The IA value of Bcl-2mRNA and Bax mRNA expressions in the rat kidney medulla after fracture(IA value,±s)
A:单纯骨折组;B:骨折治疗组;C:正常对照组。与正常对照组相比,*P<0.05;与治疗组相比,#P<0.05。
组别骨折后时间(h)1 6 12 24 36 48 A Bcl-2 60.57±2.15#* 56.18±1.69#* 42.99±2.18#* 37.64±3.28#* 36.78±2.59#* 33.04±1.54#*Bax 31.64±1.08#* 21.22±1.13#* 38.57±1.61* 68.18±1.94#* 44.94±1.71#* 42.58±1.55#*B Bcl-2 57.48±1.46* 45.86±3.15* 48.38±3.53* 42.05±2.45* 50.25±2.05* 30.33±2.13*Bax 52.66±2.20* 31.04±1.91* 41.35±1.81* 26.99±1.14 26.99±1.14 14.69±1.62*C Bcl-2 18.22±0.67 18.92±0.55 19.01±0.42 17.82±0.84 17.53±0.97 19.20±0.41 Bax 24.82±2.50 25.63±2.10 23.52±3.10 25.07±2.05 24.98±2.40 26.67±1.90
3 讨 论
骨折的诊疗、康复以及手术方式和内外固定的选择是目前对骨折的研究重点,而对骨折造成的重要器官并发症的研究不多,特别是对在骨折创伤中出现的肾脏细胞凋亡现象的研究在国内外鲜有报道。本文即对骨折所导致的肾损伤的原因、机制及PNS的保护作用作了探讨。
3.1 骨折所诱发的肾脏髓质细胞凋亡的机制 下列因素可能是骨折后所产生的肾脏细胞凋亡现象的原因:首先,机体的代偿机制在骨折后开始反应,大量的钙、磷会从血液进入尿液被排出体外,细胞内Ca2+浓度的增加可激活Ca2+/Mg2+依赖的核酸内切酶、核转录因子、谷氨酰胺转氨酶等,这些酶及核转录因子均可诱发细胞凋亡。其次,骨折所造成的创伤应激反应是诱发细胞凋亡的一个关键因素。这些影响直接或间接导致了一系列的组织和器官的损害。此外,因为骨折后伴随着髓腔内骨髓及脂肪组织的严重损伤,小脂肪滴可通过破裂的血管进入循环系统从而造成脂肪栓塞。同时,大量失血导致组织器官不能得到有效灌注,可以使组织细胞产生脂肪酶。脂肪栓子中的脂肪被脂肪酶分解成成甘油和游离脂肪酸等物质。有研究表明,游离脂肪酸可产生诱导多种细胞凋亡的作用[5-7],包括胰岛β细胞、血管内皮细胞、卵巢颗粒细胞[8]和睾丸间质细胞[9]。与骨折同时发生的还有局部软组织由于出血、肿胀,受损会释放出大量酸性代谢产物、血管活性物质和组织毒素等物质,这些代谢产生的毒性产物会进一步造成重要脏器和组织的损伤。
3.2 骨折后肾脏细胞凋亡调控基因Bcl-2及Bax表达的变化 骨折在大多数时候不会引起肾脏组织直接损伤,骨折后肾脏的损伤主要是在神经和体液素因素、创伤应激反应、局部组织损伤等原因引起的有害物质及代谢产物入血后进入肾脏等因素的影响下引起,因此它并不表现有显著局部分布特性。健康成年人在安静状态下,每分钟流过两肾的血量约相当于心输出量的1/4左右,而肾脏仅占体重约0.5%,可见肾脏是机体供血量最丰富的器官,所以当骨折伴有大量失血时,肾脏组织缺血失氧的表现会尤为突出。由于血容量减少和血流量速度减缓,一些体内的新陈代谢的产物不能被及时排出,这些代谢物可以诱发细胞凋亡的发生[5-7]。骨折创伤后,细胞凋亡程序会被机体立即启动,它保证了机体的正常代谢功能和维持肾功能得以正常进行。
在细胞凋亡过程中,Bcl-2基因起着至关重要的抑制细胞凋亡作用。有研究表明,大鼠大脑在受到创伤后出现Bcl-2的表达明显升高,反映出机体损伤后出现过度凋亡[10]。本实验结果表明,肾组织中抑凋亡因子Bcl-2蛋白表达及mRNA的转录在骨折后均会出现明显上调。Bcl-2mRNA的转录在肢体骨折后一开始即较正常对照组显著升高,但在整个过程中呈整体下降的趋势;而蛋白的表达在开始呈上升趋势,在12h后则呈下降趋势,48h后恢复到正常水平。这说明在骨折创伤后机体的抑制细胞凋亡机制即已经启动,从实验过程可以看出抑制作用在骨折后12h最为显著。由此可以得知,骨折后前12h肾髓质浅层细胞凋亡处于高峰期,12h后随着机体调节和代偿功能的跟进,肾髓质浅层细胞凋亡情况逐渐减缓。
Bax是最重要的促凋亡基因之一,广泛分布于人体组织和细胞中,而且Bax也是调节Bcl-2活性的主要因子[11]。本研究结果显示,骨折后Bax蛋白表达的上调以12h后最为显著。肾脏组织中Bax蛋白表达和mRNA转录在骨折创伤后的各个时间段中无区域性差异。表明在骨折后12h内机体主要反应是保护肾脏组织免受损伤,而在12h后,机体为了清除肾髓质浅层骨折损伤后产生的代谢产物,在骨折12h之后,Bax蛋白的表达呈逐渐升高的趋势。由此可见,骨折创伤对肾髓质浅层Bax表达有明显影响。
通过以上Bcl-2和Bax蛋白各自表达的规律,说明Bcl-2/Bax比值在骨折后肾皮质深层细胞凋亡的调控过程中始终处于一个相对的动态平衡之中,这对于预防细胞凋亡和清除受损与衰老细胞发挥着主要作用[11]。总之,骨折对肾髓质浅层Bcl-2和Bax的表达有明显影响。
3.3 PNS对肾脏髓质组织损伤的保护作用 由于坏死组织及代谢产物等入血滞留于肾脏而导致的肾损伤是骨折对机体肾脏影响的主要原因,故及时有效地清除在肾脏和血液中蓄积的代谢性产物及有害物质对维持机体和肾脏正常的生理功能具有十分重要的意义。中药三七的活性成分主要为PNS。相关研究表明,三七总皂苷具有扩张血管,改善血液循环以及活血化瘀的效果可以有效改善骨折时大量出血引起的肾脏血流量减少及对机体的创伤刺激。WYLLIE等[12]的研究表明,Bcl-2和Bax的相关蛋白可形成异源二聚体,Bax之间可形成同源二聚体,异源二聚体抑制凋亡,Bax同源二聚体则促进凋亡,因此认为Bcl-2与Bax比率可调节细胞的凋亡,调高Bax/Bcl-2促进凋亡,降低Bax/Bcl-2则抑制凋亡。在本实验中,Bax的表达在骨折后6h内可以看到骨折治疗组明显较单纯骨折组高,而Bax表达在6h以后则呈明显降低趋势。Bax mRNA转录的变化趋势与蛋白表达基本上相一致,仅有骨折治疗组Bax mRNA较长时间地持续高表达,在12h内的表达显著高于单纯骨折组。骨折治疗组肾脏组织Bcl-2蛋白的表达在创伤后1h即已显著升高,并在36h内持续处于较高的水平,直至48h时才逐渐出现降低,但依然较正常水平显著增高。骨折治疗组Bcl-2mRNA的转录在创伤后的1h亦呈显著升高,其转录表达量随着时间的推移逐渐下降。由此可以看出,三七总皂苷有将抑凋亡因子Bcl-2的表达及mRNA转录显著上调的作用,同时起着显著下调促凋亡因子Bax的表达及mRNA转录的作用。研究结果进一步表明,三七总皂苷对骨折后肾脏组织中抑凋亡因子Bcl-2蛋白的表达及mRNA转录在1~6h发挥下调作用,而在12~36h发挥上调作用,此作用在各时间段均无显著的组织结构区域性差别。
如上所述,三七总皂苷通过上调Bcl-2的表达,下调Bax过度的表达,有效调节Bcl-2/Bax比值,抑制过度凋亡,使肾髓质浅层细胞凋亡处于符合生理需求的状态,发挥保护肾脏损伤的作用[13],同时又有利于骨折的愈合。所以,三七总皂苷对肾脏的保护作用非常明显,尤其是对骨折后肾脏功能恢复具有重要意义。
[1]孙晓芳,段斐,牛建昭,等.三七总皂苷对肺纤维化小鼠细胞凋亡及Bax/Bcl-2表达的影响[J].重庆医学,2013,42(10):1125-1127.
[2]陈一心,王俊,郑欣.大鼠股骨干闭合性骨折模型的研制[J].创伤外科杂志,2008,10(6):558.
[3]寇晨程,陈丑彦,孙少华,等.大鼠肾损伤早期三七总皂苷对肾皮质小管细胞Bax的影响[J].中华创伤杂志,2014,30(2):185-188.
[4]KRAAN MC,SMITH MD,WEEDON H,et al.Measurement of cytokine and adhesion molecule expression in synovial tissue by digital image analysis[J].Ann Rheum Dis,2001,60(3):296-8
[5]AHMED K,WEI ZL,ZHAO QL,et al.Role of fatty acid chain length on the induction of apoptosis by newly synthesized catechin derivatives[J]. Chemico-Biological Interactions,2010,185(3):182-188.
[6]张清兰,李威,刘冰,等.脂肪酸与细胞凋亡的研究进展[J].东北农业大学学报,2006,37(4):539-545.
[7]傅静奕,李焱,严励,等.甘精胰岛素对游离脂肪酸诱导的RIN-m细胞凋亡的影响[J].中山大学学报:医学科学版,2005,26(4):413-416.
[8]MU YM,YANASE T,NISHI Y,et al.Saturated FFAs,palmitic acid and stearic acid,induce apoptosis in human granulosa cells[J].Endocrinology,2001,142(8):3590-3597.
[9]LU ZH,MU YM,WANG BA,et al.,Saturated free fatty acids,palmitic acid and stearic acid,induce apoptosis by stimulation of ceramide generation in rat testicular Leydig cell[J].Biochem Biophys Res Commun,2003,303(4):1002-1007.
[10]骆纯,朱诚,江基尧,等.大鼠脑创伤后bcl-xL和baxmRNA的表达改变[J].中华创伤杂志,2001,17(4):209-211.
[11]杨连君,曹雪涛,于益芝.bcl-2,bax与肿瘤细胞的凋亡[J].中国肿瘤生物治疗杂志,2003,10(3):232-234.
[12]WYLLIE AH.Death gets a brake[J].Nature,1994,369:272-273.
[13]高安敏,曾峰,孙少华,等.大鼠股骨骨折对肾皮质浅层细胞凋亡的影响及三七总皂苷的保护作用[J].南方医科大学学报,2013,33(11):1692-1695.

