人脑胶质瘤中RSUME的SUMO化与HIF-1α/VEGF通路的相关性
范阳华,叶敏华,吴 雷,何 伟,廖长春,汲乾坤,祝新根
(南昌大学第二附属医院神经外科,江西南昌 330006)
脑胶质瘤是中枢神经系统最常见的原发性肿瘤,具有无控性增殖、侵袭性生长、易复发的特点[1-2]。其本质上是一种多基因异常疾病,由于原癌基因的过表达,同时伴随抑癌基因的突变缺失,从而使肿瘤细胞逃避了正常生长的调控机制。传统治疗方法(包括手术、化疗和放疗)并没有完全解决胶质瘤侵袭性生长所导致的高复发率和低治愈率的难题。针对与胶质瘤发生、发展相关的基因异常的治疗已成为研究热点[3]。
真核细胞中存在一种小的泛素样小分子修饰因子(small ubiquitin-like modifier,SUMO)-1,其对蛋白质的修饰作用是调节细胞中蛋白质与蛋白质的相互作用和转录活性、增强底物的稳定性或影响靶蛋白亚细胞定位[4-6]。基因芯片研究结果显示,缺氧培养的细胞中SUMO-1mRNA的表达表现为时间依赖性的增加。缺氧应激研究发现,许多SUMO-1的底物与转录或者翻译后的调节相关,并可能通过与泛素或者其它修饰因子竞争HIF-1α上依赖于氧气降解结构域上的赖氨酸残基,阻断蛋白质的泛素化-蛋白酶体降解途径或者其他途径,增加HIF-1α的稳定性及其转录活性[7],提示SUMO-1在缺氧应答中扮演重要角色[8-9]。
研究发现,RSUME可通过SUMO化促进肿瘤血管新生[10-11]。RSUME是一种新发现的可促进蛋白SUMO化作用的基因片段[12],但胶质瘤中缺氧应激促进SUMO化及其引起HIF-1α/VEGF通路的调节过程及机制尚不明确。本研究通过检测不同级别胶质瘤组织和正常脑组织中RSUME及其SUMO化的表达水平与HIF-1α/VEGF信号通路的关系,为深入研究胶质瘤的分子病理机制及临床治疗提供线索。
1 材料与方法
1.1 标本来源及临床资料 收集南昌大学第二附属医院神经外科自2010年1月至2013年1月手术切除并经病理检测证实的脑胶质瘤标本63例,其中男性41例,女性22例,年龄23~69岁,平均49.6岁。并按照世界卫生组织(2007年)神经系统肿瘤分类标准对以上肿瘤组织进行分级:28例低级别脑胶质瘤包括9例低级别星形细胞瘤(WHOⅠ~Ⅱ级)和19例少突胶质细胞瘤(WHOⅡ级);35例高级别胶质瘤包括13例间变性星形细胞瘤(WHOⅢ级)和22例胶质母细胞瘤(WHOⅣ级)。正常对照组为颅脑外伤手术切除的正常脑组织(9例),所有患者术前均未经放化疗。本研究获得所有患者的知情同意,并经本院医学伦理委员审核通过,术中标本在手术显微镜辅助下用取瘤钳取出。
1.2 标本采集 切取肿瘤组织时避开囊变、坏死部位,所有标本在离体10min内取材,一份装入含RNA保存液的无酶Eppendorf(EP)管中,并立即置于液氮中备用RT-PCR检测,另一份40g/L的多聚甲醛固定48~72h,自来水充分冲洗后梯度乙醇脱水,二甲苯透明,浸蜡包埋,4μm连续切片备用免疫组化染色。
1.3 方法
1.3.1 免疫组织化学SP法染色 兔抗人SUMO-1(C0372)购于美国 ANBO 公司,兔抗人 HIF-1α(BA0912-2)、兔抗人 VEGF(BA0407)、SP染色试剂盒均购自武汉博士德公司。30mL/L H2O2阻断过氧化物酶活性,PBS冲洗3次,100mL/L胎牛血清孵育20min,分别加入SUMO-1(C0372,Anbo Biotechnology Company)、HIF-1α抗体(3716,cell signaling technology)4℃过夜孵化,PBS再次冲洗3次;加入生物素酰化二抗,孵育2h,PBS冲洗3次;加入辣根过氧化物酶标记生物素孵育2h,DAB显色,磷酸盐缓冲液(PBS)代替一抗为阴性对照,以已知阳性片(公司提供)作为阳性对照。

1.3.2 RT-PCR检测 取组织100mg组织在液氮中磨碎成粉末状,每100mg的组织加总RNA抽提试剂Trizol(购置于TransGen Biotech)1mL,并按步骤加入氯仿、异丙醇、无水乙醇提取总RNA。用紫外分光光度计测定核酸吸光度A260和A280值,测定组织总RNA浓度和纯度。按逆转录试剂盒(购置于日本,TaKaRa公司 )合成cDNA,逆转录条件:37℃反应15min,85℃反应5s。配置扩增体系:RSUME、HIF-1α、VEGF、内参上游、下游引物(引物序列见表1)各1μL,10μL 2×Taq PCR MasterMix(TransGen Biotech),扩增反应条件:94℃预变性5min,94℃变性30s,58.8℃退火30s,72℃延伸30s,扩增35个循环;最后72℃延伸8min;PCR扩增产物取5μL,经15g/L琼脂糖凝胶电泳;凝胶成像分析系统进行拍照,荧光灰度分析。用Image-Pro Plus(IPP)软件平均积分吸光度值(IA)分析,以内参强度值标化RSUME、HIF-1α及VEGF,得到各条带与相应GAPDH条带的强度比值为最后表达值,各组结果以±s表示。

表1 RSUME、HIF-1α、VEGF、GAPDH、PCR引物序列Tab.1 The PCR primer sequence of RSUME,HIF-1α,VEGF and GAPDH
1.3.3 随访 随访全部患者,无失访,随访时间:18~45个月,记录患者无进展生存期(progress free survival,PFS)。
1.4 统计学分析 所有数据采用SPSS 20.0统计软件进行处理,多组均数比较方差齐则采用方差分析(F值),方差不齐则采用非参数检验(H 值),其两两比较采用LSD法;SUMO-1、HIF-1α、VEGF在正常脑组织、低级别胶质瘤、高级别胶质瘤中的表达采用非参数检验(H 值);SUMO-1、HIF-1α、VEGF 蛋白表达相关性采用Spearman等级相关分析,生存分析单因素采用Kaplan-Meier计算、Log-rank检验。P<0.05为差异有统计学意义。
2 结 果
2.1 RSUME、HIF-1α、VEGF mRNA PCR扩增产物琼脂糖凝胶电泳结果 35例高级别胶质瘤组织、28例低级别胶质瘤组织中可见 RSUME、HIF-1α、VEGF mRNA的表达,琼脂糖凝胶电泳发现在348 bp、80bp、240bp处分别可见 RSUME(A)、HIF-1α(B)、VEGF(C)、RT-PCR产物的清晰条带,周围无杂带(图1)。
2.2 RSUME、HIF-1α、VEGF mRNA在高、低级别胶质瘤及正常脑组织中的表达情况 RSUME mRNA表达水平:高级别胶质瘤为1.12±0.23,低级别胶质瘤为0.78±0.14,正常脑组织为0.51±0.06,3组比较有统计学差异(χ2=49.289,P<0.001),并且两组间比较均有统计学差异,即随胶质瘤恶性程度的增高,RSUME mRNA表达增高。HIF-1αmRNA表达水平:高级别胶质瘤为0.81±0.10,低级别胶质瘤为0.53±0.09,正常脑组织为0.27±0.08,3组比较有显著性差异(F=121.141,P<0.01),并且两组间比较均有统计学差异(P<0.01),即随胶质瘤恶性程度的增高,HIF-1αmRNA表达增高。VEGF mRNA表达水平:高级别胶质瘤为0.78±0.17,低级别胶质瘤为0.39±0.11,正常脑组织为0.19±0.05,3组比较有统计学差异(χ2=56.412,P<0.001),并且两组间比较均有统计学差异(P<0.01),即随胶质瘤恶性程度的增高,VEGF mRNA表达增高(表2)。
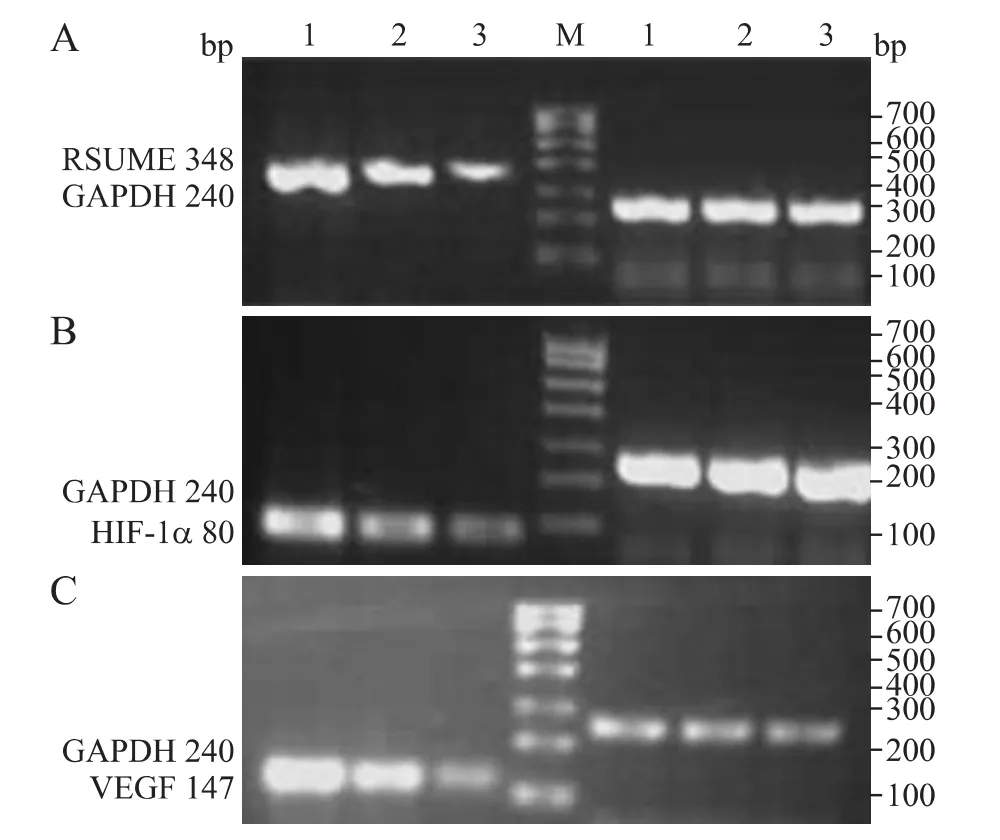
图1 RSUME(A)、HIF-1α(B)、VEGF(C)mRNA PCR产物琼脂糖凝胶电泳结果Fig.1 RT-PCR-amplified products of RSUME (A),HIF-1α(B)and VEGF(C)by agarose gel electrophoresis

表2 RSUME、HIF-1α、VEGF mRNA在高、低级别胶质瘤及正常脑组织中的表达情况Tab.2 Expressions of RSUME,HIF-1α,VEGF mRNA in gliomas and normal brain tissues
2.3 脑胶质瘤组织中 RSUME、HIF-1α、VEGF mRNA表达的相关性 脑胶质瘤组织中RSUME mRNA的表达与 HIF-1αmRNA的表达呈正相关(r=0.898 3,P<0.01,图2A);脑胶质瘤组织中RSUME mRNA的表达与 VEGF mRNA的表达呈正相关(r=0.898 3,P<0.01,图2B);脑胶质瘤组织中 HIF-1αmRNA的表达与 VEGF mRNA的表达呈正相关(r=0.959 9,P<0.01,图2C)。

图2 脑胶质瘤组织中RSUME、HIF-1α、VEGF mRNA的相关性Fig.2 The correlation among the expressions of RSUME mRNA,HIF-1αmRNA and VEGF mRNA in gliomas
2.4 SUMO-1、HIF-1α、VEGF蛋白在胶质瘤组织中的表达 SUMO-1蛋白主要定位于胶质瘤细胞核,HIF-1α蛋白主要定位于胶质瘤细胞核,VEGF蛋白主要定位于胶质瘤胞质和(或)胞膜(图3)。
2.5 SUMO-1蛋白在胶质瘤组织中的表达 35例高级别胶质瘤(Ⅲ~Ⅳ级)中阳性表达者为100%(35/35),其中高表达为85.71%(30/35),28例低级别胶质瘤(Ⅰ~Ⅱ级)中阳性表达为64.29%(18/28),其中高表达为10.71%(3/28);对应9例正常脑组织阳性表达者为11.11%(1/9),其中高表达为0(0/9)。正常脑组织、低级别胶质瘤、高级别胶质瘤间SUMO-1的表达有统计学差异(H=47.081,P<0.01,表3)。
2.6 HIF-1α在胶质瘤组织中的表达 35例高级别胶质瘤中阳性表达者为94%(33/35),28例低级别胶质瘤中阳性表达为53.57%(15/28),对应9例正常脑组织阳性表达者为0(0/9)。正常脑组织、低级别胶质瘤、高级别胶质瘤间HIF-1α的表达有统计学差异(H=44.073,P<0.01,表4)。
2.7 VEGF蛋白在胶质瘤组织中的表达 35例高级别胶质瘤中阳性表达者为91%(32/35),28例低级别胶质瘤中阳性表达为39.29%(11/28),对应9例正常脑组织阳性表达者为0(0/9)。正常脑组织、低级别胶质瘤、高级别胶质瘤间VEGF的表达有统计学差异(H=41.812,P<0.01,表5)。

表3 正常脑组织、低级别胶质瘤、高级别胶质瘤SUMO-1蛋白表达强度的比较Tab.3 Expression of SUMO-1protein in human gliomas andnormal brain tissues
2.8 SUMO-1、HIF-1α在脑胶质瘤表达的相关性经Spearman相关性分析,SUMO-1与HIF-1α在脑胶质瘤中的表达存在统计学差异(P<0.01)。两者呈明显正相关关系(r=0.857,表6)。
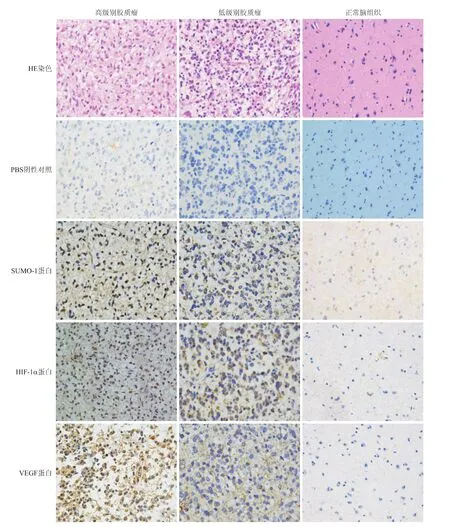
图3 SUMO-1、HIF-1α、VEGF在高、低级别胶质瘤组织及正常脑组织中的表达Fig.3 Expressions of SUMO-1,HIF-1αand VEGF protein in human gliomas and normal brain tissues by immunohistochemistry(×400)
2.9 RSUME表达对脑胶质瘤患者预后的影响Kaplan-Meier生存分析显示,RSUME低表达的胶质瘤患者的无进展生存期(PFS)为16.22月,高表达组PFS为30.19月,Log Rank单变量分析显示,RSUME低表达患者的PFS明显长于高表达组(χ2=36.032,P<0.01,图4)。
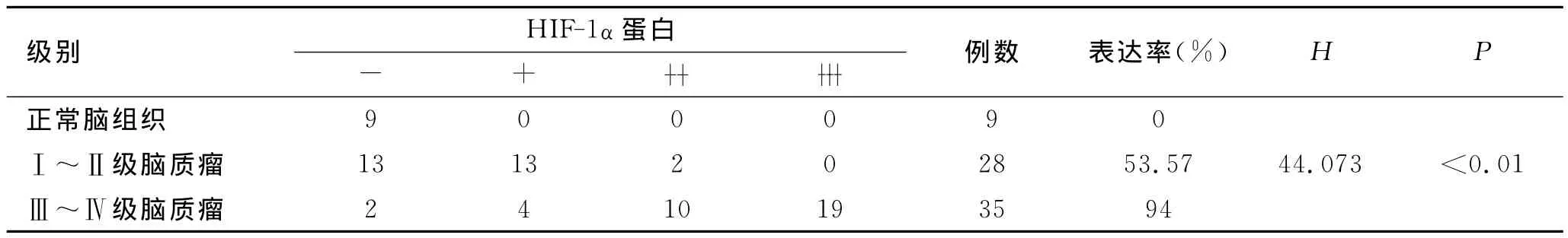
表4 正常脑组织、低级别胶质瘤、高级别胶质瘤HIF-1α蛋白表达强度的比较Tab.4 Expression of HIF-1αprotein in human gliomas and normal brain tissues

表5 正常脑组织、低级别胶质瘤、高级别胶质瘤VEGF蛋白表达强度的比较Tab.5 Expression of VEGF protein in human gliomas and normal brain tissues

表6 SUMO-1与HIF-1α在脑胶质瘤中表达的关系Tab.6 Correlation between the expressions of SUMO-1and HIF-1αin gliomas

图4 RSUME的表达水平对脑胶质瘤患者PFS的影响Fig.4 Effects of RSUME expression level on PFS in human gliomas
3 讨 论
脑胶质瘤的生长及恶性程度的增加需要足够的氧气供应,随着肿瘤的增长,肿瘤组织会处于缺氧状态,缺氧与许多生理和病理过程密切相关。肿瘤的生长、浸润和转移过程依赖于血管新生,依靠新生血管来提供营养(包括氧气)和排泄废物。在缺乏新生血管的情况下,肿瘤通常在长到几毫米后由于缺氧而停止生长[14]。细胞对低氧应激的直接反应之一是在细胞内积聚转录因子HIF-1,在细胞对环境条件的应答调节中发挥重要作用[15]。同时,HIF-1α也可通过调控下游靶基因,如血管内皮生长因子(vascular endothelial growth factor,VEGF)促进血管新生,血管的生成是脑胶质瘤发生侵袭的重要机制,VEGF是血管新生和生长的重要因子,其中VEGF的KDR受体能调控新生血管的生成[16-17]、Flk-1受体能增加血管腔化作用进而增加血管通透性[18-19]。本研究证实,在高级别胶质瘤中HIF-1α、VEGF蛋白及mRNA的表达均高于低级别胶质瘤及正常脑组织,提示胶质瘤的恶性程度与HIF-1α/VEGF通路密切相关。
SUMO分为SUMO-1、SUMO-2、SUMO-3三种蛋白亚型[20];SUMO化的作用首先需要泛素活化酶E1作用于SUMO-1,形成成熟的SUMO-1蛋白,然后与泛素结合酶E2(Ubc9)结合,最后通过泛素连接酶E3与靶蛋白结合,增强蛋白质底物的稳定性及活性[21]。与泛素化作用相反,SUMO并不引起蛋白降解,而是通过翻译后修饰,保护蛋白免受泛素化降解、影响细胞内的定位和蛋白与蛋白之间的相互作用[22-23]。RSUME是一种可促进蛋白小泛素化作用的基因片段[12];低氧、CoCl2诱导缺氧及热休克环境下可诱导RSUME的表达,poly-A RNA斑点膜的实验中发现[10],RSUME可在多个组织中表达,但在脑组织、心脏、肾脏、肝脏、胃、胰腺、前列腺和脾脏中表达较高。RSUME具有促进肿瘤生成、血管新生的能力[24]。研究发现[10-11],RSUME 可通过 SUMO 化促进肿瘤血管新生。RSUME不仅可促进SUMO化中Ubc9和SUMO-1相互的作用,并且还可以编码RWD结构域蛋白与SUMO化的底物HIF-1α结合形成二聚体,进一步促进底物SUMO化[25],可与HIF-1α序列中的泛素化位点Lys391和Lys477结合阻断蛋白质的泛素化-蛋白酶体降解途径,抑制HIF-1α的降解[26]。并且SHAN等[27]在垂体瘤细胞中证实,在缺氧环境下敲低RSUME的表达,能够明显抑制 HIF-1α的生成,证明 HIF-1α的生成需要RSUME的调控。本研究证实,随胶质瘤恶性程度增高,RSUME mRNA表达及其SUMO化程度增高,且RSUME与HIF-1α、VEGF的表达呈明显正相关。提示RSUME可能通过SUMO化的作用稳定、提高脑胶质瘤的血管生长因子HIF-1α及其下游基因VEGF,促进脑胶质瘤的增殖、侵袭。同时,RSUME与患者预后指标PFS密切相关,表明RSUME与胶质瘤的恶性程度及复发情况有关。
综上所述,人脑胶质瘤中RSUME能通过SUMO化调控HIF-1α/VEGF通路,增加人脑胶质瘤血管新生及肿瘤侵袭。进一步在胶质瘤细胞中调控RSUME的表达,进而观察胶质瘤细胞的增殖、迁移、侵袭等情况及验证其SUMO化与HIF-1α/VEGF的关系是我们进一步研究的重要方向。同时,缺氧诱导RSUME生成的机制有待进一步研究。RSUME作为一个新的脑胶质瘤发病机制的重要原因,与患者的预后密切相关,其深入的研究有望为胶质瘤的治疗提供新的靶点。
[1]ALVES TR,LIMA FR,KAHN SA,et al.Glioblastoma cells:a heterogeneous and fatal tumor interacting with the parenchyma[J].Life Sci,2011,89(15-16):532-539.
[2]NORDEN AD,DRAPPATZ J,WEN PY.Antiangiogenic therapies for high-grade glioma[J].Nat Rev Neurol,2009,5(11):610-620.
[3]CASTRO MG,CANDOLFI M,KROEGER K,et al.Gene therapy and targeted toxins for glioma[J].Curr Gene Ther,2011,11(3):155-180.
[4]DI BACCO A,OUYANG J,LEE HY,et al.The SUMO-specific protease SENP5 is required for cell division[J].Mol Cell Biol,2006,26(12):4489-4498.
[5]MARTIN S,NISHIMUNE A,MELLOR JR,et al.SUMOylation regulates kainate-receptor-mediated synaptic transmission[J].Nature,2007,447(7142):321-325.
[6]BUSCHMANN T,FUCHS SY,LEE CG,et al.SUMO-1 modification of Mdm2 prevents its self-ubiquitination and increases Mdm2 ability to ubiquitinate p53[J].Cell,2000,101(7):753-762.
[7]BAE SH,JEONG JW,PARK JA,et al.Sumoylation increases HIF-1alpha stability and its transcriptional activity[J].Biochem Biophys Res Commun,2004,324(1):394-400.
[8]KIM KI,BAEK SH.SUMOylation code in cancer development and metastasis[J].Mol Cells,2006,22(3):247-253.
[9]CARTER S,BISCHOF O,DEJEAN A,et al.C-terminal modifications regulate MDM2 dissociation and nuclear export of p53[J].Nat Cell Biol,2007,9(4):428-435.
[10]CARBIA-NAGASHIMA A,GEREZ J,PEREZ-CASTRO C,et al.RSUME,a small RWD-containing protein,enhances SUMO conjugation and stabilizes HIF-1alpha during hypoxia[J].Cell,2007,131(2):309-323.
[11]FOWKES RC,VLOTIDES G.Hypoxia-induced VEGF production‘RSUMEs’in pituitary adenomas[J].Endocr Relat Cancer,2012,19(1):C1-C5.
[12]FUERTES M,GEREZ J,HAEDO M,et al.Cytokines and genes in pituitary tumorigenesis:RSUME role in cell biology[J].Front Horm Res,2010,38:1-6.
[13]张艳,何炜,解智慧,等.VEGF在食管腺癌中的表达及其与临床预后的关系[J].西安交通大学学报:医学版,2014,35(1):104-107.
[14]HARRIS AL.Hypoxia--a key regulatory factor in tumour growth[J].Nat Rev Cancer,2002,2(1):38-47.
[15]COMERFORD KM,LEONARD MO,KARHAUSEN J,et al.Small ubiquitin-related modifier-1 modification mediates resolution of CREB-dependent responses to hypoxia[J].Proc Natl Acad Sci USA,2003,100(3):986-991.
[16]GRAY RT,O'DONNELL ME,MAXWELL P,et al.Longterm follow-up of immunocytochemical analysis of vascular endothelial growth factor (VEGF),and its two receptors,VEGF-R1(Flt-1)and VEGF-R2(Flk-1/KDR),in oesophagogastric cancer[J].Int J Biol Markers,2013,28(1):63-70.
[17]沈晓黎,邓志锋,祝新根,等.VEGF及其受体表达与垂体腺瘤血管生成和侵袭性的关系[J].中国微侵袭神经外科杂志,2011,16(3):132-135.
[18]HU X,XING L,WEI X,et al.Nonangiogenic function of VEGF and enhanced radiosensitivity of HeLa cells by inhibition of VEGF expression[J].Oncol Res,2012,20(2-3):93-101.
[19]BENDERRO GF,SUN X,KUANG Y,et al.Decreased VEGF expression and microvascular density,but increased HIF-1 and 2alpha accumulation and EPO expression in chronic moderate hyperoxia in the mouse brain[J].Brain Res,2012,1471:46-55.
[20]LI R,WEI J,JIANG C,et al.Akt SUMOylation regulates cell proliferation and tumorigenesis[J].Cancer Res,2013,73(18):5742-5753.
[21]RAPINO C,BIANCHI G,DI GIULIO C,et al.HIF-1alpha cytoplasmic accumulation is associated with cell death in old rat cerebral cortex exposed to intermittent hypoxia[J].Aging Cell,2005,4(4):177-185.
[22]MELCHIOR F.SUMO—nonclassical ubiquitin[J].Annu Rev Cell Dev Biol,2000,16:591-626.
[23]VERTEGAAL AC,OGG SC,JAFFRAY E,et al.A proteomic study of SUMO-2 target proteins[J].J Biol Chem,2004,279(32):33791-33798.
[24]何伟,王大鹏,沈晓黎.RSUME与垂体腺瘤侵袭性的分子机制研究进展[J].中国肿瘤临床,2014(14):942-944.
[25]GEREZ J,FUERTES M,TEDESCO L,et al.In silico structural and functional characterization of the RSUME splice variants[J].PLoS One,2013,8(2):e57795.
[26]CHAN JY,TSAI CY,WU CH,et al.Sumoylation of hypoxiainducible factor-1alpha ameliorates failure of brain stem cardiovascular regulation in experimental brain death[J].PLoS One,2011,6(3):e17375.
[27]SHAN B,GEREZ J,HAEDO M,et al.RSUME is implicated in HIF-1-induced VEGF-A production in pituitary tumour cells[J].Endocr Relat Cancer,2012,19(1):13-27.

