作物响应干旱胁迫应答的分子机制
李园园,陈永忠,罗秀云,田 云,卢向阳
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.国家油茶工程技术研究中心,湖南 长沙 410004;3.湖南省林业科学院,湖南 长沙 410004;4.湖南省农业生物工程研究所,湖南 长沙 410128)
Research Advances in Biosynthesis and Application of Pullulan
WANG Li-heng
(School of Biological and Environmental Engineering,Xi′an University,Xi′an 710065,China)
Abstract:Pullulan has a number of favorable properties such as good film-forming,non-toxicity,security and so on.Research status of biosynthesis of pullulan from Aureobasidium pullulans are reviewed.Application advances of pullulan in areas such as food processing,environmental protection,cosmetics are introduced. Drought as one kind of the important abiotic stress affects the growth,distribution and production of crops.Research on crop drought-resistance mechanism can help to drive the process of breeding drought-resistance crops.The mechanism of crop response to drought stress at the molecular level are reviewed,and the main ways of crop response to drought stress are illustrated,and the prospect of future research is pointed out.
10.3969/j.issn.1672-5425.2015.12.002
作物响应干旱胁迫应答的分子机制
李园园1,4,陈永忠2,3,罗秀云1,4,田云1,2,4,卢向阳1,4
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.国家油茶工程技术研究中心,湖南 长沙 410004;3.湖南省林业科学院,湖南 长沙 410004;4.湖南省农业生物工程研究所,湖南 长沙 410128)
摘要:干旱是影响作物生长发育、分布和产量的重要非生物胁迫之一,对作物抗旱机制的研究有助于推动作物的抗旱育种进程。从分子水平综述了作物响应干旱胁迫应答的机制,阐明了作物响应干旱胁迫应答的主要途径,并对该领域未来的研究进行了展望。
关键词:干旱胁迫;转录因子;脱落酸;分子机制
据报道,未来将有0.24亿~7亿人会因干旱带来的粮食短缺而迁移;到2030年,全球半数人口将生活在干旱环境中[1]。而我国自20世纪50年代以来,农作物平均受旱面积每年达0.2亿hm2,经济损失高达 2 000 亿元,且农业干旱面积逐年扩大,每年因旱灾减产250亿~300亿kg,占自然灾害损失总量的60%[2]。气候改变将带来更频繁的干旱,对作物的生长造成负面影响,因此,预防恶劣环境下的粮食短缺、培育有良好生产力的作物品种意义重大。
为适应干旱的环境,作物形成了避旱和耐旱两大主要策略。避旱是指作物在轻度或中度干旱条件下,通过调整形态结构和生长速度(如关闭气孔、卷叶、积累叶表面蜡质、加强水分吸收和储备能力、加快或减慢阶段过渡)来避免干旱的负面影响,维持正常的生理过程[3]。耐旱是指作物在严重干旱条件下,通过基因调节生理活动和代谢途径,维持一定的耐旱能力,以减少或修复干旱胁迫损伤[4]。
1作物响应干旱胁迫应答的形态学反应
作物根部从土壤中获得水分和营养物质的量直接影响作物地上部分的生长和产量。根长、根数目、根冠比可作为评判作物耐旱能力的标准。在干旱胁迫早期,为吸收深层土壤中的水分,作物根系生长旺盛,根的长度、数目和分布增加,同时,根的导管直径增大,耐旱能力增强。土壤水分严重缺失时,根伸长率降低、分化和形成层的形成及根尖生长减弱,耐旱能力减弱[5]。
作物响应干旱胁迫的形态和生理反应能减少水分流失、提高水分利用效率。水分严重缺失时,作物细胞膨压降低、叶子萎蔫,可防止多余水分的消耗。为提高耐旱能力,作物进化出小而厚的叶子、多毛的表皮、更小和更密集的气孔、较厚的角质层表皮和栅栏组织等旱生结构[6]。关闭气孔、显著降低最大叶面积和叶片数量也是作物响应干旱胁迫的反应。
2作物响应干旱胁迫应答的生理生化机制
面对干旱,作物形成了自身的生理生化响应机制,主要包括光合作用、渗透调节、活性氧(reactive oxygen species,ROS)去除和植物激素调节几个方面。
作物产量主要由光合作用决定,而光合作用受气孔CO2/H2O交换和光合活性调控。轻度干旱时,光合效率下降主要由气孔关闭、蒸腾减少造成;严重干旱时,叶绿体超微结构受损、光合色素总量减少、碳同化酶活性降低、膜脂过氧化加剧产生超氧自由基,导致光合效率降低[7]。
渗透调节是作物通过积累各种有机物质(脯氨酸、海藻糖、甜菜碱等)和无机物质(无机离子、多元醇、氨基酸等)、增大胞质浓度、降低渗透势、提高细胞保水能力来响应干旱胁迫。脯氨酸的强水合能力可维护蛋白质四级结构和膜的完整性,降低脂质膜氧化或光抑制;干旱使海藻糖迅速积累,从而抑制液态的磷脂双层膜转换成固态,稳定蛋白质和其它生物大分子的结构;甜菜碱有助于稳定酶的结构,对抗渗透损害,维持膜的完整性[8]。无机离子能调节液泡渗透势,保持细胞膨压,增强耐旱能力。
植物激素是调控干旱胁迫中不可缺少的一部分。其中,脱落酸(abscisic acid,ABA)与干旱关系最密切,它参与调控气孔的关闭、保卫细胞通道活动、转录钙调蛋白的表达。干旱时,抑制茉莉酸前体12-氧代酸转化成茉莉酸,可缩小气孔的孔径,促进气孔关闭,从而增强作物的耐旱能力[10]。乙烯参与气孔开、闭两个过程,可通过调控抗氧化类黄酮的积累来抑制气孔关闭,或通过促进NADPH氧化酶介导的ROS产生来促进气孔关闭[11]。干旱时,拟南芥植株内源一氧化氮含量升高,通过调控大量基因,如ABA受体(AtPYL4、AtPYL5)的表达,增强其耐旱能力[12]。
3作物响应干旱胁迫应答的分子机制
研究发现,作物响应干旱胁迫应答的分子机制[13-14]主要包括两条途径:ABA依赖途径和ABA不依赖途径,如图1所示。
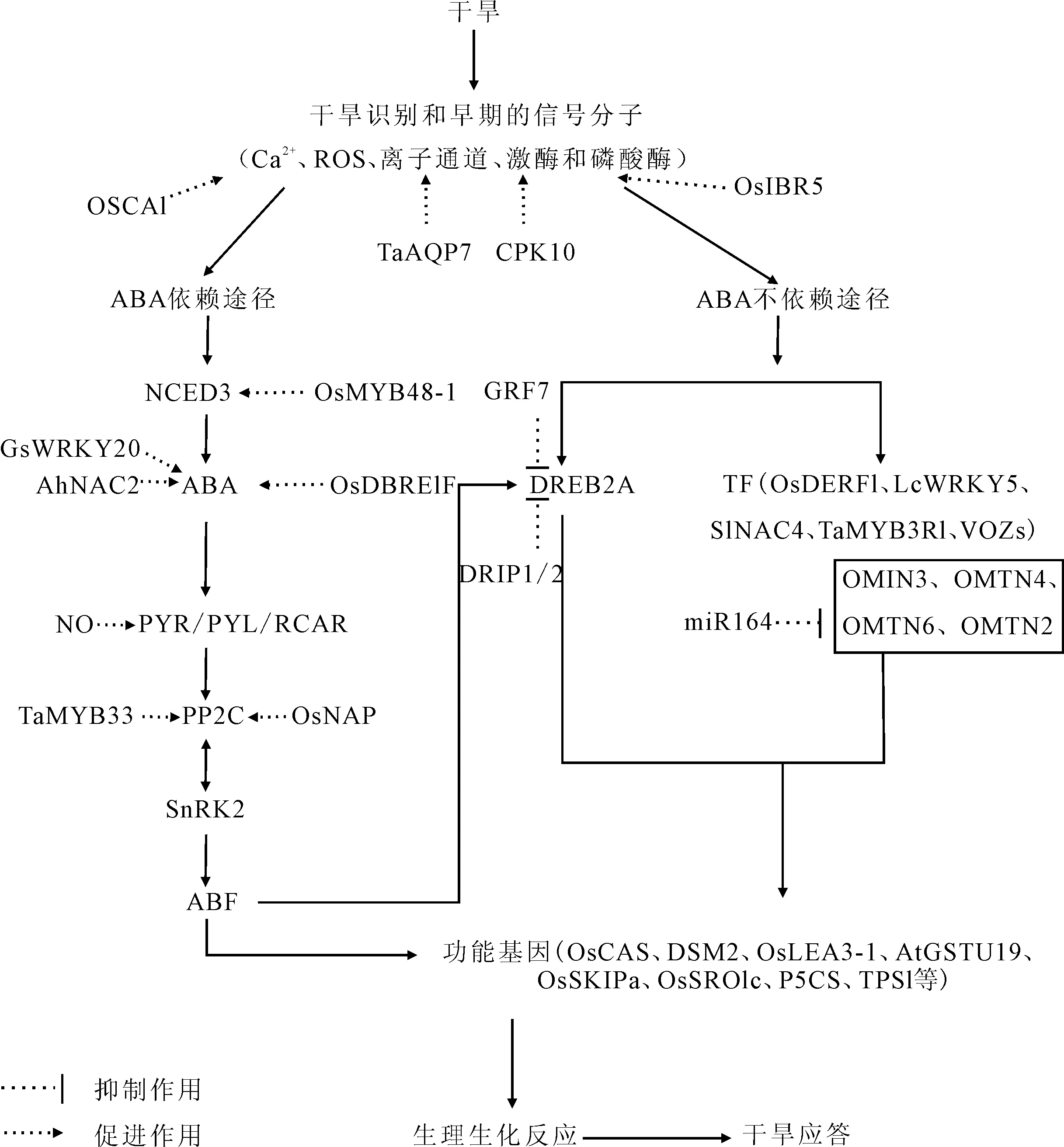
图1 作物响应干旱胁迫应答的分子机制Fig.1 Molecular mechanisms of crop response to drought stress
从图1可看出,ABA依赖途径中, 9-顺环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoid dioxygenase,NCED)为ABA生物合成的关键酶,拟南芥5个NCED编码基因中的NCED3受干旱诱导表达增加,合成或转运的ABA由受体复合物PYR/PYL/RCAR感知,并通过PP2C和SnRK2等将信号向下游传递[15]。在体外,通过ABA依赖或ABA不依赖途径,RCAR直接抑制PP2C的活性。有ABA时,PP2C通过磷酸化诱导SnRK2失活,抑制ABA信号途径;无ABA时,ABA识别并连接PYR/PYL/RCAR,从PP2C依赖负调控中释放SnRK2,磷酸化激活SnRK2下游蛋白,包括AREB/ABF TF。在ABA信号途径中,AREB/ABFs作为主要的转录激活因子调控ABRE相关基因的表达[13]。
ABA不依赖途径由脱水反应元件结合转录因子(dehydration responsive element binding protein,DREB)介导。其中,DREB2和DREB1/CBF介导ABA不依赖途径的信号通路。DREB能与抗逆基因启动子区域的DRE/CRT顺式作用元件特异性地结合,调节下游干旱胁迫响应基因的表达。在拟南芥8个DREB2中,DREB2A和DREB2B作为ABA不依赖途径信号通路的转录激活剂,被干旱高度诱导。正常条件下,DREB2A蛋白凭借C3HC4 环形域蛋白DRIP1(DREB2A互作蛋白)和DRIP2的DREB2A泛素化降解。Kim等[16]提出,生长因子GRF7与DREB2A短启动子区域互相影响,阻遏DREB2A转录。
3.1 上游信号分子
作物响应干旱胁迫早期的信号分子有Ca2+、ROS、离子通道、激酶和磷酸酶[13]。胞质膜蛋白OSCA1担当作物的渗透传感器。Yuan等[17]采用遗传筛选和物理图谱等方法,改变拟南芥植株渗透胁迫敏感性,发现OSCA1是人们长期寻找的、渗透胁迫激发的介导胞质Ca2+浓度增加的Ca2+通道。OSCA1形成一个非选择性的阳离子通道,干旱激活后在胞质膜上可通透Ca2+。OSCA1 突变体在渗透胁迫下影响保卫细胞和根细胞中的渗透性、减少水蒸腾和影响根的生长,为作物耐旱提供潜在的分子遗传学目标。
植物细胞中水通道蛋白(aquapofins,AQP)形成选择性的水运通道,在种子发芽、细胞生长、气孔运动和非生物胁迫响应过程中可调节水分快速的跨膜转运。烟草TaAQP7受聚乙二醇诱导上调,阻断ABA生物合成抑制,减少ROS积累和膜破坏,提高保水能力和抗氧化剂活性,使转基因烟草耐旱[18]。
钙依赖性蛋白激酶(calcium-dependent protein kinases,CPK)可以增强作物耐旱能力,不同作物的Ca2+依赖的信号过程不同。拟南芥CPK10正调节干旱胁迫,丧失CPK10基因功能的突变体对干旱胁迫过敏,而CPK10过表达的植株耐旱能力增强[19]。
丝裂原活化蛋白激酶磷酸酶充当丝裂原活化蛋白激酶信号通路重要的负调节因子,响应干旱胁迫的反应。Li等[20]通过构建载体、测定相对电导率等方式,发现水稻中OsIBR5受ABA和H2O2诱导表达,OsIBR5过表达的烟草植株气孔关闭显著降低,耐旱能力减弱。
3.2 转录因子(TF)
3.2.1参与ABA依赖途径的TF
据报道,大部分DREB TF参与ABA不依赖途径,只有小部分参与ABA依赖途径。OsDREB1F 过表达拟南芥中,RD29B(ABA响应基因)和RAB18的表达被激活,表明OsDREB1F可能参与ABA依赖途径[21]。
MYB TF家族通过干旱胁迫ABA依赖途径使其响应基因表达上调。水稻OsMYB48-1能调控部分ABA生物合成基因(OsNCED4)、干旱胁迫早期信号基因(OsPP2C68)和后期响应基因(OsLEA3)的表达,增强作物耐旱能力[22]。干旱时,拟南芥TaMYB33植株脯氨酸和抗坏血酸过氧化物酶活性增强,AtAAO3(ABA生物合成基因)的上调伴随着AtABF3、AtABI1(ABA信号途径成员)的下调,表明当信号受抑制时,ABA生物合成上调,耐旱能力增强[23]。
NAC TF作为植物特有蛋白,贯穿植物整个生命周期。AhNAC2(花生NAC TF)参与ABA信号途径,转基因拟南芥植株部分干旱胁迫相关基因的表达水平升高,耐旱能力增强[24]。许多干旱胁迫相关基因(OsPP2C06/OsABI2)及基因编码胁迫相关TF在遭受干旱的OsNAP(NAC TF)过表达水稻中表达上调[25]。
WRKY TF调控植物发育、代谢和胁迫响应。Luo等[26]采用大规模芯片等技术,发现野生大豆GsWRKY20参与胁迫响应,可抑制ABA诱导的种子萌发和幼苗生长,调节ABA介导的气孔关闭,正调节一组蜡质合成基因,使GsWRKY20 过表达植株较野生型表皮蜡质晶体增多,角质层增厚,叶绿素浸出率降低。
3.2.2参与ABA不依赖途径的TF
DREB TF在ABA不依赖途径中发挥中心作用,干旱诱导大豆GmDREB1B;1 过表达植株许多基因的表达增加。Kidokoro等[27]证实GmDREB1B;1的下游基因编码ABA受体家族蛋白GmPYL21,而GmDREB1B;1通过ABA不依赖途径直接激活GmPYL21的表达,增强ABRE介导的基因表达。
水稻OsDERF1(ERF TF)负调控脯氨酸生物合成关键酶Δ-吡咯啉-5-羧酸合成酶(OsP5CS)基因的表达,直接与ERF抑制因子OsERF3和OsAP2-39启动子的GCC框相互作用,水稻中OsERF3/OsAP2-39 过表达抑制乙烯的合成,提高对干旱的敏感程度[28]。
羊草LcWRKY5 TF包含一个保守的WD域,属于WRKY蛋白家族Ⅱ族。Ma等[29]指出LcWRKY5存在组织特异性,只在羊草根系和叶中表达,能被高盐和甘露醇显著诱导表达,不受ABA胁迫诱导,并通过调控DREB2A途径响应干旱胁迫。WRKY53减少H2O2含量,促进保卫细胞中淀粉的代谢,推动气孔关闭以响应干旱胁迫[30]。
SlNAC4作为干旱胁迫应答的TF,参与ABA不依赖途径的构成。SlNAC4能迅速而显著地被茉莉酸甲酯诱导表达,而不受ABA诱导,其在番茄果实成熟和类胡萝卜素积累中扮演重要角色。较高的蒸腾率使得SlNAC4干扰RNA转基因,植株叶绿素含量减少,耐旱能力减弱。SlNAC4还可以调节多种胁迫相关基因(如P5CS等)响应干旱胁迫[31]。
Cai等[32]通过体外实验表明,来自小麦的TaMYB3R1蛋白位于细胞核,能被外源ABA和非生物胁迫诱导表达。在拟南芥中,TaMYB3R1改变ABA不依赖响应基因(COR15A、ADH1、CBF4)的表达,影响干旱响应的ABA不依赖途径。转基因TaMYB3R1拟南芥植株气孔关闭增加,水分损失减少,蒸腾减少,耐旱能力增强。
拟南芥中的锌指蛋白(zinc-finger proteins)VOZs参与调节胁迫反应。正常生长条件下,在VOZ1VOZ2双突变体中许多胁迫响应基因的表达发生改变,耐旱能力增强。ABA诱导的转录因子CBF4的表达即使在正常条件下也显著增强,而内源ABA含量未发生改变,表明VOZs以ABA不依赖途径影响CBF4的表达[33]。
3.3 功能基因
在作物响应干旱胁迫的分子机制中,功能基因必不可少,可分为光合作用、渗透调节、抗氧化防御和植物激素调节4个方面。拟南芥胞外钙介导的气孔关闭主要由定位于叶绿体的钙敏感受体(CAS)调控。Zhao等[34]发现OsCAS通过减少细胞膜损害、增加渗透保护剂含量来维持较高的光合作用能力和更强的耐旱能力。DSM2(β-胡萝卜素羟化酶基因)编码叶绿体蛋白质,参与ABA前体玉米黄素的生物合成。DSM2 过表达水稻的叶黄素水平和非光化学猝灭增加,干旱和氧化胁迫耐受性增强[35]。
AtGSTU19,一个编码谷胱甘肽S-转移酶的基因,以组织特异性方式高度胁迫诱导和表达,影响干旱调节基因的表达水平,使转基因过表达植株耐旱性、种子发芽率和出苗率均提高[36]。另有OsSKIPa(Ski互作蛋白同源基因)和OsSRO1c(SNAC1的直接靶基因)通过控制ROS代谢和调节ROS动态平衡来调节作物耐旱能力[37]。
P5CS为脯氨酸合成的限速酶。转基因P5CS 过表达烟草植株中,脯氨酸产量提高,渗透保护物质的含量增加,耐旱能力增强。TPS1编码海藻糖-6-磷酸合酶(酵母中海藻糖生物合成的关键酶)。野生型和转基因TPS1植物中,多数与光合作用和碳水化合物代谢相关的基因表达下调,叶片中淀粉浓度低,而干旱条件下叶片中的脯氨酸含量则增加,导致TPS1 干旱耐受和敏感型马铃薯耐旱能力受到抑制[38]。
种子胚胎后期形成的晚期胚胎丰富蛋白(LEA)主要在脱水或外源性ABA处理后积累,对植物有保护作用。LEA3-1和RAB16C(LEA家族的一种)是ABA信号通路的下游基因,可以调控作物耐旱能力。Duan等[39]提出OsLEA3-1或OsLEA3-2的过表达水稻对增强耐旱能力有促进作用。
4作物响应干旱胁迫应答的表观遗传机制
表观遗传机制主要包括DNA甲基化、组蛋白修饰、染色体重塑和非编码 RNA 调控。通过调控基因表达来提高作物应答生物及非生物胁迫耐受性,作为逆境胁迫下表观遗传修饰的主要方式,为适应胁迫提供了新的见解。
表观遗传调控中研究最深入的是 DNA甲基化修饰。相对亲本,杂种中超甲基化或低甲基化的变化可充当干旱胁迫相关基因抑制或表达的指示器,有效地应用于干旱的筛选程序[40]。 DNA甲基化和组蛋白甲基化是通过互相依赖、互相影响的进程调控基因表达。组蛋白翻译后修饰的多种类型中,组蛋白乙酰化和甲基化研究较多。干旱时,水稻丙酮酸脱羧化酶1(PDC1) 和乙醇脱氢酶1(ADH1) 基因的 H3K4三甲基化、H3K9乙酰化的表达量升高相关;但这些修饰是暂时的,一旦除去胁迫因素,染色质又恢复到正常状态。
微RNA(microRNAs,miRNA)是一类重要的小分子调控RNA。许多miRNA在干旱胁迫下差异或特异表达,这些miRNA潜在靶基因有不同的功能,包括TF、胁迫响应蛋白和与纤维素生物合成相关的蛋白质[41]。水稻中miR164的6个靶向基因NAC(OMTN1~OMTN6)很保守,其中OMTN2、OM-TN3、OMTN4和OMTN6的过表达负调控生育阶段的耐旱能力,许多胁迫响应上调的基因在OMTN 过表达植株中被干旱胁迫诱导下调[42]。
5展望
干旱是影响作物生长发育、分布和产量的重要非生物胁迫之一,对作物抗旱机制的研究有助于推动作物的抗旱育种进程。目前,作物响应干旱胁迫应答的分子机制的研究仍有一定局限性,主要体现在:(1)对干旱受体的了解;(2)完善响应干旱胁迫的ABA的合成、受体、信号转导途径相关的TF和基因;(3)通过光合作用、渗透平衡、抗氧化机制、代谢调节,改善作物耐旱基因的表达;(4)干旱胁迫条件下,调控网络和信号网络的交联;(5)完善作物响应干旱胁迫应答机制,使得在干旱下,作物性能可以保持稳定和受到保护,以期解决将来人口增加和气候改变而引起的农作物生长和产量的问题。
参考文献:
[1]LOBELL D B,BURKE M B,TEBALDI C,et al.Prioritizing climate change adaptation needs for food security in 2030[J].Science,2008,319(5863):607-610.
[2]邱海军,曹明明,郝俊卿,等.1950~2010年中国干旱灾情频率-规模关系分析[J].地理科学,2013,33(5):576-580.
[3]TARDIEU F.Plant response to environmental conditions:Assessing potential production,water demand,and negative effects of water deficit[J].Front Physiology,2013,4:17.
[4]LUO L J.Breeding for water-saving and drought-resistance rice(WDR) in China[J].Journal of Experimental Botany,2010,61(13):3509-3517.
[5]SMITH S,de SMET I.Root system architecture:Insights from Arabidopsis and cereal crops[J].Philosophical Transactions of the Royal Society of London.Series B,Biological Sciences,2012,367(1595):1441-1452.
[6]HETHERINGTON A M,WOODWARD F I.The role of stomata in sensing and driving environmental change[J].Nature,2003,424(6951):901-908.
[7]井大炜,邢尚军,杜振宇,等.干旱胁迫对杨树幼苗生长、光合特性及活性氧代谢的影响[J].应用生态学报,2013,24(7):1809-1816.
[8]ASHRAF M,FOOLAD M R.Roles of glycine betaine and proline in improving plant abiotic stress resistance[J].Environmental and Experimental Botany,2007,59(2):206-216.
[9]MITTLER R,VANDERAUWERA S,SUZUKI N,et al.ROS signaling:The new wave?[J].Trends Plant in Science,2011,16(6):300-309.
[10]SAVCHENKO T,KOLLA V A,WANG C Q,et al.Functional convergence of oxylipin and abscisic acid pathways controls stomatal closure in response to drought[J].Plant Physiology,2014,164(3):1151-1160.
[11]WATKINS J M, HECHLER P J, MUDAY G K. Ethylene-induced flavonol accumulation in guard cells suppresses reactive oxygen species and moderates stomatal aperture[J]. Plant Physiol,2014,164(4):1707-1717.
[12]SHI H,YE T,ZHU J K,et al.Constitutive production of nitric oxide leads to enhanced drought stress resistance and extensive transcriptional reprogramming in Arabidopsis[J].Journal of Experimental Botany,2014,65(15):4119-4131.
[13]TODAKA D,SHINOZAKI K,YAMAGUCHI-SHINOZAKI K.Recent advances in the dissection of drought-stress regulatory networks and strategies for development of drought-tolerant transgenic rice plants[J].Frontiers in Plant Science,2015,6(84):1-20.
[14]GECHEV T S,BENINA M,OBATA T,et al.Molecular mechanisms of desiccation tolerance in the resurrection glacialrelic Haberlea rhodopensis[J].Cellular and Molecular Life Sciences,2013,70(4):689-709.
[15]RAGHAVENDRA A S,GONUGUNTA V K,CHRISTMANN A,et al.ABA Perception and signalling[J].Trends in Plant Science,2010,15(7):395-401.
[16]KIM J S,MIZOI J,KIDOKORO S,et al.Arabidopsis growth-regulating factor 7 functions as a transcriptional repressor of abscisic acid- and osmotic stress-responsive genes,including DREB2A[J].The Plant Cell,2012,24(8):3393-3405.
[17]YUAN F,YANG H,XUE Y,et al.OSCA1 Mediates osmotic-stress-evoked Ca2+increases vital for osmosensing in Arabidopsis[J].Nature,2014,514(7522):367-371.
[18]ZHOU S Y,HU W,DENG X M,et al.Overexpression of the wheat aquaporin gene,TaAQP7,enhances drought tolerance in transgenic tobacco[J].PLoS One,2012,7(12):e52439.
[19]ZOU J J,WEI F J,WANG C,et al.Arabidopsis calcium-dependent protein kinase CPK10 functions in abscisic acid- and Ca2+-mediated stomatal regulation in response to drought stress[J].Plant Physiology,2010,154(3):1232-1243.
[20]LI Y G,FENG D R,ZHANG D L,et al.Rice MAPK phosphatase IBR5 negatively regulates drought stress tolerance in transgenic Nicotiana tabacum[J].Plant Science,2012,188-189:10-18.
[21]WANG Q,GUAN Y,WU Y,et al.Overexpression of a rice OsDREB1F gene increases salt,drought,and low temperature tolerance in both Arabidopsis and rice[J].Plant Molecular Biology,2008,67(6):589-602.
[22]XIONG H Y,LI J J,LIU P C,et al.Overexpression of OsMYB48-1,a novel MYB-related transcription factor,enhances drought and salinity tolerance in rice[J].PLoS One,2014,9(3):1-13.
[23]QIN Y,WANG M,TIAN Y,et al.Over-expression of TaMYB33 encoding a novel wheat MYB transcription factor increases salt and drought tolerance in Arabidopsis[J].Molecular Biology Reports,2012,39(6):7183-7192.
[24]LIU X,HONG L,LI X Y,et al.Improved drought and salt tolerance in transgenic Arabidopsis overexpressing a NAC transcriptional factor from Arachis hypogaea[J].Bioscience Biotechnology and Biochemistry,2011,75(3):443-450.
[25]CHEN X,WANG Y F,LV B,et al.The NAC family transcription factor OsNAP confers abiotic stress response through the ABA pathway[J].Plant and Cell Physiology,2014,55(3):604-619.
[26]LUO X,BAI X,SUN X,et al.Expression of wild soybean WRKY20 in Arabidopsis enhances drought tolerance and regulates ABA signalling[J].Journal of Experimental Botany,2013,64(8):2155-2169.
[27]KIDOKORO S,WATANABE K,OHORI T,et al.Soybean DREB1/CBF-type transcription factors function in heat and drought as well as cold stress-responsive gene expression[J].The Plant Journal,2015,81(3):505-518.
[28]WAN L,ZHANG J,ZHANG H,et al.Transcriptional activation of OsDERF1 in OsERF3 and OsAP2-39 negatively modulates ethylene synthesis and drought tolerance in rice[J].PLoS One,2011,6(9):e25216.
[29]MA T,LI M L,ZHAO A G,et al.LcWRKY5:An unknown function gene from sheepgrass improves drought tolerance in transgenic Arabidopsis[J].Plant Cell Reports,2014,33(9):1507-1518.
[30]SUN Y D,YU D Q.Activated expression of AtWRKY53 negatively regulates drought tolerance by mediating stomatal movement[J].Plant Cell Reports,2015,34(8):1295-1306.
[31]ZHU M K,CHEN G P,ZHANG J L,et al.The abiotic stress-responsive NAC-type transcription factor SlNAC4 regulates salt and drought tolerance and stress-related genes in tomato(Solanum lycopersicum)[J].Plant Cell Reports,2014,33(11):1851-1863.
[32]CAI H, TIAN S, LIU C, et al. Identification of a MYB3R gene involved in drought, salt and cold stress in wheat (Triticum aestivum L.)[J]. Gene,2011,485(2):146-152.
[33]NAKAI Y,NAKAHIRA Y,SUMIDA H,et al.Vascular plant one-zinc-finger protein 1/2 transcription factors regulate abiotic and biotic stress responses in Arabidopsis[J].The Plant Journal,2013,73(5):761-775.
[34]ZHAO X,XU M M,WEI R R,et al.Expression of OsCAS(calcium-sensing receptor) in an Arabidopsis mutant increases drought tolerance[J].PLoS One,2015,10(6):e0131272.
[35]DU H,WANG N L,CUI F,et al.Characterization of the β-carotene hydroxylase gene DSM2 conferring drought and oxidative stress resistance by increasing xanthophylls and abscisic acid synthesis in rice[J].Plant Physiology,2010,154(3):1304-1318.
[36] XU J,TIAN Y S,XING X J,et al.Over-expression of AtGSTU19 provides tolerance to salt,drought and methyl viologen stresses in Arabidopsis[J].Physiologia Plantarum,2015,[Epub ahead of print].
[37]YOU J,ZONG W,LI X K,et al.The SNAC1-targeted gene OsSRO1c modulates stomatal closure and oxidative stress tolerance by regulating hydrogen peroxide in rice[J].Journal of Experimental Botany,2013,64(2):569-583.
[38] KONDRAK M,MARINCS F,ANTAL F,et al.Effects of yeast trehalose-6-phosphate synthase 1 on gene expression and carbohydrate contents of potato leaves under drought stress conditions[J].BMC Plant Biology,2012,12:74.
[39] DUAN J, CAI W. OsLEA3-2, an abiotic stress induced gene of rice plays a key role in salt and drought tolerance[J]. PLoS One,2012,7(9):e45117.
[40]HA M,NG D W K,LI W H,et al.Coordinated histone modifications are associated with gene expression variation within and between species[J].Genome Research,2011,21(4):590-598.
[41]XIE F L,STEWART C N,TAKI F A,et al.High-throughput deep sequencing shows that microRNAs play important roles in switchgrass responses to drought and salinity stress[J].Plant Biotechnology Journal,2014,12(3):354-366.
[42]FANG Y J,XIE K B,XIONG L Z.Conserved miR164-targeted NAC genes negatively regulate drought resistance in rice[J].Journal of Experimental Botany,2014,65(8):2119-2135.
Molecular Mechanisms of Crop Response to Drought Stress
LI Yuan-yuan1,4,CHEN Yong-zhong2,3,LUO Xiu-yun1,4,TIAN Yun1,2,4,LU Xiang-yang1,4
(1.College of Bioscience and Biotechnology,Hunan Agricultural University,Changsha 410128,China;
2.National Engineering Research Center for Oil-Tea Camellia,Changsha 410004,China;
3.Hunan Academy of Forestry,Changsha 410004,China;
4.Hunan Agricultural Bioengineering Research Institute,Changsha 410128,China)
中图分类号:Q 945.78
文献标识码:A
文章编号:1672-5425(2015)12-0003-06
作者简介:李园园(1991-),女,湖南浏阳人,硕士研究生,研究方向:生物学,E-mail:1396288156@qq.com;通讯作者:田云,教授,E-mail:tianyun79616@163.com;卢向阳,教授,E-mail:xiangyangcn@163.com。
收稿日期:2015-07-21
基金项目:国家油茶工程技术中心开放基金资助项目(2014CY03),高等学校博士学科点专项科研基金资助课题(博导类)(20134320110010),湖南省自然科学基金重点项目(13JJ2028),湖南省教育厅重点项目(13A041)

