低温诱导红鳍东方鲀雄性化及性腺分化的组织学观察
周贺,李佳奇,马海艳,李雅娟,姜志强,李霞,徐雯,江振华
(1.大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023;2.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
红鳍东方鲀Takifugu rubripes是鲀形目中最名贵的海水鱼类[1],在中国主要分布于黄海、渤海和东海,国外多见于朝鲜半岛和日本[2]等海域。研究表明,红鳍东方鲀的肌肉、嘴、精巢无毒,而且精巢在日本作为高级食材,价格十分昂贵,雄性河鲀价格比雌性河鲀高1.5~2.0倍[3]。正常情况下,河鲀雌、雄比为1∶1,也就是说养殖生产中50%的生殖腺 (卵巢)不能食用。而且,红鳍东方鲀雌鱼的生殖腺指数较高,繁殖期卵巢最高可占鱼体质量的20%~30%,这样可食用的部分极低。目前,在生产上推广全雄性红鳍东方鲀养殖,可大幅度提高精巢产量,提高养殖企业的经济效益达50%以上,其成果具有重要的学术意义和应用价值。
关于利用温度处理诱导鱼类雄性化曾有一些报道。Desprez等[4]研究表明,蓝色罗非鱼Oreochromis aureus在34℃时孵化,后代雄性比例高达97.8%。尼罗罗非鱼O.nilotica在高温34~37℃时孵化,也产生较高的雄性率,而莫桑比克罗非鱼O.mossambica则在低温19℃或20℃时孵化,能增加雄鱼的比例[5]。海鲈Dicentrarchus labrax在正常温度 (25℃)下孵化时,其性比偏向雄性,而在性腺发育易变期内经15℃低温处理会产生全雄群体[6]。Goto等[7]采用高温诱导处于性别分化期的条斑星鲽Verosper moseri,也获得了100%的雄性率。关于红鳍东方鲀低温诱导雄性化方面的研究,仅见日本近畿大学报道了通过低温培育成功获得了80%的雄性后代,但存在生长速度慢及未能达到100%全雄性后代等问题[3]。
国内外对红鳍东方鲀的遗传育种方面的研究报道较少。日本在遗传连锁图谱、抗虫、种间杂交、雄性化等方面进行了系统报道[3],Matsuura等[8]和Suzuki等[9]对红鳍东方鲀的早期性分化和性腺发育进行了研究;中国开展此方面的研究较晚,只是近几年在核型[10]、三倍体育种[11]、遗传多样性[12-13]、生化遗传变异[14]等方面有零星报道。但关于红鳍东方鲀低温诱导雄性化及不同温度处理后性腺分化及组织学变化的研究目前尚未见报道。本研究中,采用低温诱导雄性化技术,对红鳍东方鲀后代的早期性腺分化进行分析,旨在探索出简单、安全、易操作的鱼类雄性化新途径,为低温诱导全雄红鳍东方鲀的研究提供基础资料。
1 材料与方法
1.1 材料
试验用红鳍东方鲀稚鱼鱼苗取自辽宁省富谷水产有限公司。选择体表无伤、活动情况良好、大小相近的个体用于试验。
1.2 方法
1.2.1 低温处理 分别在孵化后15、45、75 d运至大连海洋大学农业部重点实验室,将鱼苗放入控温水箱 (75 cm×45 cm×55 cm)中,分别控制水温在15、17℃,以正常水温21℃为对照,每组设2个平行组,每个平行组放入200尾鱼苗,水箱中保持流水状态且水温恒定,并利用充气泵持续供氧。在各温度条件下培育65 d,然后将水温控制在21℃左右开始饲养。
1.2.2 红鳍东方鲀性别比例的检测 经低温处理结束后,从孵化后45 d和75 d试验组以及对照组随机抽取25~35尾鱼苗,用乙醚将鱼麻醉,解剖取出性腺,用Bouin氏液固定,进行石蜡切片、苏木精-曙红 (H.E)染色,在显微镜下观察各温度条件下性腺细胞学特征并确定其性别,同时统计样本的雌、雄比例。
1.2.3 性腺组织学切片与观察 从孵化后15 d的低温处理试验组中取样,每3 d取样一次,每次取样5尾。一个月后,每5 d取样一次,每次取样5尾。仔鱼平均体长在1.0 cm以下,取整条;平均体长在1.0~2.0 cm时,取躯干部分;平均体长在2.0~4.0 cm时,除去腹壁皮肤,暴露性腺,与部分躯干一同固定;平均体长在4 cm以上时,只取性腺进行固定。各样品均在Bouin氏液中先固定24 h后 (样品体积不超过 Bouin氏固定液体积的1/20),再转入体积分数为70%的乙醇溶液中保存。将固定的样品分别用梯度酒精脱水、二甲苯透明、常规石蜡包埋,连续切片,切片厚度为6~7 μm,采用H.E染色,用中性树胶封片,在Olympus AH2下观察并显微摄影。
1.3 数据处理
采用SPSS 19.0软件对测量数据进行单因素方差分析 (One-Way ANONA),用Duncun法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 温度与红鳍东方鲀性别比例的相关分析
从表1可见:在15、17、21℃条件下,红鳍东方鲀的雄性率为51.57% ~74.70%;在孵化后45 d,15℃试验组的雄性率最高,但仅于21℃组有显著性差异 (P<0.05);在孵化后75 d,15℃试验组的雄性率仍为最高,且显著高于其他两组(P<0.05),17℃组也显著高于 21℃组 (P<0.05)。

表1 红鳍东方鲀在15、17、21℃条件下的雌、雄性比例Tab.1 Proportions of female and male in redfin puffer Takifugu rubripes reared at 15,17 and 21℃
从表2可见,温度、雄性率和雌性率三者之间的相关性均极显著 (P<0.01),其中,温度与雄性率的相关系数为-0.827,呈极显著负相关 (P<0.01),而温度与雌性率的相关系数为0.823,呈极显著正相关 (P<0.01)。结果显示,温度对红鳍东方鲀的雄性比例有抑制作用。

表2 温度与红鳍东方鲀性别比例的相关系数Tab.2 Correlations between temperature and sexual ratio in redfin puffer Takifugu rubripes
2.2 红鳍东方鲀的性腺分化与发育
2.2.1 原始性腺的发育 孵化后23 d,21℃条件下,稚鱼 (体长5.4~7.5 mm)中肾管下方、直肠上方、肠管边缘处发现有椭圆状的原始生殖细胞,没有被膜包裹,体积较大,直径为6~7 μm,细胞核明显,细胞质呈弱嗜碱性,染色很浅,核嗜碱性,呈深紫色,大且透亮,核膜清晰,核仁偏位(图1-A);17℃条件下,稚鱼 (体长4.1~6.2 mm)细胞分裂缓慢,中肾管下方出现少数生殖细胞 (图1-B);15℃条件下,稚鱼 (体长3.3~3.9 mm)中肾管下方可以清晰地看到直肠,但在肠管边缘未发现原始生殖细胞 (图1-C)。
孵化后33 d,21℃条件下,幼鱼 (体长7.1~8.9 mm)中肾管下方沿体腔膜基部向腹部伸出一突起——生殖嵴,之中含有少数原始生殖细胞,两者共同构成性腺原基 (图1-D);17℃条件下,幼鱼 (体长 5.3~7.0 mm)性腺中出现性腺原基,但内含原始生殖细胞数量少于21℃条件下 (图1-E);15℃条件下,幼鱼 (体长4.2~5.0 mm)性腺中观察到原始生殖细胞 (图1-F)。
孵化后43 d,21℃条件下,幼鱼 (体长9.1~10.5 mm)性腺中性腺原基明显增大,内部出现大量上皮生殖细胞,原始生殖细胞与上皮生殖细胞共同构成原始性腺,此时仍不能明显分辨精巢、卵巢(图1-G);17℃条件下,幼鱼 (体长6.1~7.8 mm)性腺中观察到明显原始性腺 (图1-H);15℃条件下,幼鱼 (体长4.2~5.0 mm)中肾管下方出现性腺原基 (图1-I)。
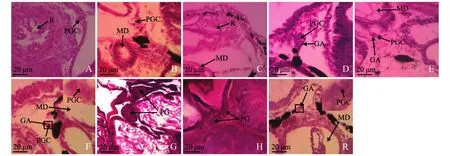
图1 不同温度下红鳍东方鲀的原始性腺发育Fig.1 Primordial gonadal development of redfin puffer Takifugu rubripes at different temperature
2.2.2 卵巢的分化 21℃条件下,孵化后43 d,幼鱼 (体长9.1~10.5 mm)部分原始性腺发育缓慢,仍呈梨状,另一部分原始性腺呈橄榄状,其原始生殖细胞进行有丝分裂,数量明显增加,与肠壁形成闭合结构,开始出现卵巢腔 (图2-A)。孵化后48 d,幼鱼 (体长9.3~10.6 mm)原始生殖细胞继续增多,性腺中间处有细小缝隙出现,即原始卵巢腔 (图2-B)。58 d,幼鱼 (体长14.3~15.9 mm)性腺的卵巢腔十分明显,大量原始生殖细胞正在进行有丝分裂,细胞数量增多,在生殖上皮附近出现Ⅰ时相卵原细胞。Ⅰ时相卵原细胞呈圆形,嗜碱性,为浅紫色。期间卵原细胞大量分裂,此过程中性腺组织无明显变化,只是体积不断增大(图2-C)。88 d,幼鱼 (体长27.4 ~29.6 mm)卵原细胞开始向卵巢腔内部进行增殖,出现原始的卵巢小叶 (图 2-D)。103 d,幼鱼 (体长 70.6~88.1 mm)卵巢发育完全,卵巢小叶呈辐射状排列,卵巢中可以同时看到卵原细胞和卵母细胞,标志着卵巢细胞学上分化的开始 (图2-E)。
17℃条件下,幼鱼发育略慢于21℃条件下,孵化后63 d,幼鱼 (体长18.2~21.3 mm)出现明显的卵巢腔和卵原细胞 (图2-F)。103 d,幼鱼(体长40.2~46.4 mm)出现清晰的卵巢小叶,细胞分裂快速,性腺不断增大 (2-G)。123 d,幼鱼(体长50.1~56.4 mm)经过卵原细胞大量分裂,性腺不断发育,能看到卵巢小叶上有少量卵母细胞出现 (图2-H)。
15℃条件下,幼鱼发育明显缓慢,孵化后73 d,幼鱼 (体长18.4~19.9 mm)才出现明显的卵巢腔和卵原细胞 (图2-I)。143 d,幼鱼 (体长55.9~63.4 mm)有明显的卵巢小叶,卵巢小叶上有大量的卵原细胞和少量卵母细胞 (图2-J)。
2.2.3 精巢的分化 孵化43 d之后,精巢发育明显晚于卵巢。原始性腺细胞的有丝分裂几乎处于静止状态,没有出现任何缝隙 (图3-A)。
21℃条件下,孵化后 68 d,幼鱼 (体长21.3~24.5 mm)性腺中才可观察到在生殖腺柄部出现裂缝状的输精管原基,此结构标志着该性腺向精巢方向分化 (图 3-B)。93 d,幼鱼 (体长28.4~30.6 mm)精巢内精原细胞分裂迅速,数量增加,精小叶明显,结构清晰可见,至此精巢完成了第Ⅰ期的分化 (图3-C)。113 d,幼鱼 (体长75.6~93.1 mm)精小叶之间紧密排列,彼此之间充满结缔组织,精小叶内还可以看到大量的精原细胞和初级精母细胞 (图3-D)。
17℃条件下,孵化后 83 d,幼鱼 (体长25.1~27.4)性腺中才观察到输精管原基 (图3-E)。98 d,能观察到精小叶和少量精原细胞(图3-F)。113 d,幼鱼 (体长 54.2 ~66.8 mm)的精小叶发育明显,精原细胞大量分裂,性腺明显增大 (图3-G)。
15℃条件下,幼鱼发育较21℃条件下缓慢,几乎停滞。孵化后93 d,幼鱼 (体长19.3~21.4 mm)性腺中仅能观察到不十分明显的精小叶 (图3-H),由于试验设计,取样时期较短,并没有样本观察到初级精母细胞的出现。
3 讨论
3.1 温度对红鳍东方鲀性别比例的影响
研究表明,鱼类的性别决定和分化机制多种多样,总体来说可以分为基因型性别决定 (genetic sex determination,GSD)和环境型性别决定 (environmental sex determination,ESD)两种类型。ESD指子代的性别主要由环境因子决定,精卵所处环境的温度、湿度、pH和一些不确定的因素均有可能影响到子代的性别。已有报道表明,多种鱼类的性腺分化方向受到温度影响,鱼类的温度依赖型性别决定 (temperaturedependentsexdetermination,TSD)最早在爬行动物中被发现。Witschi在高温32℃下培育美洲林蛙的蝌蚪,发现有雄性化的趋势[15]。而且对于性别比例的影响在多种硬骨鱼类中都有报道[16-19],在多数鱼类中,如银汉鱼Atherinid、丽鱼科 Cichlids、金鱼 Carassius auratus和鲶形目Siluriform,低温能引起雌性分化,高温能导致雄性比例升高。泥鳅Misgurnus anguillicaudatus和大鳞副泥鳅Paramisgurnus dabryanus胚胎在20~30℃时发育,随着温度的升高雄性率明显提高,最高可达80%以上[20]。但是在少数鱼类中,如鲈,高温能诱导雌性率,而低温能使雄性率升高[16]。服部亘宏等[21]报道,孵化后2~3周开始低温培育红鳍东方鲀苗种,可以显著提高稚鱼的雄性比例。本研究中,雄性化比例随温度的降低而升高。在21℃条件下,雄性率最高为51.57%±0.06%,在17℃条件下,雄性率最高为59.60%±3.49%,在15℃条件下,雄性率最高可达到74.70%±2.79%。将孵化后不同时期的鱼苗在相同温度下进行培育,对鱼苗的雄性率没有呈现出相同的上升或下降趋势。15℃条件下,孵化后45 d对鱼苗进行培育的雄性率为 (64.38%±4.62%),低于孵化后75 d开始培育鱼苗的雄性率(74.70%±2.79%)。而17℃条件下,孵化后45 d培育鱼苗的雄性率 (59.60%±3.49%)和 75 d培育鱼苗的雄性率 (58.34%±0.40%)几乎相同。在本试验过程中还发现,在孵化后15 d对鱼苗进行低温处理,对鱼苗的摄食量和活动能力有很大影响,且容易发生病变,使成活率极低。同时,通过石蜡组织切片对鱼苗样本进行生理性别的鉴定发现,低温可以提高红鳍东方鲀雄性化率,与服部亘宏等[21]的研究结果一致。但对于是否发生性逆转需要今后进行遗传性别鉴别。

图2 不同温度下红鳍东方鲀的卵巢分化Fig.2 Ovarian differentiation of radfin puffer Takifugu rubripes at different temperature
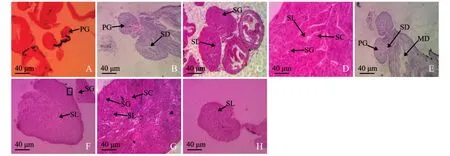
图3 不同温度下红鳍东方鲀的精巢分化Fig.3 Testis differentiation of radfin puffer Takifugu rubripes at different temperature
3.2 红鳍东方鲀性腺的分化方式
鱼类的性别分化一般分为雌雄异体、雌雄同体和兼性3种类型。Yamamoto[22]根据文献将雌雄异体型分为两种,一是分化型雌雄异体型,即在早期的性腺发育过程中未分化性腺,直接发育为精巢或卵巢,如大鳞副泥鳅[23]、鲤 Cyprinus carpio[24]等;二是未分化型雌雄异体型,即未分化性腺先分化为卵巢状结构,然后在半数左右个体中卵巢状结构退化而精巢结构出现,如斑马鱼 Danio rerio[25]等。本研究中,红鳍东方鲀早期性腺发育过程中,半数左右个体未分化性腺直接发育为卵巢,另外半数个体则直接发育为精巢,因此,红鳍东方鲀的性腺分化属于分化型雌雄异体型,与Matsuura等[8]的研究结果一致。
3.3 红鳍东方鲀性腺发育的低温处理时间
对大多数鱼类的研究发现,影响性腺早期分化方向的有效温度处理时间应该在组织学性腺分化之前,或者与组织学性腺分化同时[26-27]。研究通过控制温度诱导红鳍东方鲀全雄化,必须了解红鳍东方鲀的性腺分化的过程和规律,以掌握温度处理的最适时机。尽管可能因为生活空间、种群密度和食物的可得性等条件差异而造成不同试验结果有所差异,但根据对红鳍东方鲀性腺早期发育进行的预备试验发现,红鳍东方鲀适宜生长温度为14~27℃。高温环境下容易发生病变,如饵料易变质,污染水质;而低温环境下鱼体活动能力下降,摄食量下降,转换饵料时会出现大量死亡现象,在低于13℃时,鱼苗几乎停止生长。因此,本试验中设计15、17、21℃ 3个温度,为了保证试验准确性,培育过程中水温变化在1℃以内。本试验过程中,从孵化后45 d、75 d分别进行温度控制,从温度处理开始后各自培育65 d,之后在21℃条件下继续养殖。从鱼苗的生长情况和组织学观察来看,温度的设置比较合理。
3.4 温度对红鳍东方鲀性腺早期分化的影响
温度通过影响性腺发育的方向而间接决定鱼类的性别,Desprez等[4]认为,在低温环境下,体积小的鱼比体积大的鱼耐受性要低。雌鱼的生长速度要比雄鱼快,更容易受低温环境的影响。田永胜等[28]研究表明,高温可以促进半滑舌鳎Cynoglossus semilaevis生殖细胞的增殖和卵母细胞的发育,致使雌性比例升高。本研究中发现,孵化后23 d,在15℃条件下的试验组样品中还未观察到原始生殖细胞,且之后性腺发育也明显慢于其他两组。17℃试验组样本性腺中细胞分裂速度明显缓慢,发育到同一阶段的性腺之间相比较,可以看出,低温组性腺较小,细胞数量少于高温试验组。精巢的发育过程中也有相似的情况。试验中孵化后的鱼苗,在温度环境不同的条件下培育,结果造成了性腺发育快慢的明显不同。可见,在适当温度范围内,温度的提高有助于细胞的分裂,推动性腺的发育和分化。
[1]何亚,王华,王伟,等.温度对不同体质量红鳍东方鲀幼鱼耗氧率和排氨率的影响[J].大连海洋大学学报,2014,29(5):481-485
[2]姜志强.,吴立新,郝拉娣,等.海水养殖鱼类生物学及养殖[M].北京:海洋出版社,2004:61.
[3]鈴木譲.ゲノム育種によりトラフグの新品種作出をめざす[J].生物機能開発研究所紀要,2010,10:9-23.
[4]Desprez D,Melard C.Effect of ambient water temperature on sex determination in the blue tilapia Oreo-chromis aureus[J].Aquaculture,1998,162:79-84.
[5]范兆廷.水产动物育种学(修订版)[M].北京:中国农业出版社,2013:175.
[6]桂建芳.鱼类性别和生殖的遗传基础及其人工控制[M].北京:科学出版社,2007:51.
[7]Goto R,Tatsunari M,Kawamata K,et al.Effects of temperature on gonadal sex determination in barfin flounder(Verasper moseri)[J].Fisheries Science,1999,65:884-887.
[8]Matsuura S,Naito T,Shincho M,et al.Gonadal sex differentiation in tiger puffer,Takifugu rubripes[J].Suisanzoshoku,1994,42(4):619-625.
[9]Suzuki N,Okada K,Kamiya N.Gonadal development,sexual differentiation and sex ratio of tiger puffer,Takifugu rubripes[J].Bulletin of the Nansei National Fisheries Research Institute(Japan),1996,29(2):39-48.
[10]舒琥,蔡晓阅,刘锋,等.鲀形目3种鱼的染色体组型分析[J].动物学杂志,2010,45(2):101-106.
[11]王茂林,姜志强,李荣.红鳍东方鲀三倍体诱导的初步研究[J].水产科学,2006,25(7):349-352.
[12]郝君,孙效文,孟雪松.红鳍东方鲀微卫星DNA多态性初步分析[J].上海水产大学学报,2006,15(1):21-24.
[13]崔建洲,申雪艳,杨官品,等.红鳍东方鲀基因组微卫星特征分析[J].中国海洋大学学报,2006,36(2):249-254.
[14]陈艳翠,高天翔,陈四清,等.红鳍东方鲀养殖群体生化遗传变异初步研究[J].海洋水产研究,2007,28(4):14-20.
[15]李桑,尤永隆,林丹军,等.泽蛙的性腺分化及温度对性别决定的影响[J].动物学报,2008(2):271-281.
[16]Blazquez M,Zanuy S,Carillo M,et al.Effects of rearing temperature on sex differentiation in the European sea bass(Dicentrar-chus labrax L.)[J].Journal of Experimental Zoology Part B:Molecular and Developmental Evolution,1998,281:207-216.
[17]Craig J K,Foote C J,Wood C C.Evidence for temperature-dependent sex determination in sockeye salmon(Oncorhynchus nerka)[J].Canadian Journal of Fisheries and Aquatic Sciences,1996,53:141-147.
[18]Strssmann C A,Moriyama S,Hanke E F,et al.Evidence of thermolabile sex determination in pejerrey[J].Journal of Fish Biology,1996,48:643-651.
[19]Patino R,Davis K B,Schoore J E,et al.Sex differentiation of channel catfish gonads:normal development and effects of temperature[J].Journal of Experimental Zoology Part B:Molecular and Developmental Evolution,1996,276:209-218.
[20]南平,杜启艳,燕帅国,等.温度对泥鳅和大鳞副泥鳅性腺分化的影响和CYP19a基因的克隆与时空表达[J].中国水产科学,2005,12(4):408-412.
[21]服部亘宏,宮下盛,澤田好史.トラフグ養殖における雄の優占生産[J].日本水産学会誌,2012,78(1):87.
[22]Yamamoto T.Sex differentiation[M]//Fish Physiology(Vol.III).New York:Academic Press,1969:17-117.
[23]史改花,杜启艳,张晓亚,等.大鳞副泥鳅性腺发生和分化的组织学研究[J].河南师范大学学报,2008,36(6):163-166.
[24]Komen J,De Boer P,Richter J J.Male sex reversal in gynogentic XX females of common carp(Cyprinus carpio L.)by a recessive mutation in a sex-determining gene[J].Hered,1992,83(6):431-434.
[25]Maack G,Segner H.Morphological development of the gonads in zebrafish[J].Journal of Fish Biology,2003,62(4):895-906.
[26]Baroiller J F,D'Cotta H.Environment and sex determination in farmed fish[J].Comparative Biochemistry and Physiology Part C:Toxical Pharmacol,2001,130(4):399-409.
[27]Strussmann C A,Saito T,Usui M,et al.Thermal thresholds and critical period of thermolabile sex determination in two atherinid fishes,Odontesthes bonariensis and Patagonina hatcheri[J].Journal of Experimental Zoology Part A:Comparative Experimental Biology,1997,278(3):167-177.
[28]田永胜,汪娣,徐营,等.温度对半滑舌鳎家系生长及性别的影响[J].水产学报,2011,35(2):176-183.

